bílkovina katalyzující biochemické reakce From Wikipedia, the free encyclopedia
Enzym je jednoduchá či složená bílkovina[pozn. 1] s katalytickou aktivitou. Enzymy určují povahu i rychlost chemických reakcí a řídí většinu biochemických procesů v těle všech živých organismů včetně člověka. Věda o enzymech se jmenuje enzymologie a rozvíjí se zejména od 19. století, kdy si lidé začali všímat procesů, k nimž dochází např. při trávení potravy. Základní složkou enzymů jsou proteiny, na něž se velmi často vážou další přídatné molekuly známé jako kofaktory nebo prostetické skupiny, které se podílí na katalýze. Samotná enzymatická reakce probíhá obvykle v tzv. aktivním místě enzymu. Enzymů je obrovské množství a je možné je klasifikovat do sedmi skupin: oxidoreduktázy, transferázy, hydrolázy, lyázy, izomerázy, ligázy a od roku 2018 i translokázy. Všechny mají společnou katalytickou funkci; vedou reakci jinou reakční cestou, čímž umožňují energeticky méně náročný průběh reakce. Enzymy obecně jsou výrazně specifické a obvykle přeměňují jeden nebo několik málo substrátů, a to jedním definovaným způsobem. Aktivita enzymů, spočívající v ovlivnění rychlosti chemických reakcí snižováním jejich aktivační energie, je závislá zejména na koncentraci substrátu, teplotě, pH a přítomnosti aktivátorů a inhibitorů. Celá řada enzymů již našla praktické využití i v průmyslu a ve výzkumu.


Vědu o enzymech nazýváme enzymologie. Na přelomu 18. a 19. století již existovalo povědomí o procesech, jako je trávení masa žaludeční šťávou[1] nebo rozklad škrobu na jednoduché cukry účinkem slin. Skutečný průběh těchto jevů však byl zahalen tajemstvím a např. pepsin byl objeven až ve století devatenáctém.[2] Velký pokrok v tomto směru představují výzkumy slavného mikrobiologa L. Pasteura, který si povšiml, že pouze živé čerstvé kvasinkové buňky jsou schopné kvasit cukry na alkohol a že tedy tato schopnost je zřejmě nějakým výlučným rysem živých organismů.[3] V té době se však biokatalyzátorům neříkalo enzymy, nýbrž fermenty, protože byly činěny zodpovědnými za rozkladné fermentační procesy v přírodě.[4] V roce 1877 německý fyziolog Wilhelm Kühne poprvé použil slovo „enzym“, které pochází z řeckého ενζυμον, tedy „v kvasinkách (v kvásku, v droždí)“.[pozn. 2] Slovo však bylo v dnešním moderním smyslu používáno až později. O dvacet let později si Eduard Buchner povšiml, že pro kvašení cukru stačí jen kvasinkový extrakt, který zřejmě obsahuje enzym, jenž toto kvašení umožňuje (on tuto látku označoval jako „zymáza“). Za tyto výzkumy mu také bylo udělena Nobelova cena za chemii.[6][7] Stalo se zvykem, že jsou enzymy pojmenovávány podle toho, jakou reakci katalyzují, přidáním koncovky –áza (dříve –asa). Tento úzus zřejmě zavedl francouzský vědec Émile Duclaux, který tak chtěl oslavit objevitele diastázy – prvního izolovaného enzymu vůbec.[8]
Dalším cílem výzkumníků bylo určit biochemickou povahu enzymů. Několik vědců sice poukazovalo na to, že enzymatická aktivita má něco společného s proteiny, ale například vlivný chemik Richard Willstätter tvrdil, že bílkoviny jsou pouhé přenašeče skutečných enzymů a nejsou samy o sobě schopné katalyzovat chemické reakce. James Batcheller Sumner v roce 1924 izoloval a krystalizoval enzym ureázu a prokázal, že se jedná o čistý protein. Důkaz, že proteiny mohou samy o sobě plnit funkci enzymů, podali Northrop a Stanley, kteří zkoumali trávicí enzymy pepsin, trypsin a chymotrypsin. Spolu se Sumnerem jim byla v roce 1946 udělena Nobelova cena za chemii.[9] Díky Sumnerovu objevu krystalizace proteinů se otevřel prostor pro důležitou metodu tzv. rentgenové krystalografie, jenž umožňuje určit prostorovou strukturu bílkovin. Poprvé s touto metodou uspěla skupina vedená D. C. Phillipsem, která v roce 1965 zveřejnila prostorovou strukturu enzymu lysozymu.[10]

Základem většiny enzymů je proteinová složka, tzn. dlouhé sekvence aminokyselin vytvářející prostorový útvar. Existuje nicméně i malý počet enzymů, které jsou místo bílkovin složené z RNA – těmto RNA enzymům se říká také ribozymy a patří k nim například rRNA v ribozomu. Menšinovou, ale o to významnější složkou enzymů jsou tzv. prostetické skupiny, které se pevně vážou na enzym a umožňují zpravidla jeho katalytickou funkci. Pouze bílkovinná složka enzymu se označuje apoenzym, který spolu s prostetickou skupinou tvoří výsledný a aktivní holoenzym.[11] Mimo prostetické skupiny se enzymové katalýzy účastní i další, volněji navázané látky, označované obvykle jako koenzymy.
Co se týče terminologie okolo kofaktorů, prostetických skupin a koenzymů, panuje značná nejednotnost. Voet & Voet rozlišují dva druhy kofaktorů, koenzymy a prostetické skupiny, z nichž první se vážou slabě a druhé kovalentně.[11] Stejné pojetí zastává například Vodrážkova Enzymologie[4] nebo Oxford Dictionary of Biochemistry and Molecular Biology.[12] Poněkud jiné definice používá např. Alberts[13] nebo Harper.[14]
Mezi kofaktory se obvykle neřadí další nebílkovinné součási enzymů, jako například různé cukerné složky nebo ionty kovů (protože mnohé enzymy jsou glykoproteiny nebo metaloproteiny). Ke známým metaloenzymům patří metaloproteázy, alkoholdehydrogenáza či karbonáthydrolyáza.[4]
Hlavní složkou molekul holoenzymů jsou bílkoviny (lineární polypeptidy) složené z 20[pozn. 3] základních proteinogenních α-L-aminokyselin, z nichž každá je svými vlastnostmi odlišná od těch ostatních (ty však platí i pro ostatní proteiny, nejen pro enzymy). Fenylalanin, tryptofan a nepolární alifatické aminokyseliny se například obvykle nachází uvnitř enzymů. Tyrosin nebo histidin bývají poměrně často přítomny v tzv. aktivním centru enzymů, první jmenovaný díky své schopnosti tvořit vodíkové můstky, druhý kvůli schopnosti přijímat protony a svým nukleofilním vlastnostem.[4]
Délkou sahají od pouhých 62 aminokyselin v případě 4-oxalokrotonáttautomerázy[15] po 2500 aminokyselin dlouhý komplex syntázy mastných kyselin.[16] Mnohdy se na stavbě enzymu podílí několik samostatných bílkovin, které dohromady tvoří tzv. proteinový komplex. Pokud se vlivem určitých chemických látek rozruší prostorová struktura enzymů, dojde k tzv. denaturaci, kdy enzym vratně nebo nevratně přestane být funkční. Je tedy zřejmé, že prostorový tvar enzymů je zcela zásadní pro jejich funkčnost – bohužel však stále neumíme podle tvaru molekuly spolehlivě předpovědět druh enzymatické aktivity.[17] Většina enzymů je mnohem větší než látky, jejichž přeměnu katalyzují a na vlastní enzymatické aktivitě se podílí jen např. 3–4 aminokyseliny.[18] Tyto aminokyseliny společně vytváří tzv. aktivní místo. Dalšími důležitými oblastmi v enzymu jsou části, kde se vážou kofaktory nebo jiné malé molekuly potřebné pro katalýzu.
Některé enzymy ke své funkci potřebují další, nebílkovinné molekuly, jimž se obvykle říká kofaktory. Takových enzymů je dokonce většina, odhaduje se asi 60 %.[4] Kofaktory obecně umožňují přenos jednotlivých atomů nebo elektronů v průběhu enzymatické činnosti.[4] Vymezení a definice jednotlivých druhů kofaktorů se liší autor od autora, nicméně prostetická skupina je obvykle chápána jako pevně vázaná a stabilní součást molekul enzymů, zatímco koenzym se váže pouze slabě a snadno disociuje. Navíc obvykle platí, že koenzymy se obvykle po proběhnutí reakce „spotřebovávají“ a jsou v mnoha případech jiným enzymem opět regenerovány, aby mohly opět plnit svou funkci. V reálné biochemii však existuje plynulý přechod mezi koenzymy a prostetickými skupinami.[4] Podle chemické struktury a funkce je možné všechny kofaktory praktičtěji rozdělit do několika skupin:[4]
Tvar enzymu může být různý, ale v každém případě by měl zahrnovat tzv. aktivní místo, což je obvykle štěrbina nebo prohlubeň, kde je substrát dostatečně uchráněn před okolním vodným prostředím a může zde dojít ke katalýze. U multimerických enzymů (tedy s více podjednotkami) je aktivní místo mnohdy vytvořeno na pomezí mezi dvěma podjednotkami a na jeho vzniku se tedy podílí aminokyselinové zbytky z dvou či více různých proteinů. V aktivním místě se často nachází různé kofaktory a prostetické skupiny. Jiným důležitým místem je u mnohých (ale zdaleka ne u všech) enzymů tzv. alosterické místo, které se uplatňuje zejména u kaskád několika enzymatických reakcí a je prostředkem tzv. alosterické regulace. Vážou se sem jisté molekuly, přičemž ale nedochází k enzymatické přeměně.[14]
Mezinárodní biochemická a molekulárně biologická unie (IUBMB) zavedla nomenklaturické rozdělení enzymů pomocí tzv. EC čísel do 7 hlavních kategorií, které se dále dělí na podkategorie. Často se tak můžeme vedle jména enzymu setkat ještě s jeho číselným označením ve stylu např. EC 3.4.11.4. Mezi sedm hlavních kategorií enzymů patří:[4][19]
Tzv. systémové názvy enzymů jsou pokusem o systematické pojmenování enzymů skutečným popisem reakcí, jež katalyzují. Příkladem je třeba (S)-laktát:NAD+-oxidoreduktáza, která katalyzuje oxidoredukční reakci substrátu (S)-laktát se substrátem (resp. kofaktorem) NAD+. V EC systému by její číselný kód zněl EC 1.1.1.27, protože patří do skupiny oxidoreduktáz (1), účinkuje na CH-OH skupinu (1.1), jako akceptor vodíku protonů využívá NAD+ nebo NADP+ (1.1.1) a jedná se o laktátdehydrogenázu (1.1.1.27).[4]
Téměř všechny biochemické reakce jsou řízené enzymaticky.[11] Enzymy jsou speciální skupina katalyzátorů, které stojí na pomezí heterogenní a homogenní katalýzy, ale v mnohém připomínají spíše tu heterogenní, ač jsou obvykle rozpuštěné ve vodě. Jsou tak výkonné, že enzymaticky katalyzované reakce dosahují 108–1014× vyšších rychlostí než reakce nekatalyzované.[4] Extrémním příkladem je orotidin-5'-fosfátdekarboxyláza – díky ní reakce, která by trvala 78 milionů let, proběhne s poločasem 18 milisekund.[20] Enzymy předčí svou rychlostí o několik řádů i běžné chemické katalyzátory. Enzymatická reakce má však i celou řadu dalších výhod. Takové reakce se dají obvykle uskutečnit za mnohem nižších teplot, při atmosférickém tlaku a při fyziologickém pH. Dále jsou enzymy velice specifické, mnohem více, než jakýkoliv chemický katalyzátor. Konečně je možné enzym snadno regulovat, například alostericky nebo třeba útlumem syntézy daného proteinu.[11]
Enzymy mění (snižují) aktivační energii. Pozor, enzymy nemění Gibbsovu volnou energii.[21] Snížení aktivační energie výrazně zvyšuje rychlost reakce (stačí poměrně malé snížení energie pro mnohonásobné zvýšení rychlosti).[11] Za vynikající katalytické schopnosti enzymů jsou zodpovědné především čtyři mechanismy. Jednou z možností je, že enzym vhodně přiblíží substráty a vhodně je prostorově orientuje. Vznikne tak vysoká lokální koncentrace substrátů a usnadní se reakce. Jindy se v aktivním místě enzymu vytváří pomocí zbytků vhodných aminokyselin silně kyselé nebo zásadité prostředí podle toho, co je potřeba k proběhnutí reakce. V jiných případech dochází k navázání substrátu na enzym (např. na serin, cystein či histidin[4]) a k natahování nebo rozrušování substrátu, což oslabuje např. cílovou vazbu a usnadňuje rozkladné reakce. Jindy dochází ke katalýze tak, že enzym volí jiný reakční mechanismus, který probíhá snadněji (s nižší aktivační energií), a to obvykle tak, že substrát je dočasně kovalentně navázán samotným enzymem.[14]

Enzymy jsou obvykle velmi specifické a obvykle katalyzují zcela konkrétní chemickou reakci, při níž dochází k přeměně substrátu na produkt. Existuje obvykle nejen účinková (reakční) specifita, tedy schopnost enzymu katalyzovat jeden konkrétní typ reakce, ale dále také do jisté míry i substrátová specifita, tedy katalytická aktivita na jeden substrát či na skupinu několika substrátů podobných.[4] Za enzymatickou specifitu je zodpovědný především komplementární tvar substrátu a aktivního místa enzymu, náboj a také hydrofilní a hydrofobní vlastnosti jednotlivých oblastí enzymu a substrátu. Enzymy jsou díky tomu silně geometricky specifické (rozeznávají konkrétní tvar substrátu, na který se vážou) a stereospecifické (působí jen na jeden z enantiomerů).[11] Některé enzymy účastnící se replikace a exprimování DNA (např. 3' 5' exonukleázy) nejen jsou velice přesné, ale ještě po sobě kontrolují vzácné chyby, a tak jsou ve výsledku tak specifické, že činí méně než 1 chybu na 100 milionů enzymatických reakcí.[22][23] Na druhou stranu existují i velmi nespecifické („promiskuitní“) enzymy, jež mohou katalyzovat celou řadu reakcí – příkladem je γ-humulensyntáza z jedle obrovské (Abies grandis), která je za pomoci jednoho substrátu schopna vyrobit 52 různých seskviterpenů.[24]
Na konci 19. století biochemik Emil Fischer navrhl, že substrát přesně zapadá do aktivního centra enzymu.[25] Tato teorie je známa jako hypotéza zámku a klíče. V roce 1958 Koshland vyjádřil přesvědčení,[26] že enzymy se nechovají přesně jako zámek a klíč, ale spíše při vzájemném setkání enzym mění tvar a „zámek a klíč“ se vytvoří teprve v okamžiku, kdy se substrát naváže na enzym. Tato teorie je známa jako hypotéza indukovaného přizpůsobení.[11] Někdy může přizpůsobovat svůj tvar i samotný substrát.[27] Model indukovaného přizpůsobení je zřejmě blíže pravdě než model zámku a klíče, jak ukázala rentgenová difrakční analýza.[11]
Enzym lze regulovat v zásadě dvěma způsoby, regulací jeho množství a regulací jeho aktivity. Celá řada enzymů není v buňce vůbec či téměř přítomna, dokud nejsou skutečně potřeba (typickým příkladem jsou enzymy v bakteriálním lac operonu). Jiné enzymy je zase možné přestat za jistých okolností vyrábět. V obou případech se jedná o regulaci pomocí navázání na různé regulační sekvence umístěné před geny. Poněkud rychlejší odpovědi buňka dosáhne, pokud zároveň rozloží enzymy již přítomné v buňce.[14]
V případě velmi náhlé (a často dočasné) potřeby se obvykle postupuje cestou regulace aktivity enzymu. To znamená, že enzym je přítomen, ale je (de)aktivován navázáním jistého ligandu (tzv. alosterického regulátoru) či kovalentní modifikací enzymu. Alosterická regulace obvykle zahrnuje určitý druh zpětné vazby: produkt reakce se váže do alosterického místa enzymu a mění jeho aktivitu (inhibuje ho, nebo naopak stimuluje), a to díky změně Michaelisovy konstanty enzymu či limitní rychlosti reakce vmax. Alostericky působí například vazba různých hormonů či druhých poslů na receptor. Z kovalentních modifikací je nejznámější zřejmě fosforylace a defosforylace enzymů (obvykle pomocí kináz a fosfatáz), čímž dochází ke změně aktivity enzymu (buď k jeho spuštění nebo vypnutí).[14] Jiným způsobem aktivace je vyštěpení části proteinu pomocí proteázy, čímž se proenzym (zymogen) změní na aktivní enzym.
Obecně lze rozdělit inhibici na ireverzibilní (nevratnou), která trvale modifikuje molekulu enzymu, a reverzibilní (vratnou), kdy po odstranění inhibitoru např. dialýzou či ultrafiltrací dojde k opětovnému zvýšení aktivity. Ireverzibilní inhibitor se na enzym obvykle váže pevnou kovalentní vazbou, zatímco reverzibilní inhibitor je vázán slabšími interakcemi. Z hlediska mechanismu působení inhibitoru se rozeznávají tři základní typy reverzibilní inhibice. První je tzv. kompetitivní (soutěživá) inhibice, kdy inhibičně působící molekula soutěží se substrátem o vazebné místo na enzymu, ale sama se nedokáže přeměnit na produkt. Zvýšením koncentrace substrátu se dá tomuto typu inhibice do velké míry zabránit. Častější je druhý typ inhibice, tzv. inhibice nekompetitivní, při níž dochází k vazbě inhibitoru na alosterické centrum (tedy nikoliv na aktivní místo) a ke snížení funkceschopnosti enzymu. Změna koncentrace substrátu s takovým typem inhibice nic neudělá. Konečně třetím typem je akompetitivní inhibice, kdy dochází k vazbě inhibitoru na enzym až poté, co byl navázán substrát. To zabraňuje komplexu enzym-substrát, aby provedl enzymatickou reakci. Existuje i celá řada dalších způsobů regulace enzymové aktivity v závislosti na tom, jaké hledisko třídění je použito.[28]
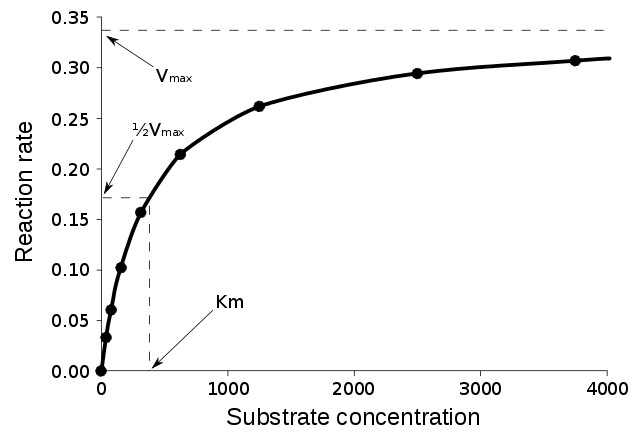
Kinetika zkoumá rychlost chemických reakcí a s ní související záležitosti. Pro enzymovou kinetiku platí obecné zákony chemické kinetiky a uplatňují se v ní běžně známé chemické veličiny, jako je reakční rychlost (v), rovnovážná konstanta (K) či třeba Gibbsova energie (G). Obvykle se vychází ze zjednodušující představy, že enzymem katalyzovaná reakce probíhá ve dvou krocích („E“ je enzym, „S“ je substrát, „P“ je produkt):
načež platí:
Výše uvedená rovnice je tzv. rovnice Michaelise a Mentenové, základní rovnice enzymové kinetiky vůbec. je počáteční rychlost reakce, je mezní rychlost reakce (při nadbytku substrátu a 100% nasycení enzymů), je Michaelisova konstanta a je rovnovážná koncentrace substrátu.[11] Podle uvedené rovnice má závislost reakční rychlosti na koncentraci substrátu má tvar hyperboly. Zajímavou veličinou je Michaelisova konstanta, pro niž platí KM = (k-1 + k2) / k1 a která udává koncentraci substrátu, při níž je reakční rychlost rovna polovině maximální rychlosti.[11] Rovnice Michaelise a Mentenové však je silně zjednodušujícím popisem reality a platila by jen pro počáteční stavy jednosubstrátových reakcí, přičemž by muselo docházet k přímému rozpadu komplexu enzym-substrát na enzym a produkt.[28]
Na rychlost enzymatické reakce (konkrétně na velikost Michaelisovy konstanty) má výrazný vliv řada fyzikálně-chemických vlastností prostředí. Obecně platí, že s vzrůstající teplotou roste rychlost enzymatické reakce až do doby, než se bílkovinná složka enzymu začne denaturovat. Denaturační teplota obvykle u živočišných enzymů činí asi 50–60 °C.[pozn. 4] Na rychlost má dále výrazný vliv pH prostředí – většině enzymů vyhovuje nejlépe pH 5–7, nicméně pepsin má optimum při pH 1,5–2 a argináza při pH 9,5. Aktivitu enzymů dále někdy ovlivňuje redox potenciál, iontová síla a relativní permitivita.[4] Samostatnou kapitolou je vliv inhibitorů a dalších efektorů na průběh enzymatické reakce.
Enzymy nalezly celou řadu funkcí i v celé řadě oborů lidské činnosti. Neoddiskutovatelný je jejich význam ve vědě a výzkumu – běžně se využívají různé polymerázy, restrikční endonukleázy, proteázy a podobně. Už několik desetiletí se přidávají enzymy také do pracích prášků, čímž se zvyšuje účinnost odstraňování skvrn i při nižších teplotách. Enzymy šetří energii i v potravinářském, textilním a papírenském průmyslu, v odpadovém hospodářství a podobně. Do budoucna se uvažuje o masivním nasazení enzymů pro výrobu ekologicky šetrných biopaliv.[29] Těmto a dalším aplikacím by mělo usnadnit cestu tzv. enzymové inženýrství.[30]
Proteolytické enzymy se používají například v mlékárenském průmyslu jako syřidla (chymosin) nebo k přípravě hypoalergeního mléka. Enzymy lze využít i ke změkčování masa (papain). Pomocí enzymatického štěpení trisacharidů v luštěninách lze připravit takové luštěniny, které nenadýmají. V analytické chemii lze použít enzymů jako značek na specifickém indikátoru (např. ELISA). Pomocí redoxních enzymů lze poměrně snadno stanovit koncentraci specifického substrátu pro daný enzym. V lékařství lze podávat enzymy jako náhradu chybějících enzymů při poškození slinivky břišní či při léčbě některých onemocnění. Při perorálním podávání enzymů, které mají usnadnit trávení či metabolismus, zpravidla dochází k denaturaci těchto enzymů v žaludku.[31] Denaturaci enzymů v kyselém prostředí žaludku je možno předcházet pomocí vhodné enkapsulace; žaludkem však v takovém případě projde jen několik procent enzymů v původním (nedegradovaném) stavu[32]. Enzymy jsou také využívány při restaurování uměleckých předmětů, převážně malby.[33]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.