unitat de matèria més petita d'un element químic From Wikipedia, the free encyclopedia
Un àtom és la unitat constituent més petita de la matèria ordinària que forma un element químic. Tot sòlid, líquid, gas i plasma es compon d'àtoms ionitzats o neutres. Els àtoms són extremament petits i tenen una mida d'aproximadament 100 picòmetres. Són tan petits que intentar predir el seu comportament per mitjà de la física clàssica —considerant-los, per exemple, com si fossin boles de billar— retorna prediccions incorrectes a causa dels efectes quàntics. Gràcies al desenvolupament de la física, els models atòmics han incorporat principis quàntics per poder explicar i predir millor aquest comportament.
| Àtom | |
|---|---|
 Il·lustració de l'àtom d'heli on es mostra el nucli (en rosa) i la distribució del núvol d'electrons (negre). El nucli (a dalt a la dreta) de l'heli-4 és en realitat simètric esfèricament i s'assembla molt al núvol d'electrons, però en nuclis més complicats aquests no és sempre el cas. La barra negra és la mesura d'un ångström (1x10-10 m). | |
| Classificació | |
| Divisió més petita possible d'un element químic | |
| Propietats | |
| Massa | ≈ 1,66 × 10−27 a 4,52 × 10−25 kg |
| Càrrega elèctrica | Zero (neutra) o amb càrrega iònica |
| Diàmetre | 62 pm (He) a 520 pm (Cs) (llista completa) |
| Components | Electrons i un nucli compacte de protons i neutrons |
Tot àtom està compost per un nucli i un o més electrons lligats al nucli. El nucli està fet d'un o més protons i, típicament, un nombre similar de neutrons; els protons i neutrons s'anomenen nucleons. Més del 99,94% de la massa de l'àtom està concentrada al nucli. Els protons tenen una càrrega elèctrica positiva; els electrons, negativa; i els neutrons no en tenen. Si el nombre de protons i electrons és el mateix, llavors l'àtom és elèctricament neutre; en canvi, si té més o menys electrons que protons, té una càrrega negativa o positiva (respectivament) i s'anomena ió.
Els electrons d'un àtom resulten atrets als protons del nucli atòmic per la força electromagnètica. Els protons i neutrons del nucli s'atrauen entre si, però, per una força diferent, la força nuclear, que normalment és més forta que la força electromagnètica que repel·leix els protons carregats positivament entre si. En algunes circumstàncies, la força electromagnètica de repulsió esdevé més forta que la nuclear, i els nucleons poden resultar expulsats del nucli, deixant enrere un element diferent: es tracta d'una desintegració nuclear que resulta en una transmutació nuclear.
El nombre de protons del nucli defineix a quin element químic pertany l'àtom: per exemple, tots els àtoms de coure contenen 29 protons. El nombre de neutrons, d'altra banda, defineix l'isòtop de l'element. El nombre d'electrons influeix en les propietats magnètiques de l'àtom. Els àtoms es poden unir a un o més altres àtoms mitjançant enllaços químics per formar compostos químics com ara les molècules. La capacitat dels àtoms d'associar-se o dissociar-se és la responsable de la majoria de canvis físics observats a la naturalesa; la química és la ciència que estudia aquests canvis.
La idea que la matèria està composta d'unitats separades és un concepte molt antic i que apareix en moltes cultures de l'antiguitat, tals com a Grècia o l'Índia. La paraula «àtom» (del grec ἄτομος, atomos, 'indivisible') fou encunyada pels filòsofs de l'Antiga Grècia Leucip i el seu deixeble Demòcrit (ca. 460–ca. 370 aC).[1][2][3][4] Demòcrit sostenia que els àtoms eren infinits en nombre, no creats i eterns, i que les qualitats d'un objecte resultaven de la mena d'àtoms que el componien.[2][3][4] L'atomisme de Demòcrit fou refinat i elaborat pel filòsof posterior Epicur (341–270 aC).[3][4] Durant la baixa edat mitjana, l'atomisme fou gairebé oblidat a l'Europa occidental, però sobrevisqué dins d'alguns grups de filòsofs islàmics.[3] Durant el segle xii, l'atomisme tornà a ser conegut a l'Europa occidental gràcies a referències trobades en les escriptures descobertes d'Aristòtil.[3]
En el segle xiv, la redescoberta d'obres notables que descrivien ensenyances atomistes –entre les quals De rerum natura, de Lucreci, i Vides i opinions de filòsofs eminents, de Diògenes Laerci– comportà una major atenció del tema.[3] Tanmateix, com que l'atomisme s'associava amb la filosofia de l'epicureisme, la qual contradeia les ensenyances cristianes ortodoxes, la creença en els àtoms no era considerada acceptable.[3] El sacerdot catòlic francès Pierri Gassendi (1592–1655) revisqué l'atomisme epicuri amb modificacions, argüint que els àtoms eren creats per Déu i, encara que extremadament nombrosos, no eren infinits.[3][4] La seva teoria modificada es popularitzà a França gràcies al físic François Bernier (1620–1688) i a Anglaterra gràcies al filòsof naturalista Walter Charleton (1619–1707).[3] Tant el químic Robert Boyle (1627–1691) com el físic Isaac Newton (1642–1727) definiren l'atomisme i, a finals del segle xvii, esdevingué acceptat per sectors de la comunitat científica.[3]

A primeries del segle xix, John Dalton utilitzà el concepte dels àtoms per explicar per què els elements químics sempre reaccionen en proporcions de petits nombres enters (la llei de les proporcions múltiples). Per exemple, existeixen dos tipus d'òxid d'estany: un és 88,1% estany i 11,9% oxigen, i l'altre és 78,1% estany i 21,3% oxigen (òxid d'estany(II) i diòxid d'estany, respectivament): això significa que 100 grams d'estany es combinen amb 13,5 grams o 27 grams d'oxigen. 13,5 i 27 formen una proporció d'1 a 2, que és una proporció de petits nombres enters. Aquest patró comú en química suggerí a Dalton que els elements reaccionen en múltiples d'unitats discretes: és a dir, en altres paraules, àtoms. En el cas dels òxids d'estany, un àtom d'estany es combina amb un o bé dos àtoms d'oxigen.[5]
Dalton també creia que la teoria atòmica podia explicar per què l'aigua absorbeix diferents gasos en diferents proporcions; per exemple, descobrí que l'aigua absorbeix diòxid de carboni molt millor que no pas nitrogen.[6] Dalton hipotetitzà que això passa a causa de la diferència entre les masses i les configuracions de les partícules de cada gas; les molècules de diòxid de carboni (CO₂) són més grans i pesades que les de nitrogen (N₂).
El 1827, el botànic Robert Brown utilitzà un microscopi per observar grans de pols flotant a l'aigua i descobrí que es movien erràticament, un fenomen que posteriorment es conegué com a moviment brownià. Es creia que això era causat per molècules d'aigua col·lidint amb els grans de pols. El 1905, Albert Einstein provà la realitat d'aquestes molècules i els seus moviments produint el primer anàlisi de física estadística del moviment brownià.[7][8][9] El físic francès Jean Perrin utilitzà l'obra d'Einstein per determinar experimentalment la massa i dimensió dels àtoms, verificant així la teoria atòmica de Dalton.[10]

El físic J.J. Thomson mesurà la massa de raigs catòdics, cosa que mostrà que estaven fets de partícules, però eren unes 1800 vegades més lleugeres que el més lleuger dels àtoms, l'hidrogen. Per tant, no es tractava d'àtoms, sinó d'una nova partícula, concretament de la primera partícula subatòmica mai descoberta, que ell anomenà corpuscle però que posteriorment s'anomenà electró a causa de les partícules postulades per George Johnstone Stoney el 1874. També mostrà que eren idèntiques a partícules emeses per materials fotoelèctrics i radioactius.[11] Es reconegué ràpidament que són les partícules que porten el corrent elèctric en fils metàl·lics, i que porten la càrrega elèctrica negativa dins dels àtoms. Thomson rebé el Premi Nobel de Física de 1906 pel seu treball, el qual donà la volta a la creença que els àtoms eren indivisibles i les partícules més bàsiques de la matèria.[12] Thomson també postulà incorrectament que els electrons de petita massa i carregats negativament estaven distribuïts al voltant de l'àtom en un mar uniforme de càrrega positiva. Això esdevingué conegut com el model del púding de panses.
El 1909, Hans Geiger i Ernest Marsden, sota la direcció d'Ernest Rutherford, bombardejaren una làmina de metall amb partícules alfa per observar com es dispersaven. Esperaven que totes passessin directament a través seu amb poca deflexió, ja que el model de Thomson deia que les càrregues a l'àtom són tan difuses que els seus camps elèctrics no podien afectar gaire les partícules; tanmateix, Geiger i Marsden observaren partícules alfa que eren desviades amb angles superiors a 90°, cosa que se suposava que era impossible segons el model de Thomson. Per explicar-ho, Rutherford proposà que la càrrega positiva de l'àtom es concentra en un petit nucli al seu centre.[13]
Mentre experimentava amb els productes de la desintegració radioactiva, el 1913 el radioquímic Frederick Soddy descobrí que aparentment hi havia més d'un tipus d'àtom a cada posició de la taula periòdica.[14] El terme «isòtop» fou encunyat per Margaret Todd per representar diferents àtoms que pertanyen al mateix element químic. J.J. Thomson creà una tècnica per a la separació d'isòtops durant el seu treball sobre els gasos ionitzats, la qual conduí a la descoberta dels isòtops estables.[15]

El 1913 el físic Niels Bohr proposà un model en el qual s'assumia que els electrons d'un àtom orbitaven al voltant del nucli però només ho podien fer en un conjunt finit d'òrbites, i que podien saltar entre aquestes òrbites només en canvis discrets d'energia corresponents a l'absorció o radiació d'un fotó.[16] Aquesta quantització fou utilitzada per explicar per què les òrbites electròniques són estables (ja que normalment les càrregues en acceleració, incloent-hi el moviment circular, perden energia cinètica, que és emesa com a radiació electromagnètica; vegeu Radiació sincrotrònica) i per què els elements absorbeixen i emeten radiació electromagnètica en espectres discrets.[17]
Més tard, el mateix any, Henry Moseley trobà evidència experimental addicional a favor de la teoria de Niels Bohr. Aquests resultats refinaren el model de Rutherford i Van de Broek, que proposava que l'àtom conté en el seu nucli un nombre positiu de càrregues nuclears que és igual al seu nombre (atòmic) a la taula periòdica. Fins aquests experiments, no se sabia que el nombre atòmic fos una quantitat física i experimental; que aquest nombre és igual a la càrrega atòmica nuclear roman el model atòmic acceptat avui en dia.[18]
Els enllaços químics entre àtoms foren explicats per Gilbert Newton Lewis el 1916 com les interaccions entre els seus electrons constituents.[19] Com que se sabia que les propietats químiques dels elements en gran manera es repetien segons la llei periòdica,[20] el 1919 el químic estatunidenc Irving Langmuir suggerí que això podia ser explicat si els electrons d'un àtom estiguessin connectats o agrupats d'alguna manera. Es pensà que grups d'electrons ocupaven un conjunt de capes d'electrons al voltant del nucli.[21]
L'experiment de Stern–Gerlach de 1922 aportà més evidència sobre la naturalesa quàntica de les propietats atòmiques. Quan un feix d'àtoms de plata passava a través d'un camp magnètic d'una forma concreta, el feix es dividia d'una manera correlacionada amb el moment angular de la direcció d'un àtom, és a dir, l'espín. Com que la direcció de l'espín inicialment és aleatòria, s'esperaria que el feix es desviés en una direcció aleatòria; ben al contrari, el feix es dividia en dos components direccionals corresponents als espíns atòmics essent orientats amunt o avall respecte al camp magnètic.[22]
El 1925 Werner Heisenberg publicà la primera formulació matemàtica consistent de la mecànica quàntica (mecànica matricial).[18] Un any abans, el 1924, Louis de Broglie havia proposat que totes les partícules es comporten fins a cert punt com les ones i, el 1926, Erwin Schrödinger utilitzà aquesta idea per desenvolupar un model matemàtic de l'àtom (mecànica d'ones) que descrivia els electrons com a ones tridimensionals i no pas com a partícules puntuals.
Una conseqüència d'utilitzar formes d'ona per a descriure partícules és que és matemàticament impossible obtenir valors precisos tant per la posició com per la quantitat de moviment d'una partícula en un punt concret del temps: això esdevingué conegut com el principi d'incertesa, formulat per Werner Heisenberg el 1927.[18] En aquest concepte, per a una precisió donada en mesurar una posició, hom només podia obtenir un interval de possibles valors per la quantitat de moviment, i viceversa.[23] Aquest model fou capaç d'explicar observacions de comportament atòmic que els models anteriors no podien, tals com certs patrons estructurals i espectrals d'àtoms més grans que l'hidrogen. En conseqüència, el model planetari de l'àtom fou descartat en favor del que descrivia zones d'orbitals atòmics al voltant del nucli en les quals un cert electró té més possibilitats de ser observat.[24][25]
El desenvolupament de l'espectròmetre de masses permeté mesurar la massa dels àtoms amb millor precisió. Aquest dispositiu utilitza un imant per corbar la trajectòria d'un feix de ions, i la quantitat de desviació es determina per la proporció entre la massa d'un àtom i la seva càrrega. El químic Francis William Aston l'utilitzà per mostrar que els isòtops tenien diferents masses. La massa atòmica d'aquests isòtops variava en quantitats enteres, cosa que s'anomena la regla dels nombres sencers.[26] L'explicació per aquests diferents isòtops fou el preludi de la descoberta del neutró, una partícula sense càrrega amb una massa similar a la del protó, per part del físic James Chadwick el 1932. Llavors, els isòtops s'explicaren com a elements amb el mateix nombre de protons però diferents nombres de neutrons dins del nucli.[27]
El 1938, el químic alemany Otto Hahn, estudiant de Rutherford, dirigí neutrons contra àtoms d'urani esperant obtenir elements transurànics. En comptes d'això, els seus experiments químics mostraren que obtenia bari com a producte.[28][29] Un any més tard, Lise Meitner i el seu nebot Otto Frisch verificaren que els resultats de Hahn foren la primera fissió nuclear experimental.[30][31] El 1944, Hahn rebé el Premi Nobel de Química. Tot i els esforços de Hahn, les contribucions de Meitner i Frisch no foren reconegudes.[32]
A la dècada de 1950, el desenvolupament d'acceleradors de partícules i detectors de partícules millorats permeté als científics estudiar els impactes d'àtoms movent-se a altes energies.[33] Es descobrí que els neutrons i els protons eren hadrons, o compostos de partícules més petites anomenades quarks. Es desenvolupà el model estàndard de física de partícules el qual, fins al moment, ha explicat amb èxit les propietats del nucli en termes d'aquestes partícules subatòmiques i les forces que governen les seves interaccions.[34]
Encara que el vocable àtom designava originalment una partícula que no pot ser dividida en partícules més petites, en l'ús científic modern l'àtom es compon de diverses partícules subatòmiques. Les partícules constituents de l'àtom són l'electró, el protó i el neutró; tots tres són fermions. Tanmateix, l'àtom hidrogen-1 no té neutrons i l'ió hidró no té electrons.
L'electró és, de llarg, la menys massiva d'aquestes partícules amb 9,11×10−31 kg, amb una càrrega elèctrica negativa i una mida que és massa petita per ser mesurada amb les tècniques actualment disponibles.[35] Fou la partícula més lleugera en tenir una massa en repòs positiva mesurada, fins a la descoberta de la massa del neutrí. En condicions ordinàries, els electrons estan lligats al nucli carregat positivament per l'atracció creada entre càrregues elèctriques oposades. Si l'àtom té més o menys electrons que el seu nombre atòmic, llavors esdevé carregat negativament o positiva, respectivament; un àtom carregat s'anomena ió. Els electrons s'han conegut des de les darreries del segle xix, majoritàriament gràcies a J.J. Thomson.
Els protons tenen una càrrega positiva i una massa 1.836 vegades més gran que la de l'electró, amb un valor de 1,6726×10−27 kg. El nombre de protons en un àtom s'anomena nombre atòmic de l'àtom. Ernest Rutherford (1919) observà que el nitrogen, sota un bombardeig de partícules alfa, desprenia el que semblaven nuclis d'hidrogen. El 1920 ja havia acceptat que el nucli d'hidrogen és una partícula diferent dins de l'àtom i l'anomenà protó.
Els neutrons no tenen càrrega elèctrica i tenen una massa lliure 1.839 vegades més gran que l'electró,[36] és a dir, de 1,6929×10−27 kg, la més gran de les tres partícules constituents, però pot resultar reduïda a causa de l'energia d'enllaç nuclear. Els protons i neutrons (coneguts col·lectivament com a nucleons) tenen dimensions comparables (de l'ordre de 2,5×10−15 m) encara que la «superfície» d'aquestes partícules no està clarament definida.[37] El neutró fou descobert el 1932 pel físic anglès James Chadwick.
En el model estàndard de física, els electrons són realment partícules elementals sense estructura interna. Tanmateix, tant els protons com els neutrons són partícules compostes de partícules elementals anomenades quarks. Hi ha dos tipus de quarks en els àtoms, i cadascun té una càrrega elèctrica fraccional. Els protons són compostos per dos quarks dalt (cadascun amb una càrrega de +23) i un quark baix (amb una càrrega de −13); els neutrons, d'altra banda, estan formats per un quark dalt i dos quarks baixos. Aquesta distinció explica la diferència de massa i càrrega entre les dues partícules.[38][39]
Els quarks es mantenen units per la interacció forta (o força forta), la qual és mediada per gluons. Els protons i neutrons, al seu torn, es mantenen junts l'un amb l'altre al nucli per la força nuclear, que és un residu de la força forta amb unes propietats d'abast una mica diferents. El gluó és un membre de la família dels bosons de gauge, que són partícules elementals que fan de mediadores de forces físiques.[38][39]

Tots els protons i neutrons de l'àtom constitueixen un petit nucli atòmic, i col·lectivament s'anomenen nucleons. El radi d'un nucli és aproximadament igual a 1,07 3√A fm, on A és el nombre total de nucleons.[40] Aquest valor és molt més petit que el radi de l'àtom, que és de l'ordre de 10⁵ fm. Els nucleons resten enllaçats per un potencial d'atracció de curt abast anomenat força forta residual. A distàncies menors de 2,5 fm, aquesta força és molt més potent que la força electroestàtica que fa que els protons, de càrrega positiva, es repel·leixin entre si.[41]
Els àtoms d'un mateix element químic tenen el mateix nombre de protons, anomenat el nombre atòmic. Dins d'un element concret, el nombre de neutrons pot variar: això determina l'isòtop de l'element. El nombre total de protons i neutrons determina el núclid. El nombre de neutrons en relació al de protons determina l'estabilitat del nucli: certs isòtops pateixen una desintegració radioactiva.[42]
El protó, l'electró i el neutró són classificats com a fermions. Els fermions obeeixen el principi d'exclusió de Pauli, el qual prohibeix que fermions idèntics, tals com protons múltiples, ocupin el mateix estat quàntic al mateix temps. Per tant, qualsevol protó en el nucli ha d'ocupar un estat quàntic diferent de tots els altres protons; això mateix aplica a tots els neutrons del nucli i a tots els electrons del núvol electrònic.[43]
Un nucli que té un nombre diferent de protons que de neutrons pot, potencialment, caure a un estat d'energia inferior per mitjà d'una desintegració radioactiva, la qual causa que ambdós nombres s'apropin. Com a resultat, els àtoms amb un nombre de protons igual que d'electrons són més estables davant la desintegració. Tanmateix, com més alt és el nombre atòmic, la repulsió mútua dels protons requereix una proporció més alta de neutrons per mantenir l'estabilitat del nucli, la qual cosa modifica lleugerament aquesta tendència d'igual nombre de protons i neutrons.[43]
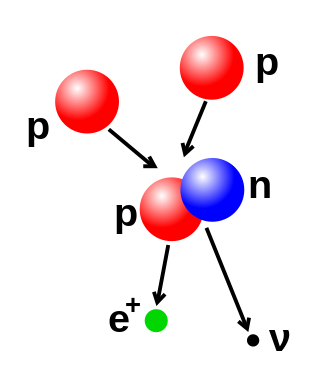
La quantitat de protons i neutrons del nucli es pot modificar, encara que fer-ho requereix energies molt elevades a causa de la força forta. La fusió nuclear té lloc quan múltiples partícules atòmiques s'uneixen per formar un nucli més pesant, tal com mitjançant la col·lisió energètica de dos nuclis. Per exemple, al nucli del Sol els protons requereixen energies de 3-10 keV per sobreposar-se a la seva repulsió mútua –la barrera de Coulomb– i fusionar-se en un sol nucli.[44] La fissió nuclear és el procés oposat: causa que un nucli es divideixi en dos nuclis més petits, normalment mitjançant desintegració radioactiva. El nucli també pot ser modificat mitjançant el bombardeig amb partícules subatòmiques d'alta energia o fotons. Si això modifica el nombre de protons en un nucli, l'àtom canvia a un element químic diferent.[45][46]
Si la massa del nucli després d'una reacció de fusió és menor que la suma de les masses de les partícules separades, llavors la diferència entre aquests dos valors pot ser emès com un tipus utilitzable d'energia (tal com un raig gamma, o l'energia cinètica d'una partícula beta), com es descriu a la fórmula d'equivalència massa-energia d'Albert Einstein, E = mc², on m és la pèrdua de massa i c és la velocitat de la llum. Aquest dèficit és part de l'energia d'enllaç del nou nucli, i és la pèrdua d'energia no recuperable que causa que les partícules fusionades romanguin juntes en un estat que requereix aquesta energia per a separar-se.[47]
La fusió de dos nuclis que creen nuclis més grans de nombre atòmic més petit que el del ferro i el níquel —un nombre de nucleons total al voltant de 60— és normalment un procés exotèrmic que allibera més energia de la necessària per ajuntar-los.[48] És aquest procés d'alliberament d'energia el que converteix els processos de fusió nuclear en els estels en reaccions autosostingudes. Pel que fa a nuclis més pesants, l'energia d'enllaç per nucleó en el nucli comença a decréixer: això significa que els processos de fusió que produeixen nuclis de nombres atòmics més grans de 26, i masses atòmiques més altes de 60 són processos endotèrmics. Aquests nuclis més massius no poden patir una reacció de fusió que produeixi energia que pugui sostenir l'equilibri hidroestàtic d'un estel.[43]

Els electrons en un àtom són atrets als protons del nucli per la força electromagnètica. Aquesta força lliga els electrons dins d'un pou de potencial electroestàtic que envolta els nuclis més petits, la qual cosa significa que és necessària una font d'energia externa perquè l'electró pugui escapar. Com més proper és un electró al nucli, més gran és la força d'atracció; per tant, els electrons lligats prop del centre del pou de potencial requereixen més energia per escapar que aquells que estan més separats.
Els electrons, com altres partícules, tenen propietats de partícula i d'ona. El núvol d'electrons és una regió dins del pou de potencial on cada electró forma un tipus d'ona estacionària tridimensional (una forma d'ona que no es mou en relació al nucli). Aquest comportament ve definit per un orbital atòmic, una funció matemàtica que caracteritza la probabilitat que un electró sembli estar en una ubicació concreta quan es mesura la seva posició.[49] Tan sols existeix un conjunt discret (o quantititzat) d'aquests orbitals al voltant del nucli, ja que altres possibles patrons d'ona es desintegren ràpidament cap a una forma més estable.[50] Els orbitals poden tenir una o més estructures d'anell o de node, i difereixen l'un de l'altre en mida, forma i orientació.[51]

Cada orbital atòmic correspon a un nivell d'energia concret de l'electró. L'electró pot canviar el seu estat a un nivell superior d'energia absorbint un fotó amb suficient energia per alçar-lo al nou estat quàntic. De manera similar, mitjançant emissió espontània, un electró en un estat d'energia superior pot baixar a un estat d'energia inferior radiant l'excés d'energia en forma de fotó. Aquests valors d'energia característics, definits per les diferències de les energies entre estats quàntics, són els responsables de les línies atòmiques espectrals.[50]
La quantitat d'energia necessària per sostreure o afegir un electró —l'energia d'enllaç electrònica— és molt menor que l'energia d'enllaç de nucleons. Per exemple, es requereixen només 13,6 eV per sostreure un electró en estat estacionari d'un àtom d'hidrogen,[52] en comparació amb 2,23 milions eV per dividir un nucli de deuteri.[53] Els àtoms són elèctricament neutres si tenen un nombre idèntic de protons i d'electrons; aquells que tenen un dèficit o excedent d'electrons s'anomenen ions. Els electrons més allunyats del nucli poden ser transferits a altres àtoms propers o ser compartits entre àtoms; mitjançant aquest mecanisme, els àtoms poden constituir enllaços químics per formar molècules i altres tipus de compostos químics tals com cristalls iònics o covalents.[54]
Per definició, qualssevol dos àtoms amb un nombre idèntic de protons en el seu nucli pertanyen al mateix element químic. Els àtoms amb igual nombre de protons però diferent nombre de neutrons són isòtops diferents del mateix element. Per exemple, tots els àtoms d'hidrogen admeten exactament un protó, però n'existeixen isòtops sense neutrons (com l'hidrogen-1, de llarg, la forma més comuna,[55] anomenada proti), amb un neutró (deuteri), dos neutrons (triti) i més de dos neutrons. Els elements coneguts formen un conjunt de nombres atòmics, des de l'element uniprotonal hidrogen fins al de 118 protons, l'oganessó.[56] Tots els isòtops coneguts d'elements de nombre atòmic més gran que 82 són radioactius, encara que la radioactivitat de l'element 83 (bismut) és tan petita que a la pràctica és negligible.[57][58]
A la Terra es poden trobar uns 339 núclids que ocorren naturalment,[59] dels quals 254 (aproximadament el 75%) no s'ha observat que es desintegrin i, en conseqüència, se'ls anomena «isòtops estables». Això no obstant, només 90 d'aquests núclids són estables a totes les desintegracions, fins i tot en la teoria; els altres 164 no s'ha observat que es desintegrin, encara que en teoria és energèticament possible. Aquests també es classifiquen formalment com a "estables". 34 núclids radioactius addicionals tenen semivides superiors als 80 milions d'anys, i han perdurat prou temps per haver estat presents des del naixement del sistema solar. Aquesta col·lecció de 288 núclids es coneix com a núclids primordials. Finalment, es coneixen 51 núclids de vida curta que ocorren naturalment com a productes fill de la desintegració dels núclids primordials (tals com el radi de l'urani) o com a productes de processos energètics naturals terrestres, tals com el bombardeig de raigs (per exemple, el carboni-14).[60]
Existeix com a mínim un isòtop estable per a 80 elements químics. Com a regla general, només hi ha uns pocs isòtops estables per cadascun d'ells: de mitjana, 3,2 isòtops estables per element. 26 elements només tenen un isòtop estable. El nombre d'isòtops estables més gran observat per qualsevol element és de 10 en l'estany. Els elements tecneci (43), prometi (61) i tots els que estan més enllà del bismut (83) no tenen isòtops estables.[61]
L'estabilitat dels isòtops es veu afectada per la proporció de protons a neutrons, així com per la presència de certs "nombres màgics" de neutrons o protons que representen capes quàntiques tancades i completes. Aquestes capes quàntiques corresponen a un conjunt de nivells d'energia dins del model de capes del nucli; les capes completes, tals com la capa completa de 50 protons de l'estany, confereixen una estabilitat poc usual al núclid. Dels 254 núclids estables coneguts, només quatre tenen un nombre imparell de protons i també un nombre imparell de neutrons: l'hidrogen-2 (deuteri), el liti-6, el bor-10 i el nitrogen-14. D'altra banda, només quatre núclids imparell-imparell radioactius que ocorren naturalment tenen una semivida de més de mil milions d'anys: el potassi-40, el vanadi-50, el lantani-138 i el tàntal-180m. La majoria de núclids imparell-imparell són altament inestables respecte a la desintegració beta, perquè els productes de la desintegració són parell-parell i, per tant, enllaçats més fortament a causa dels efectes d'emparellament nuclear.[61]
La major part de la massa de l'àtom prové dels protons i neutrons que el componen. El nombre total d'aquestes dues partícules (anomenades "nucleons") en un cert àtom s'anomena nombre màssic. Aquest valor és un nombre enter positiu i adimensional (no té dimensió de massa), perquè expressa un comptatge. Un exemple de l'ús del nombre màssic és «carboni-12», àtom que té 12 nucleons (sis protons i sis neutrons).
La massa d'un àtom en repòs s'expressa sovint utilitzant la unitat de massa atòmica unificada (u), també anomenada dalton (Da). Aquesta unitat es defineix com la dotzena part de la massa de l'àtom neutre lliure de carboni-12, la qual cosa és aproximadament 1,66×10−27 kg.[62] L'hidrogen-1 (l'isòtop més lleuger de l'hidrogen, que també és el núclid amb la massa més petita) té una massa atòmica d'1,007825 u.[63] El valor d'aquest nombre s'anomena massa atòmica. Un cert àtom té una massa atòmica aproximadament igual (dins de l'1%) al seu nombre màssic multiplicat per la unitat de massa atòmica (per exemple, la massa d'un àtom de nitrogen-14 és aproximadament 14 u). Tanmateix, aquest nombre no és mai exactament un enter excepte en el cas del carboni-12 (vegeu a sota).[64] L'àtom estable més pesant és el plom-208,[57] amb una massa de 207,9766521 u.[65]
Com que fins i tot els àtoms més massius són, de lluny, massa lleugers per treballar-hi directament, els químics utilitzen en comptes la unitat del mol. Un mol d'àtoms de qualsevol element sempre té el mateix nombre d'àtoms (al voltant de la constant d'Avogadro, 6,022×1023). Aquest nombre fou escollit de tal manera que si un element té una massa atòmica d'1 u, un mol d'àtoms d'aquest element té una massa propera a un gram. A causa de la definició de la unitat de massa atòmica unificada, cada àtom de carboni-12 té una massa atòmica exactament de 12 u i, per tant, un mol d'àtoms de carboni-12 pesa exactament 0,012 kg.[62]
Els àtoms no tenen una frontera exterior ben definida, per la qual cosa les seves dimensions normalment es descriuen en termes d'un radi atòmic. Això és una mesura de la distància fins a la qual el núvol d'electrons s'estén respecte al nucli.[66] Això no obstant, això assumeix que l'àtom presenta una forma esfèrica, la qual cosa només ocorre quan es troben al buit o a l'espai lliure. Els radis atòmics es poden derivar de les distàncies entre dos nuclis quan els dos àtoms estan enllaçats per un enllaç químic. El radi varia amb la localització de l'àtom a la taula periòdica, el tipus d'enllaç químic, el nombre d'àtoms veïns (nombre de coordinació) i una propietat mecànica quàntica coneguda com a espín.[67] A la taula periòdica dels elements, la mida de l'àtom tendeix a augmentar quan es baixa per les columnes, però es redueix quan es mou cap a la dreta a les files.[68] Conseqüentment, l'àtom conegut més petit és el de l'heli, amb un radi de 32 pm, mentre que un dels més grans és el del cesi, amb 225 pm.[69]
Quan està sotmès a forces externes, com per exemple camps elèctrics, la forma de l'àtom es pot desviar de la simetria esfèrica. La deformació depèn de la magnitud del camp i del tipus orbitals dels electrons de la capa més externa, tal com mostren les consideracions de teoria de grups. Les desviacions esfèriques es poden obtenir, per exemple, en cristalls, en els quals poden ocórrer grans camps cristall-elèctrics en llocs d'entramat de poca simetria.[70][71] S'ha demostrat que ocorren deformacions el·lipsoides significatives en ions sulfur[72] i ions calcogen[73] en compostos de tipus pirita.
Les dimensions atòmiques són milers de vegades més petites que les longituds d'ona de la llum (400–700 nm), per la qual cosa no poden ser vistes mitjançant un microscopi òptic. Tanmateix, els àtoms individuals es poden veure mitjançant un microscopi d'efecte túnel. Per visualitzar la menudesa de l'àtom, es pot comparar amb un cabell humà típic, que té un gruix equivalent a 1 milió d'àtoms de carboni.[74] Una sola gota d'aigua conté uns 2×1021 àtoms d'oxigen i el doble d'hidrogen.[75] Un diamant d'un quirat d'una massa de 2×10−4 kg conté uns 1022 àtoms de carboni.[nota 1] Si es magnifiqués una poma a la mida de la Terra, llavors els àtoms de la poma tindrien, aproximadament, la mida de la poma original.[76]

Tot element té un isòtop o més amb nuclis inestables que estan subjectes a la desintegració radioactiva, la qual causa que el nucli emeti partícules o radiació electromagnètica. La radioactivitat pot ocórrer quan el radi d'un nucli és gran en comparació amb el radi de la força forta, la qual només actua en distàncies més grans de l'ordre d'1 fm.[77]
Les formes més comunes de desintegració radioactiva són:[78][79]
Altres tipus més rars de desintegració radioactiva inclouen l'expulsió de neutrons, protons o clústers de nucleons d'un nucli, o més d'una partícula beta. Un anàleg de l'emissió gamma que permet que nuclis excitats perdin energia d'una manera diferent és la conversió interna, un procés que produeix electrons d'alta velocitat que no són raigs beta, seguits de la producció de fotons d'alta energia que no són raigs gamma. Alguns nuclis grans explosionen en dos o més fragments carregats, de masses variants, més uns quants neutrons en una desintegració anomenada fissió nuclear espontània.
Cada isòtop radioactiu té un període de desintegració característic –la semivida– que ve determinat per la quantitat de temps necessària perquè es desintegri la meitat d'una mostra. Aquest és un procés de desintegració exponencial que fa decréixer constantment la proporció de l'isòtop romanent en un 50% cada semivida; per exemple, després que hagin passat dues semivides, només queda present el 25% de l'isòtop.[77]
Les partícules elementals posseeixen una propietat mecanicoquàntica intrínseca coneguda com a espín. Aquesta propietat és anàloga al moment angular d'un objecte giravoltant al voltant del seu centre de masses, encara que, estrictament parlant, aquestes partícules són considerades puntuals i no es pot dir que rotin. L'espín es mesura en unitats de la constant de Planck reduïda (ħ); els electrons, protons i neutrons tenen tots un espín ½ ħ, o "espín-½". En un àtom, els electrons en moviment al voltant del nucli posseeixen un moment angular orbital a més a més del seu espín, mentre que el mateix nucli posseeix moment angular a causa del seu espín nuclear.[80]
El camp magnètic produït per un àtom –el seu moment magnètic– ve determinat per aquestes diferents formes de moment angular, d'igual manera que un objecte carregat que rota, en mecànica clàssica, produeix un camp magnètic. Això no obstant, la contribució més dominant prové de l'espín electrònic. A causa de la naturalesa dels electrons, que obeeixen el principi d'exclusió de Pauli segons el qual no se'n poden trobar dos en el mateix estat quàntic, els electrons enllaçats s'aparellen l'un amb l'altre, amb un membre de cada parell d'espín tal que es cancel·len l'un amb l'altre; això redueix el moment dipolar magnètic total a zero en alguns àtoms amb un nombre d'electrons parell.[81]
En elements ferromagnètics tals com el ferro, el cobalt o el níquel, un nombre imparell d'electrons fa que en quedi un sense aparellar i, per tant, hi hagi un moment magnètic net total. Els orbitals d'àtoms veïns se sobreposen i s'assoleix un estat d'energia inferior quan els espíns dels electrons sense aparellar s'alineen: es tracta d'un procés espontani conegut com a interacció d'intercanvi. Quan els moments magnètics dels àtoms ferromagnètics s'alineen, el material pot produir un camp macroscòpic mesurable. D'altra banda, els materials paramagnètics tenen àtoms amb moments magnètics que s'alineen en direccions aleatòries quan no hi ha un camp magnètic present, però els moments magnètics dels àtoms individuals s'alineen en presència d'un camp.[81][82]
El nucli d'un àtom no té espín quan té nombres parells tant de neutrons com de protons, però per altres casos de nombres imparells el nucli pot tenir espín. Normalment, el nuclis amb espín s'alineen en direccions aleatòries a causa de l'equilibri tèrmic. Tanmateix, en certs elements (tals com el xenó-129) és possible polaritzar una proporció significativa dels estats d'espín nuclears de tal manera que s'alineïn tots en la mateixa direcció: es tracta d'una condició anomenada hiperpolarització que té aplicacions importants en imatge per ressonància magnètica.[83][84]

L'energia potencial d'un electró d'un àtom és negativa. La seva dependència de la posició arriba al mínim (en valor absolut, màxim) dins del nucli, i s'esvaeix quan la distància respecte aquest s'acosta a l'infinit, aproximadament en proporcionalitat inversa respecte a la distància. En el model mecanicoquàntic, un electró enllaçat només pot ocupar un cert conjunt d'estats centrats al nucli, i cada estat correspon a un nivell energètic específic (vegeu Equació de Schrödinger per una explicació teòrica). Un nivell energètic es pot mesurar per la quantitat d'energia necessària per separar l'electró de l'àtom, mesura que se sol donar en electrons-volt (eV). L'estat energètic més baix d'un electró enllaçat s'anomena estat fonamental o estacionari, mentre que una transició electrònica a nivells superiors resulta en un estat excitat.[85] L'energia de l'electró creix quan n creix, ja que la distància (mitjana) al nucli augmenta. La dependència de l'energia respecte el nombre quàntic azimutal (ℓ) no és causada pel potencial electroestàtic del nucli, sinó per la interacció entre electrons.
Per tal que un electró transiti entre dos estats diferents com, per exemple, de l'estat fonamental al primer nivell d'excitació (ionització),ha d'absorbir o emetre un fotó a una energia que coincideixi amb el potencial energètic entre aquests dos nivells, segons el model de Niels Bohr, que es pot calcular amb precisió mitjançant l'equació de Schrödinger. Els electrons salten entre orbitals com si fossin una partícula: per exemple, si un sol fotó "ataca" els electrons, llavors un sol electró canvia d'estat en resposta al fotó (vegeu Orbital atòmic).
L'energia d'un fotó emès és proporcional a la seva freqüència, per la qual cosa aquests nivells específics d'energia apareixen com a bandes diferenciades a l'espectre electromagnètic[86] Cada element posseeix un espectre característic que pot dependre de la càrrega nuclear, les subcapes emplenades amb electrons, les interaccions electromagnètiques entre aquests i altres factors.[87]

Quan un espectre d'energia continu és passat a través de gas o plasma, alguns dels fotons són absorbits per àtoms, la qual cosa fa que els electrons canviïn el seu nivell energètic. Aquests electrons excitats que romanen enllaçats al seu àtom emeten espontàniament aquesta energia com a fotó, viatjant en una direcció aleatòria, i per tant cauen a nivells d'energia més baixos. Els àtoms es comporten, doncs, com un filtre que forma una sèrie de bandes d'absorció fosques en la producció d'energia.[nota 2] Les mesures espectroscòpiques de la magnitud i amplada de les línies atòmiques espectrals permeten determinar la composició i propietats físiques d'una substància.[88]
Un examen de les línies espectrals revela que algunes mostren un desdoblament d'estructura fina. Això ocorre a causa de l'acoblament espín-òrbita, que és una interacció entre l'espín i el moviment de l'electró més extern.[89] Quan un àtom es troba en un camp magnètic extern, les línies espectrals se separen en tres o més components en un fenomen conegut com a efecte Zeeman. Això es causat per la interacció del camp magnètic amb el moment magnètic de l'àtom i els seus electrons. Alguns àtoms poden tenir múltiples configuracions electròniques amb el mateix nivell energètic, i per tant apareixen com una sola línia espectral. La interacció del camp magnètic amb l'àtom desplaça aquestes configuracions electròniques a nivells energètics lleugerament diferents, cosa que resulta en múltiples línies espectrals.[90] La presència d'un camp elèctric extern pot causar un desplaçament i separació de línies espectrals comparable modificant els nivells energètics dels electrons, un fenomen anomenat efecte Stark.[91]
Si un electró enllaçat és en un estat excitat, un fotó que interaccioni amb l'energia adequada pot causar una emissió estimulada d'un fotó amb un nivell energètic equivalent. Perquè això ocorri, l'electró ha de caure a un nivell energètic inferior que tingui una diferència d'energia coincident amb l'energia del fotó que interacciona. El fotó emès i el fotó es mouen llavors en paral·lel i amb fases corresponents; és a dir, els patrons d'ona dels dos fotons estan sincronitzats. Aquesta propietat física s'utilitza per fabricar làsers, els quals emeten un feix coherent d'energia lluminosa en una banda de freqüència prima.[92]
La valència és el poder combinatori d'un element. Es defineix com el nombre d'àtoms d'hidrogen que poden enllaçar-se amb un àtom d'aquest o ser substituïts per ell.[93] La capa d'electrons més externa d'un àtom sense combinar es coneix com a capa de valència, i els electrons que s'hi troben s'anomenen electrons de valència. El nombre d'electrons de valència determina el comportament d'enllaç amb altres àtoms. Els àtoms tendeixen a reaccionar químicament els uns amb els altres de manera que s'emplenin (o es buidin) les seves capes de valència.[94] Per exemple, una transferència d'un sol electró entre àtoms és una aproximació útil dels enllaços que es formen entre àtoms que tenen un electró més que una capa complerta, i altres que els falta un electró per tenir una capa complerta: això ocorre, per exemple, amb el clorur de sodi i altres sals químiques iòniques. Tanmateix, molts elements tenen múltiples valències, o tendències a compartir diferents nombres d'electrons en diferents compostos; com a conseqüència, l'enllaç químic entre aquests elements pren moltes formes de compartició d'electrons que són més que simples transferències d'aquests. Exemples inclouen l'element carboni i els compostos orgànics.[95]
Els elements químics se solen ordenar en una taula periòdica disposada de tal manera que s'hi mostren les propietats químiques recurrents, i els elements amb el mateix nombre d'electrons de valència formen un grup que es troba alineat en la mateixa columna de la taula.[nota 3] Els elements que es troben a la dreta del tot de la taula tenen la seva capa externa emplenada completament d'electrons, cosa que els converteix en elements químicament inerts: són els gasos nobles.[96][97]

Els àtoms es troben en diferents estats de la matèria, els quals depenen de les condicions físiques de l'ambient, tals com la temperatura i la pressió. Variant aquestes condicions, els materials poden transitar entre sòlids, líquids, gasos i plasmes.[98] Dins d'un mateix estat, un material pot també existir en diferents al·lòtrops. Un exemple d'això n'és el carboni sòlid, que pot existir com a grafit o com a diamant.[99] També existeixen al·lòtrops gasosos, com el dioxigen i l'ozó.
A temperatures properes al zero absolut, els àtoms poden formar un condensat de Bose-Einstein, punt en el qual els efectes mecanicoquàntics, que normalment només s'observen a escala atòmica, esdevenen aparents a escala macroscòpica.[100][101] Aquesta col·lecció d'àtoms superrefredada es comporta com un superàtom, el qual permet fer comprovacions fonamentals de comportament mecanicoquàntic.[102]

El microscopi de rastreig d'efecte túnel és un aparell que serveix per visualitzar superfícies a escala atòmica. Es basa en l'efecte túnel, un fenomen que permet a les partícules travessar una barrera que en condicions normals no podrien superar. Els electrons passen pel buit que hi ha entre dos elèctrodes de metall planar, cadascun dels quals té un àtom en adsorció, i generen una densitat de corrent per efecte túnel que es pot mesurar. El rastreig d'un àtom (punta) quan passa al costat de l'altre (mostra) permet traçar el desplaçament de la punta en comparació amb la separació lateral per a un corrent constant. El càlcul indica fins a quin punt són visibles les imatges de microscòpia de rastreig d'efecte túnel d'un àtom individual, a més de confirmar que, amb poc biaix, el microscopi mostra les dimensions mitjanades en l'espai dels orbitals electrònics a través de nivells d'energia molt compactats: la densitat local d'estats al nivell de Fermi.[103][104]
Un àtom es pot ionitzar traient-li un dels seus electrons. La càrrega elèctrica fa que la trajectòria d'un àtom es corbi quan passa a través d'un camp magnètic; el radi d'aquesta trajectòria ve determinat per la massa de l'àtom. L'espectròmetre de masses utilitza aquest principi per mesurar la proporció massa-càrrega dels ions. Si una mostra conté isòtops diversos, l'aparell pot determinar la proporció de cadascun d'ells mesurant la intensitat dels diferents feixos de ions. Les tècniques per vaporitzar els àtoms inclouen l'espectrometria d'emissió atòmica per plasma acoblat inductivament i l'espectrometria de masses per plasma d'acoblament inductiu: ambdues utilitzen un plasma per vaporitzar mostres pel seu anàlisi.[105]
Un mètode més selectiu d'àrea és l'espectroscòpia de pèrdua d'energia d'electrons, que mesura la pèrdua d'energia d'un feix d'electrons dins d'un microscopi electrònic de transmissió quan interacciona amb una part de la mostra. La sonda atòmica tomogràfica té una resolució subnanomètrica en tres dimensions i pot identificar químicament àtoms individuals utilitzant l'espectroscòpia de masses de temps de vol.[106]
Els espectres d'estats excitats es poden utilitzar per analitzar la composició atòmica d'estels distants. Les longituds d'ona de llum específiques contingudes en la llum observada dels estels es pot destriar i relacionar amb les transicions quantititzades d'àtoms de gas lliure. Aquests colors poden ser replicats utilitzant una làmpada de descàrrega que contingui el mateix element.[107] L'heli fou descobert d'aquesta manera en l'espectre del Sol 23 anys abans de ser trobat a la Terra.[108]
Els àtoms constitueixen al voltant d'un 4% del total de la densitat d'energia de l'univers observable, amb una densitat mitjana d'uns 0,25 àtoms/m³.[109] Dins d'una galàxia tal com la Via Làctia, els àtoms tenen una concentració molt superior, amb una densitat de matèria en el medi interestel·lar que va dels 10⁵ fins als 10⁹ àtoms/m³.[110] Es creu que el Sol es troba dins de la Bombolla Local, una regió de gas altament ionitzat, de tal manera que la densitat en les regió propera a l'astre és només d'uns 10³ àtoms/m³.[111] Els estels es formen a partir de núvols densos del medi interestel·lar; els processos evolutius dels estels tenen com a resultat un enriquiment regular d'aquest medi amb elements més massius que l'hidrogen i l'heli. Fins a un 95% dels àtoms de la Via Làctia estan concentrats dins d'estels, i la massa total dels àtoms suma aproximadament un 10% de la massa de la galàxia.[112][nota 4][113]
Es creu que els electrons existeixen a l'univers des de les primeres etapes del big-bang. Els nuclis atòmics es formen en reaccions de nucleosíntesi: en uns tres minuts, la nucleosíntesi del big-bang produí la majoria de l'heli, liti i deuteri de l'univers, i potser part del beril·li i del bor.[114][115][116]
La ubiqüitat i estabilitat dels àtoms depèn de la seva energia d'enllaç, la qual cosa significa que un àtom té una energia menor que un sistema desunit de nucli i electrons. On la temperatura és molt superior que el potencial d'ionització, la matèria existeix en forma de plasma –un gas de ions carregats positivament (possiblement, nuclis sols) i electrons. Quan la temperatura cau per sota del potencial de ionització, els àtoms esdevenen estadísticament favorables. Els àtoms (complets amb electrons enllaçats) esdevingueren dominants sobre les partícules carregades elèctricament 380.000 anys després del big-bang, en un moment anomenat recombinació, en el qual l'univers en expansió es refredà prou com per permetre que els electrons s'unissin als nuclis.[117]
Des del big-bang, en el qual no es produí carboni ni elements més pesants, els nuclis atòmics s'han combinat dins dels estels mitjançant el procés de fusió nuclear per produir més àtoms d'heli i, gràcies al procés triple-alfa, la seqüència d'elements des del carboni fins al ferro (vegeu Nucleosíntesi estel·lar per a més detalls).[118]
Els isòtops tals com el liti-6, així com alguns del beril·li i del bor, es generen a l'espai mitjançant l'espal·lació de raigs còsmics.[119] Això té lloc que un protó d'alta energia col·lisiona amb un nucli atòmic, cosa que fa que s'expulsin grans nombres de núclids.
Els elements més pesants que el ferro foren produïts en supernoves per mitjà del procés R i en estels BAG per mitjà del procés S. Ambdós processos comprenen la captura de neutrons per part dels nuclis atòmics.[120] Elements tals com el plom es formaren en gran part a partir de la desintegració radioactiva d'elements més pesants.[121]
La majoria dels àtoms que formen la Terra i els seus habitants ja es trobaven presents en la seva forma actual a la nebulosa que col·lapsà d'un núvol molecular per formar el sistema solar. La resta són el resultat de la desintegració radioactiva, i la seva proporció relativa es pot fer servir per determinar l'edat de la Terra mitjançant datació radiomètrica.[122][123] La majoria d'heli de l'escorça terrestre (al voltant d'un 99% de l'heli dels pous de gas, tal com es veu per la seva baixa abundància d'heli-3) és un producte de la desintegració alfa.[124]
Hi ha alguns àtoms traça a la Terra que no eren presents al principi (és a dir, no són "primordials") ni són resultat de la desintegració radioactiva. El carboni-14 és generat contínuament per raigs còsmics a l'atmosfera.[125] Alguns àtoms de la Terra han estat generats artificialment, ja sigui deliberadament o com a subproductes de reactors nuclears o explosions.[126][127] Dels elements transurànics –els de nombre atòmic més gran de 92– tan sols el plutoni i el neptuni ocorren de manera natural a la Terra.[128][129] Els elements transurànics tenen temps de vida radioactius més curts que l'edat actual terrestre[130] i, per tant, quantitats identificables d'aquests elements s'han desintegrat des de llavors, amb l'excepció de traces de plutoni-244 dipositades possiblement per pols còsmica.[122] Dipòsits naturals de plutoni i neptuni són produïts per captura neutrònica en menes d'urani.[131]
La Terra conté aproximadament 1,33×1050 àtoms.[132] Encara que existeix un petit nombre d'àtoms independents de gasos nobles –com l'argó, el neó i l'heli–, el 99% de l'atmosfera terrestre conté àtoms agrupats en molècules, entre les quals el diòxid de carboni i oxigen i nitrogen diatòmics. A la superfície de la Terra, l'àmplia majoria d'àtoms es combinen per formar compostos diversos, entre els quals aigua, sal, silicats i òxids. Els àtoms també es poden combinar per crear materials que no consisteixen en molècules discretes, incloent-hi els cristalls i metalls líquids o sòlids.[133][134] Aquesta matèria atòmica forma disposicions en xarxa a les quals manca el tipus particular d'ordre interromput a petita escala associat amb la matèria molecular.[135]
Tot i que se sap que els isòtops de nombre atòmic més alt que 82 (plom) són radioactius, s'ha proposat una «illa d'estabilitat» per alguns elements de nombre atòmic superior al 103. Aquests elements superpesants poden tenir un nucli relativament estable enfront de la desintegració radioactiva.[136] El candidat més probable per ser un àtom superpesant estable, l'unbihexi, té 126 protons i 184 neutrons.[137]
Cada partícula de matèria té una partícula corresponent d'antimatèria de càrrega elèctrica oposada. Per tant, el positró és un antielectró carregat positivament, i l'antiprotó és l'equivalent del protó però carregat negativament. Quan es troben una partícula de matèria i una corresponent d'antimatèria s'aniquilen l'una a l'altra; a causa d'això, i també del desequilibri entre el nombre de partícules de matèria i antimatèria, aquestes darreres són més rares a l'univers. Les causes d'aquest desequilibri no es comprenen del tot, encara que les teories de la bariogènesi en podrien oferir una explicació. Com a resultat d'això, no s'han descobert àtoms d'antimatèria a la naturalesa;[138][139] tanmateix, el 1996 se sintetitzà l'homòleg d'antimatèria de l'àtom d'hidrogen (l'antihidrogen) al laboratori del CERN.[140][141]
S'han creat altres àtoms exòtics substituint un dels protons, neutrons o electrons per altres partícules de la mateixa càrrega. Per exemple, un electró pot ser reemplaçat per un muó més massiu i formar així un àtom muònic. Aquests tipus d'àtoms es poden utilitzar per testar les prediccions fonamentals de la física.[142][143][144]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.