RNK-polimeraza (skraćeno RNKP ili RNKpol i službeno DNK usmjerena RNA-polimeraza) – u molekulskoj biologiji – je enzim koji sintetizira RNK prema matričnom polulancu DNK .
| DNK-usmjerena RNK-polimeraza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Heteromer ljudske TNK-polimeraze II} | |||||||||
| Identifikatori | |||||||||
| EC broj | 2.7.7.6 | ||||||||
| CAS broj | 9014-24-8 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA unos | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG unos | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| PDB strukture | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologija gena | AmiGO / QuickGO | ||||||||
| |||||||||
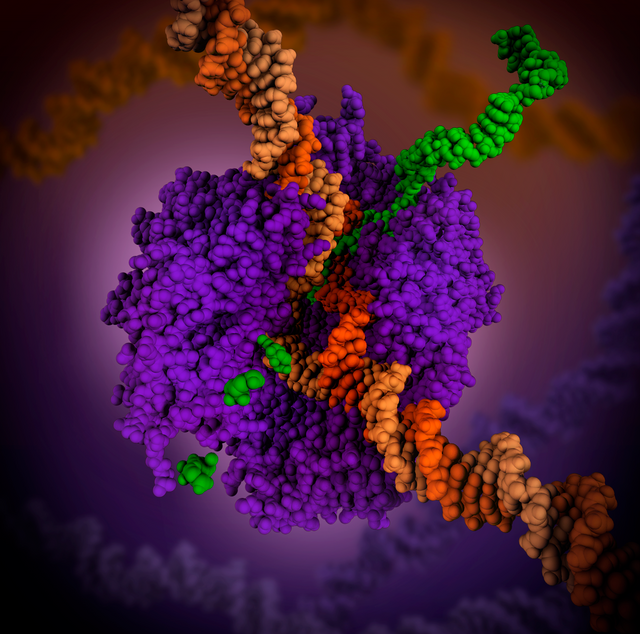
Korištenjem enzima helikaza, RNKP lokalno otvara dvolančanu DNK, tako da se jedan lanac izloženih nukleotida može koristiti kao predložak za sintezu RNK, u procesu zvanom transkripcija. Transkripcijski faktor i pridružena transkripcija kompleksa medijatora moraju biti vezani za mesto vezanja DNK zvano regija promotora, prije nego što RNKP može pokrenuti despiralizaciju DNK na tom položaju. RNKP ne samo da započinje transkripciju RNK, već i dovodi nukleotide u određeni položaj, olakšava vezanje i izduživanje, ima suštinske sposobnosti ispravki i zamjene, kao i sposobnost prepoznavanja završetka. Kod eukariota , RNKP može graditi lance dužine sve do 2,4 miliona nukleotida.
RNKP proizvodi RNK koja je, funkcijski, ili za kodiranje, proteinskog lanca tj. informacijska RNK (iRNK); ili nekodiranje (takozvani "RNK geni"). Postoje najmanje četiri funkcijska tipa RNK gena:
- transportna RNK (tRNK) – prenosi specifične aminokiseline na rastuće polipeptidne lance na ribosomskom mjestu sinteze proteina, tokom translacije;
- ribosomska RNK (rRNA) – ugrađuje se u ribosome;
- mikro-RNK (miRNK) – regulira aktivnost gena; i,
- katalitska RNK (ribozim) – funkcionira kao enzimski aktivna molekula RNK.
RNK-polimeraza bitna je za život i nalazi se u svim živim organizmima i mnogim virusima. Ovisno o organizmu, RNK-polimeraza može biti proteinski kompleks (multi-podjedinica RNKP) ili se sastojati samo od jedne podjedinice (RNKP, ssRNKP), od kojih svaka predstavlja neovisnu lozu. Prva se nalazi kod bakterija, arheja i eukariota, dijeleći sličnu strukturu jedra i mehanizam.[1] Potonji se nalazi u bakteriofagu, kao i u eukariotskim hloroplastima i mitohondrijama, a povezan je sa modernim DNK-polimerazama.[2] Eukariotski i arhejski RNKP-ovi imaju više podjedinica nego bakterijski i njima se drugačije kontrolira.
Bakterije i arheje imaju samo jednu RNK-polimerazu. Eukarioti imaju više tipova jedarnih RNKP-a, od kojih je svaki odgovoran za sintezu različitog podskupina RNK:
- RNK-polimeraza I sintetizira pre-rRNK 45 S (35S u kvascima), koja sazrijeva i formira glavne sekcije RNK ribosoma.
- RNK-polimeraza II sintetizira prekursornu iRNK i većinu sRNK i mikroRNK.
- RNK-polimeraza III sintetizira tRNK, rRNK 5S i druge male RNK koji se nalaze u jedru i citosolu.
- RNK-polimeraza IV i V, pronađene u biljkama, manje su razumljive; one proizvode siRNK. Pored ssRNAKP-a, hloroplasti također kodiraju i koriste RNKP, sličan bakterijskom.
Struktura
Nobelova nagrada za hemiju za 2006. godinu dodeljena je Rogeru D. Kornbergu za stvaranje detaljnih molekularnih slika RNK-polimeraze tokom različitih faza procesa transkripcije.[3]
U većini prokariota, jedan tip RNK-polimeraze transkribira sve tipove RNK. RNK-polimeraza "jedra" E. coli sastoji se od pet podjedinica: dvije alfa (α) podjedinice od 36 kDa, beta (β) podjedinica od 150 kDa, beta podjedinica (β′) od 155 kDa i mala omega (ω) podjedinica. Faktor sigma (σ) veže se za jedro, tvoreći holoenzim. Nakon započinjanja transkripcije, faktor se može odvezati i pustiti jedarni enzim da nastavi sa svojom aktivnošću.[4][5] Jezgreni kompleks RNK-polimeraze tvori strukturu "rakova kandža" ili "stezna čeljust" sa unutrašnjim kanalom koji prolazi cijelom dužinom.[6] RNK-polimeraze eukariota i arhea imaju sličnu strukturu jezgra i rade na sličan način, iako imaju mnogo dodatnih podjedinica.[7]
Svi RNAP-ovi sadrže metalni kofaktori, posebno katione cinka i magnezija, koji pomažu u procesu transkripcije.[8][9]
Funkcija

Kontrola procesa transkripcije gena utiče na obrasce ekspresije gena i, prema tome, omogućava ćelijama da se prilagode promenljivom okruženju, obavlja specijalizovane uloge u organizmu i održava osnovne metaboličke procese neophodne za preživljavanje. Stoga nije iznenađujuće da je aktivnost RNKP-a duga, složena i visoko regulirana. U bakteriji Escherichia coli identificirano je više od 100 faktora transkripcije, koji modificirauju aktivnost RNKP-a.[10]
RNKP može inicirati transkripciju na specifičnim sekvencama DNK, poznatim kao promotori . Zatim proizvodi RNK-lanac, koji je komplementarna kopija DNK-lanca. Proces dodavanja nukleotida lancu RNK poznat je kao elongacija (izduživanje); u eukariotima RNKP može graditi lance sve dok 2,4 miliona nukleotida (puna dužina distrofinskog gena). RNKP će preferencijski prezentirati svoj RNK transkript na specifičnim sekvencama DNK, kodiranim na kraju gena, koji su poznati kao terminatori.
Proizvodi RNAP-a uključuju:
- Informacijsku RNK (iRNK) – predložak za sintezu proteina u ribosomima. Tu su i
- Nekodirajuća RNK ili "RNK geni" – široka klasa gena koji kodiraju neprevedenu RNK u protein. Najistaknutiji primjeri RNK gena su transportna RNK (tRNK) i ribosomna RNK (rRNK), koji su uključeni u proces translacije. Međutim, od kasnih 1990-ih pronađeno je mnogo novih RNK-gena, pa stoga oni mogu imati mnogo značajniju ulogu nego što se ranije mislilo
- Transportna RNK (tRNA) – prenosi specifične aminokiseline na rastuće polipeptidne lance na ribosomskom mjestu sinteze proteina tokom translacije;
- Ribosomska RNK (rRNK) – komponenta ribosoma;
- Mikro RNK – regulira aktivnost gena;
- Katalitska RNK (ribozim) – enzimski aktivne molekule RNK.
RNAP postiže sintezu de novo. To je u stanju učiniti jer specifične interakcije s inicirajućim nukleotidom čvrsto drže RNKP, olakšavajući hemijski napad na dolazni nukleotid. Takve specifične interakcije objašnjavaju zašto RNAP radije započinje transkripte s ATP-om (slijedi GTP, UTP, a zatim CTP). Za razliku od DNK polimeraze, RNAP uključuje helikazu aktivnost, stoga nije potreban poseban enzim za odmotavanje DNK.
Aktivnost
Inicijacija
Vezanje RNK-polimeraze u bakterijama uključuje sigma faktor prepoznavanja promotorskog jezgra koje sadrži –35 i –10 elemenata (koji se nalaze prije početka sekvence koja će se transkribirati), a kod nekih promotora i α podjedinica C-krajevog domena koji prepoznaje uzlazne elemente promotora. Postoji više zamjenjivih sigma faktora, od kojih svaki prepoznaje zaseban skup promotora. Na primjer, u E. coli, σ70 izražen je u normalnim uvjetima i prepoznaje promotore za gene potrebne u normalnim uvjetima ("domaćinski geni"), dok σ32 prepoznaje promotore gena potrebnih na visokim temperaturama ("geni toplotnog šoka". U arhejama i eukariotima, funkcije bakterijskog općeg transkripcijskog faktora sigme obavljaju višestruki opći transkripcijski faktori, koji djeluju zajedno. Zatvoreni kompleks RNK-polimeraznog-promotora obično se naziva "kompleks transkripcijske inicijacije".[11][12]
Nakon vezanja za DNK, RNK-polimeraza prelazi iz zatvorenog u otvoreni kompleks. Ova promjena uključuje razdvajanje DNK lanaca kako bi se formirao odmotani dio od približno 13 bp, koji se naziva "mjehurić transkripcije". Superspirala ima važnu ulogu u aktivnosti polimeraze zbog odmotavanja i premotavanja DNK. Budući da su regije DNK ispred RNKP-a odmotane, postoje kompenzacijski pozitivni super-namotaji. Regije iza RNKP-a se premotavaju i prisutni su negativni supernamotaji.[12]
"Bijeg" promotora
RNK-polimeraza tada počinje sintetizirati početni DNK-RNK heterodupleks, s ribonukleotidima baznim uparenim u matricu DNK lanca prema Watson-Crickovoj interakciji baznog uparivanja. Kao što je gore napomenuto, RNK-polimeraza uspostavlja kontakt sa promotorskom regijom. Međutim, ovi stabilizacijski kontakti inhibiraju sposobnost enzima da pristupi DNK i dalje nizvodno, a time i sintezu produkta pune dužine. Da bi nastavila sintezu RNK, RNK-polimeraza mora „pobjeći“ iz promotora. Mora održavati kontakte promotora, dok odmotava više nizvodnih DNK za sintezu, "uvujanje" više nizvodnih DNK u inicijacijski kompleks.[13] > Za vrijeme tranzicije bijega promotora, RNK-polimeraza se smatra "intermedijarom pod stresom". Termodinamički stres akumulira se od aktivnosti odmotavanja i sabijanja DNK. Kada je DNK-RNK heterodupleks dovoljno dug (~ 10 bp), RNK-polimeraza oslobađa svoje gornje kontakte i efikasno postiže prelazak promotora u fazu izdužeivanja/elongacije. Heterodupleks u aktivnom centru stabilizira kompleks izduživanja.
Međutim, "bijeg" promotora nije jedini ishod. RNK-polimeraza također može ublažiti stres, oslobađanjem svojih nizvodnih kontakata, zaustavljanjem transkripcije. Pauzirani kompleks transkripcije ima dvije mogućnosti: (1) oslobađanje novonastalog transkripta i novo započinjanje kod promotora ili (2) ponovno uspostavljanje novog 3'OH na na aktivnom mjestu novonastalog transkripta, putem katalitske aktivnosti RNK-polimeraze i ponovnim probijanjem DNK kako bi se omogućio bijeg promotora. Abortivna inicijacija, neproduktivni ciklus RNK-polimeraze prije tranzicije bijega promotora, rezultira kratkim fragmentima RNK od oko 9 bp u procesu poznatom kao abortivna transkripcija. Opseg abortivnog započinjanja ovisi o prisutnosti faktora transkripcije i snazi kontakata promotora.[14]
Elongacija


Transkripcijski kompleks od 17 bp ima hibrid od 8 bp DNK-RNK, odnosno osam baznih parova uključuje RNA transkript vezan za matrični lanac DNK. Kako transkripcija odmiče, ribonukleotidi se dodaju na 3 'kraj RNK-transkripta i RNAKP kompleks se kreće duž DNK. Karakteristične brzine elongacije kod prokariota i eukariota su oko 10–100 nts/sec.[15]
Ostaci aspartila (asp) u RNKP-u zadržavaju se na ionima Mg2+, koji će zauzvrat koordinirati fosfate ribonukleotida. Prve Mg2+ zadržavat će α-fosfat NTP-a koji treba dodati. To omogućava nukleofilni napad 3'OH iz RNK-transkripta, dodajući još jedan NTP-lanac. Drugi ion Mg2+ zadržat će pirofosfat NTP-a.[16] Ukupna jednadžba reakcije je:
- n + → n+1 + i
Tačnost
Za razliku od lektorskih mehanizama DNK-polimeraze, mehanizmi RNKP-a istraženi su tek nedavno. „Lektorsko“ ispravljanje započinje odvajanjem pogrešno uklopljenih nukleotida DNK predloška. Ovo zaustavlja transkripciju. Polimeraza se zatim vraća za položaj jedan i cijepa dinukleotid koji sadrži neusklađeni nukleotid. U RNK-polimerazi to se događa na istom aktivnom mjestu koje se koristi za polimerizaciju i stoga se znatno razlikuje od DNK-polimeraze, gdje se lektura događa na određenom aktivno mjesto|aktivnom mjestu nukleaze.[17]
Ukupna stopa grešaka je oko 10−4 to 10−6.[18]
Terminacija
U bakterija, završetak transkripcije RNK može biti rho-ovisan ili rho-neovisan. Prvi se oslanja na rho faktor, koji destabilizira DNK-RNK heterodupleks i uzrokuje oslobađanje RNK.[19] Potonji, poznat i kao suštinski završetak, oslanja se na palindromski region DNK. Transkribiranje regije uzrokuje stvaranje strukture "ukosnice" transkripcije RNK koja stvara petlju i veže se za sebe. Ova struktura ukosnice često je bogata baznim parovima G-C, što je čini stabilnijom od samog DNK-RNK hibrida. Kao rezultat, hibrid od osam bp DNK-RNK u transkripcijskom kompleksu prelazi u hibrid od četiri bp. Ova posljednja 4-bazna para su slabi A-U bazni parovi i cijeli RNK-transkript otpast će s DNK.
Završetak transkripcije u eukariota manje je razumljiv nego kod bakterija, ali uključuje cijepanje novog transkripta, praćeno dodavanjem adenina na novom 3' kraju, neovisno o matrici, u procesu koji se naziva poliadenilacija.[20]
Ostali organizmi
S obzirom na to da DNK– i RNK-polimeraze provode polimerizaciju nukleotida ovisnu o kalupu, moglo bi se očekivati da će dva tipa enzima biti strukturno povezane. Međutim, rendgenska kristalografska studija oba tipa enzima otkrivaju da, osim što sadrže kritični ion Mg2+ na katalitskom mjestu, oni praktično nisu međusobno povezani ; zaista se čini da su nukleotidni polimerizacijski enzimi, koji su ovisni o predlošku nastali dva puta neovisno tokom rane evolucije ćelija. Jedna loza dovela je do modernih DNK-polimeraza i reverznih transkriptaza, kao i do nekoliko jednolančanih RNK-polimeraza (ssRNAP) iz faga i organela.[2] The other multi-subunit RNAP lineage formed all of the modern cellular RNA polymerases.[1][21]
Bakterije
Kod bakterija, isti enzim katalizira sintezu iRNK i nekodirajuća RNK (ncRNA).
RNAP je velika molekula. Jezgro ima pet podjedinica (~ 400 kDa) [22]
- β': β' podjedinica je najveća podjedinica i kodira je rpoC gen.[23] Podjedinica β' sadrži dio aktivnog centra odgovornog za sintezu RNK i neke odrednice za nesekvencu specifične interakcije s DNK i RNK u nastajanju. Podijeljen je na dvije podjedinice u cijanobakterijama i hloroplastima.[24]
- α: α podjedinica je treća po veličini podjedinica i prisutna je u dvije kopije po molekulu RNKP-a, αI i α II (jedna i dvije). Svaka α podjedinica sadrži dva domena: αNTD (domen N-kraja) i αCTD (domen C-kraja). αNTD sadrži odrednice za sastavljanje RNKP-a. αCTD (domen C-kraja) sadrži odrednice za interakciju s promotorskom DNK, čineći nesljedne nespecifične interakcije kod većine promotora i specifične za sekvence interakcije na promotorima koji sadrže uzvodne elemente i odrednice za interakcije s regulatornim faktorima.
- ω: ω podjedinica je najmanja od svih podjedinica. ω olakšava sastavljanje RNKP-a i stabilizira sklopljeni RNKP.[25]
Da bi se vezalo za promotore, jezgro RNKP povezuje se s faktorom inicijacije transkripcije sigma (σ) da bi se formirao holoenzim RNK-polimeraze. Sigma smanjuje afinitet RNAP-a za nespecifičnu DNK, istovremeno povećavajući specifičnost za promotore, omogućavajući započinjanje transkripcije na tačnim mjestima. Kompletni holoenzim stoga ima šest podjedinica: β'βαI and αIIωσ (~450 kDa).
Eukarioti

Eukaryoti imaju više tipova jedarnih RNKP-ova, od kojih je svaki odgovoran za sintezu posebne podskupine RNK. Svi su međusobno strukturno i mehanički povezani i s bakterijskim RNKP-om:
- RNK-polimeraza I sintetizira pre-rRNK 45S (35S u kvascu), koji sazrijeva u 28S, 18S i 5.8S rRNA, koji će formirati glavne ribosomske sekcije RNK.[26]
- RNK-polimeraza II sintetizira prekursore iRNK i većinu snRNK i mikroRNK.[27] Ovo je najviše proučavan tip, a zbog visokog nivoa kontrole koji je potreban nad transkripcijom, potreban je niz transkripcijskih faktora za njegovo vezanje za promotore.
- RNA polimeraza III sintetizira tRNK , rRNK 5S i druge male RNK pronađene u jedru i citosolu.[28]
- RNK- polimeraza IV sintetizira siRNK u biljkama.[29]
- RNK polimeraza V sintetizira RNK uključene u siRNK usmjerenu heterohromatinsku tvorbu u biljkama.[30]
Eukariotski hloroplasti sadrže RNKP vrlo sličan bakterijskom RNKP ("polimeraza kodirana s plastidom, PEP"). Koriste sigma faktore kodirane u jedarnom genomu.[31]
Hloroplasti također sadrže drugu, strukturno i mehanički nepovezanu, jednopodjedinicu RNKP ("jedrom kodirana polimeraza , NEP"). Eukariotske mitohondrije koriste POLRMTjednodijelnu , kodiranu jezgru RNKP]].[2] Takve fagima-slične polimeraze u biljkama nazivaju se RpoT.[31]
Archaea
Archaea imaju jedan tip RNKP-a, odgovornog za sintezu svih RNK. Njihov RNKP strukturno je i mehanički sličan bakterijskom RNKP-u i eukariotskom nuklearnom RNKP-u I, a posebno je usko strukturno i mehanički povezan s eukariotskim jedarnim RNKP-om II.[7][32]
Historija otkrića RNK-polimeraze arhea prilično je novijeg datuma. Prva analiza RNKP-a arhea izvršena je 1971., kada je RNKP iz krajnjeg halofilnog Halobacterium cutirubrum izolovan i pročišćen.[33] Kristalne strukture RNKP-a iz Sulfolobus solfataricus i Sulfolobus shibatae postavljaju ukupan broj identifikovanih arhejskih podjedinica na trinaest.[7][34]
Archaea imaju podjedinicu koja odgovara eukariotskom Rpb1. podijeljenu na dva dijela. Ne postoji homolog eukariotskog Rpb9 (POLR2I) u S. shibatae, iako je TFS (homolog TFIIS) predložen kao jedan na osnovu sličnosti. Postoji dodatna podjedinica nazvana Rpo13; zajedno s Rpo5 zauzima prostor ispunjen insercijom koja se nalazi u bakterijskim β' podjedinicama (1.377-1.420 u Taq).[7] Ranija studija niže rezolucije o strukturi S. solfataricus nije pronašla Rpo13 i samo je prostor dodijelila Rpo5 / Rpb5. Rpo3 je značajan po tome što je klaster protein željezo-sumpor. RNAP I / III podjedinica AC40, pronađena u nekih eukariota ima slične sekvence,[34], ali ne veže gvožđe.[35] This domain, in either case, serves a structural function.[36]
Podjedinica RNKP-a arhea prethodno je koristila "RpoX" nomenklaturu gdje je svakoj podjedinici dodeljeno slovo na način koji nije povezan sa bilo kojim drugim sistemom.[1] U 2009., predložene je numeriranje po novoj nomenklaturi, zasnovana na eukariotskoj Pol II podjedinici "Rpb.[7]
Virusi
[[Datoteka:RNA pol.jpg|thumb|right|T7 RNK- polimeraza koja stvara iRNK (zelena) iz DNK predloška. Protein je prikazan u obliku ljubičaste vrpce. Slika je izvedena iz linka PDB 1MSW
Ortopoksvirus i neki drugi nukleocitoplazmatski veliki DNK virusi sintetiziraju RNK pomoću vizuelno kodiranog višepodjediničnog RNKP. Oni su najsličniji eukariotskim RNKP-ima, s tim da su neke podjedinice minimizirane ili uklonjene.[37] Exactly which RNAP they are most similar to is a topic of debate.[38] Većina drugih virusa koji sintetiziraju RNK koriste nepovezane mehanizme.
Mnogi virusi koriste RNKP koji ovisi o jednoj podjedinici (ssRNKP) , strukturno i mehanički povezanom sa jednostavnom podjedinicom RNKP-om eukariotskih hloroplasta (RpoT) i mitohondrija (POLRMT), a što je dalje i za DNK-polimeraze i reverzne transkriptaze . Možda je najšire proučavan takav jednojedinični RNKP bakteriofaga T7 RNK polimeraza. ssRNAP-ovi ne mogu lektorirati.[2]
Ostali virusi koriste RNK-zavisnu RNKP (RNKP koji koristi RNK kao obrazac umjesto DNK). To se događa u virusima negativnih lanaca RNK i virusi dsRNK, koji dio svog životnog ciklusa postoje kao dvolančana RNK . Međutim, neki RNK virusi pozitivnih lanaca, kao što je polio virus, sadrže i RNKP-zavisni RNKP.[39]
Historija
RNKP su nezavisno otkrili Charles Loe, Audrey Stevens i Jerard Hurwitz 1960.[40] Do tada je polovinu Nobelove nagrada za fiziologiju ili medicinu dobio Severo Ochoa, za otkriće onoga za šta se vjerovalo da je RNKP, ,[41], ali se umjesto toga pokazalo da je to polinukleotid fosforilaza.
Prečišćavanje
RNK-polimeraza može se izolirati na sljedeće načine:
- Hromatografija;[42]
- Glicerolskim gradijentom centrifugiranja;[43]
- Dnk kolonom;
- Kolonom ionske hromatografije;[44]
Također se primjenjuju i kombinacije gore navedenih tehnika.
Također pogledajte
Reference
Vanjski linkovi
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.






