From Wikipedia, the free encyclopedia
Histon H2A je jedan od pet glavnih histonskih proteina uključenih u strukturu hromatina u eukariotskim ćelijama.
Ostali histonski proteini su: H1, H2B, H3 i H4.


Histoni su proteini koji pakuju DNK u nukleosome.[1] Histoni su odgovorni za održavanje oblika i strukture nukleosoma. Jedna molekula hromatina sastoji se od najmanje jednog histona svakog jezgra na 100 baznih parova DNK.[2] Do danas je poznato pet porodica histona; ovi histoni se nazivaju H1/H5, H2A, H2B, H3 i H4.[3] H2A se smatra jezgarnim histonom, zajedno sa H2B, H3 i H4. Formiranje jezgra se prvo dešava kroz interakciju dvije molekule H2A.[3] Zatim, H2A formira dimer sa H2B; jezgarna molekula je potpuna kada se i H3-H4 veže i formira tetramer.
Histon H2A se sastoji od nealelnih varijanti.[4] Termin "histon H2A" je namjerno nespecifičan i odnosi se na niz blisko povezanih proteina koji se često razlikuju za samo nekoliko aminokiselina. Osim kanonskog oblika, značajne varijante uključuju H2A.1, H2A.2, H2A.X i H2A.Z. H2A varijante se mogu istražiti koristeći "HistoneDB sa bazom podataka varijanti Promjene u varijantnom sastavu se javljaju u ćelijama koje se diferenciraju. Ovo je uočeno u diferenciranju neurona tokom sinteze i prometa; promjene u varijantnom sastavu uočene su među histonom H2A.1. Jedina varijanta koja je ostala konstantna u nervnoj diferencijaciji bila je varijanta H2A.Z.[4] H2A.Z je varijanta koja se izmjenjuje sa konvencijskim jezgarnim proteinom H2A; ova varijanta je važna za utišavanje gena.[5]
Fizički, postoje male promjene na površini nukleosoma koje čine histon drugačijim od H2A. Nedavna istraživanja sugeriraju da je H2AZ inkorporiran u nukleosom pomoću Swr1, Swi2/Snf2 srodne adenozin-trifosfataze.[6]
Još jedna H2A varijanta koja je identificirana je H2AX. Ova varijanta ima ekstenziju C-terminala, koja se koristi za popravku DNK. Metod popravke koju ova varijanta koristi je nehomologno spajanje krajeva. Direktno oštećenje DNK može izazvati promjene u varijantama sekvence. Eksperimenti izvedeni sa ionizirajućim zračenjem povezanim γ-fosforilacijama H2AX do prekida dvolančane DNK.[7] A large amount of chromatin is involved with each DNA double-strand break; a response to DNA damage is the formation of γ- H2AX.
Na kraju, varijanta MacroH2A je varijanta koja je slična H2A; kodira je gen H2AFY. Ova varijanta se razlikuje od H2A zbog dodavanja domena nabora u njenom C-terminalnom repu. MakroH2A se izražava u neaktivnom X hromozomu kod žena.[8]

H2A se sastoji od glavnog globulskog domena, N-terminalnog i C-terminalnog repa.[9] Oba repa su lokacija posttranslacijskih modifikacija. Do sada, istraživači nisu identifikovali nijednu sekundarnu strukturu koja nastaje u repovima. H2A koristi proteinski nabor poznat kao "histonski nabor". Histonski nabor je jezgarni domen sa tri heliksa koji je povezan sa dvije petlje. Ova veza formira 'aranžman rukovanja'. Najznačajnije, ovo se naziva heliks-obrt-heliksni motiv, koji omogućava dimerizaciju sa H2B. 'Histonski nabor' je konzerviran među H2A na strukturnom nivou; međutim, genska sekvenca koja kodira ovu strukturu razlikuje se između varijanti.[10]
Struktura varijante makroH2A izložena je putem kristalografije X-zrake. Konzervirani domen sadrži strukturu vezivanja DNK i nabor peptidaza.[11] Funkcija ovog konzerviranog domena ostaje nepoznata. Istraživanja sugeriraju da ovaj konzervirani domen može funkcionirati kao sidro za Xist DNK ili može funkcionirati i kao modificirajući enzim.
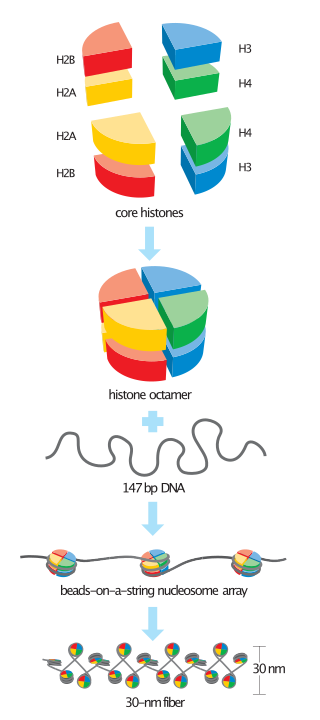
H2A je važna za pakovanje DNK u hromatin. Pošto H2A pakuje molekule DNK u hromatin, proces pakovanja će uticati na ekspresiju gena. H2A je u korelacijama sa modifikacijom DNK i epigenetikom. H2A ima glavnu ulogu u određivanju ukupne strukture hromatina. Nehotice je otkriveno da H2A reguliše ekspresiju gena.[10]
Modifikacija DNK pomoću H2A događa se u ćelijskom jedru. Proteini odgovorni za jedarni unos H2A proteina su karioferin i importin.[12] Nedavne studije pokazuju i da se protein 1 za sklapanje nukleosoma također koristi za transport H2A u jedro kako bi mogao obaviti DNK. Druge funkcije H2A viđene su u histonskoj varijanti H2A.Z. Ova varijanta je povezana sa aktivacijom gena, utišavanjem i supresijom antisens RNK. Osim toga, kada je H2A.Z proučavan u ljudskim i kvaščevim ćelijama, korišten je za podsticanje regrutacije RNK-polimeraze II.[13]
Histoni su konzervirani eukariotskim kationskim proteinima, prisutni u ćelijama i uključeni su u antimikrobno djelovanje. Kod kičmenjaka i beskičmenjaka, varijanta histona H2A uključena je u imunski odgovor domaćina, djelujući kao antimikrobni peptidi (AMP). H2A su α-heliksne molekule, amfipatski proteini sa hidrofobnim i hidrofilnim ostacima na suprotnim stranama, koji pojačavaju antimikrobnu aktivnost H2A.[14]
H2A je kodiran mnogim genimaa u ljudskom genomu, uključujući: H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2 i H2AFZ. Genetički obrasci između različitih molekula H2A uglavnom su konzervirani među varijantama. Varijabilnost u ekspresiji gena postoji među regulatornim mehanizmima koji upravljaju ekspresijom H2A. Istraživači su proučavali eukariotske evolucijske linije histonskih proteina i otkrili raznolikost među regulatornim genima. Najveće razlike uočene su u motivima cis-regulatorne sekvence jezgra histonskog gena i pridruženih proteinskih faktora. Promjenjivost u sekvenci gena uočena je u genima bakterija, gljiva, biljaka i sisara.[10]
Jedna varijanta H2A proteina je H2ABbd (deficitarna varijanta za Barrovo tijelo). Ova varijanta je sastavljena od drugačije genske sekvence u odnosu na H2A. Varijanta funkcionira s transkripcijski aktivnim domenima.[10] Ostale varijacije povezane sa H2ABbd nalaze se unutar njegovog C-terminala. H2ABbd ima kraći C-terminalni domen u poređenju sa velikim C-terminalom koji se nalazi na H2A. Dva C-terminala su oko 48% identična. H2ABbd funkcionira s aktivnim hromosomima. Do sada nedostaje Xi hromosomima u fibroblastnim ćelijama. Konačno, otkriveno je da je povezan sa acetiliranim H4.[15]
Različite funkcije H2A.Z u poređenju sa H2A povezane su s genetičkim razlikama između H2A i varijante. Otpornost na nukleosome javlja se u H2A.Z vezivanjem za H1 faktor. H2A.Z gen je esencijalni gen u kvascu i označava se kao Htz1. Komparativno, kičmenjaci imaju dva H2A.Z gena.[10] Ovi geni, H2A.Z1 i H2A.Z2 kodiraju proteine koji se razlikuju od H2A.Z za tri ostatka. U početku su istraživači zaključili da su ovi geni suvišni; međutim, kada je stvoren mutant H2A.Z1, to je rezultiralo smrtnošću tokom testova na sisarima.[15] Dakle, H2A.Z1 je esencijalni gen. S druge strane, istraživači nisu identificirali funkciju varijante H2A.Z2. Poznato je da se transkribuje kod sisara i ova ekspresija gena je konzervirana među vrstama sisara. Ova konzervacija sugerira da je gen funkcionalan.[15] Kada se proučava H2A.Z u biljnim vrstama, protein se razlikuje među ostacima od vrste do vrste. Ove razlike doprinose razlikama u regulaciji ćelijskog ciklusa.[15] Ovaj fenomen je uočen samo kod biljaka.
Filogenetska stabla su stvorena da pokažu divergenciju varijanti od njihovih predaka. Divergencija varijante, H2A.X, od H2A dogodila se na višestrukim izvorima u filogenetskom stablu. Sticanje motiva fosforilacija bilo je u skladu s mnogim porijeklom H2A koji je proizašao iz H2A.X predaka. Konačno, prisustvo H2A.X i odsustvo H2A u gljivama navodi istraživače da vjeruju da je H2A.X bio originalni predak histonskog proteina H2A [10]
Modifikacija H2A je još u fazi istraživanja. Međutim, modifikacija H2A se dešava. Na H2A su identificirana mjesta fosforilacija serina. Treonin O-GlcNAc je također identifikovan na H2A. Postoje velike razlike između modifikovanih ostataka H2A varijanti. Naprimjer, H2ABbd nema modificiranih ostataka koji postoje u H2A.[15] Razlike u modifikaciji mijenjaju funkciju H2ABbd u odnosu na H2A. Kao što je ranije spomenuto, otkriveno je da varijanta H2AX funkcionira u popravci DNK. Ova funkcija ovisi o fosforilaciji H2AX C-terminala.[7] Jednom kada H2AX postane fosforiliran, može funkcionirati u popravci DNK. Varijanta H2A.X razlikuje se od H2A kroz modifikacije. C-terminal H2A.X sadrži dodatni motiv u odnosu na H2A. Motiv koji se dodaje je Ser-Gln-(Glu/Asp)- (hidrofobni ostatak).[15] Motiv postaje jako fosforilisan na serinskom ostatku; ako dođe do ove fosforilacije, varijanta postaje γH2A.X. Fosforilacija se javlja zbog prekida dsDNK.[15] Modifikacija histonskih proteina ponekad može rezultirati promjenom funkcije. Različite varijante H2A korištene su da imaju različite funkcije, genske sekvence i modifikacije.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.