Histon H1
From Wikipedia, the free encyclopedia
Remove ads
Histon H1 je jedna od pet glavnih porodica histonskih proteina koje su komponente hromatina u eukariotskim ćelijama. Iako visoko konzerviran, on je ipak najvarijabilniji histon u sekvenci među vrstama.
Remove ads
Struktura
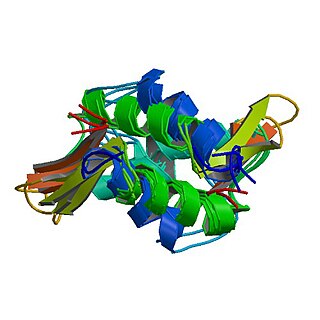
Kod Metazoa H1 proteini imaju centralni globulastii domen "krilati heliksa" i duge C- i kratke N-terminalne repove. H1 je uključen u pakovanje podstruktura "perle na niti" u strukturu visokog reda, čiji detalji još nisu riješeni.[1] H1 pronađen u protistima i bakterijama, inače poznati kao nukleoproteini HC1 i HC2 (Pfam PF07432, PF07382), nemaju centralni domen i N-terminalni rep.[2]

H1 je manje konzerviran od jezgarnih histona. Globulasti domen je najkonzerviraniji dio H1.[3]
Remove ads
Funkcija
Za razliku od ostalih histona, H1 ne čini nukleosomno "zrnce". Umjesto toga, sjedi na vrhu strukture, držeći na mjestu DNK koja je omotana oko nukleosoma. H1 je prisutan u polovičnoj količini od ostala četiri histona, koji doprinose po dvije molekule svakoj kuglici nukleosoma. Osim vezivanja za nukleosom, protein H1 se vezuje za "linker DNK" (dužine približno 20-80 nukleotida) područje između nukleosoma, pomažući u stabilizaciji cik-cak hromatinskog vlakna od 30 nm.[4] Mnogo je naučeno o histonu H1 iz studija na pročišćenim hromatinskim vlaknima. Ionska ekstrakcija linkerskih histona iz nativnog ili rekonstituiranog hromatina pospješuje njegovo odvijanje u hipotonskim uvjetima od vlakana širine 30 nm do nukleosomskih nizova kuglica na niti.[5][6][7]
Neizvjesno je da li H1 promovira solenoidno hromatinsko vlakno, u kojem je izložena linkerska DNK skraćena, ili samo promovira promjenu ugla susjednih nukleosoma, bez uticaja na dužinu linkera[8] Međutim, pokazalo se da povezujući histoni pokreću zbijanje kromatinskih vlakana koja su rekonstituirana in vitro korištenjem sintetskih sekvenci DNK jakog elementa za pozicioniranje '601' nukleosoma.[9] Eksperimenti sa varenjem nukleaza i otiskom DNK sugeriraju da se globulastii domen histona H1 lokalizira u blizini nukleosomske dijade, gdje štiti otprilike 15-30 baznih parova dodatne DNK.[10][11][12][13] Osim toga, eksperimenti na rekonstituiranom hromatinu otkrivaju karakterističan motiv drške na dijadi u prisustvu H1.[14] Uprkos prazninama u razumijevanju, pojavio se opći model u kojem globulasti domen H1 zatvara nukleosom, umrežavanjem dolazne i odlazeće DNK, dok se rep veže za linker DNK i neutralizira njegov negativni naboj.[8][12]
Mnogi eksperimenti koji se bave funkcijom H1 izvedeni su na pročišćenom, obrađenom hromatinu u uslovima niske količine soli, ali uloga H1 in vivo je manje sigurna. Ćelijske studije su pokazale da prekomjerna ekspresija H1 može uzrokovati aberantnu jedarnu morfologiju i strukturu hromatina, te da H1 može poslužiti i kao pozitivan i negativan regulator transkripcije, ovisno o genu.[15][16][17] U ekstraktima jaja žaba roda Xenopus, smanjenje histonskih linkera uzrokuje ~2-struko produženje mitotskih hromosoma, dok prekomjerna ekspresija uzrokuje hiperkompaktaciju hromosoma u neodvojivu masu.[18][19] Potpuni nokaut H1 in vivo nije postignut u višećelijskim organizmima, zbog postojanja više izoformi koje mogu biti prisutne u nekoliko klastera gena, ali različite izoforme histonskih linkera su iscrpljene u različitom stepenu u Tetrahymena, C. elegans, Arabidopsis thaliana, voćnim mušicama i miševima, što rezultira različitim defektima specifičnim za organizam u jedarnoj morfologiji, strukturi hromatina, metilacijama DNK i/ili specifičnoj ekspresiji gena.[20][21][22]
Remove ads
Dinamika
Dok je većina histona H1 u jedru vezana za hromatin, molekule H1 prelaze između regiona hromatina prilično velikom brzinom.[23][24]
Teško je razumjeti kako bi takav dinamički protein mogao biti strukturna komponenta hromatina, ali se sugerira da ravnoteža u stabilnom stanju unutar jedra još uvijek snažno favorizira povezanost između H1 i hromatina, što znači da unatoč njegovoj dinamici, velika većina od H1 u bilo kojoj vremenskoj tački je vezana hromatin.[25] H1 sabija i stabilizuje DNK pod silom i tokom sastavljanja hromatina, što sugeriše da dinamičko vezivanje H1 može pružiti zaštitu DNK u situacijama kada je potrebno ukloniti nukleosome.[26]
Čini se da su citoplazmatski faktori neophodni za dinamičku razmjenu histona H1 na hromatinu, ali oni tek trebaju biti posebno identificirani.[27] Dinamika H1 može biti u određenoj mjeri posredovana O-glikozilacijama i fosforilacijama. O-glikozilacija H1 može podstaknuti kondenzaciju i zbijanje hromatina. Pokazalo se da fosforilacija tokom interfaze smanjuje afinitet H1 za hromatin i može promovirati dekondenzaciju hromatina i aktivnu transkripciju. Međutim, pokazalo se da fosforilacija tokom mitoza povećava afinitet H1 za hromosome i stoga podstiče kondenzaciju mitotskih hromosoma.[19]
Izoforme
Porodica H1 kod životinja uključuje više H1 izoformi koje se mogu eksprimirati u različitim ili preklapajućim tkivima i razvojnim fazama unutar jednog organizma. Razlog za ove višestruke izoforme ostaje nejasan, ali i njihovo evolucijsko konzerviranje od morskog ježa do čovjeka, kao i značajne razlike u njihovim aminokiselinskim sekvencama sugeriraju da one nisu funkcionalno ekvivalentne.[3][28][29] Jedna izoforma je histon H5, koji se nalazi samo u ptičjim eritrocitima, koji su za razliku od eritrocita sisara po tome što imaju jedra. Druga izoforma je oocitno/zigotna izoforma H1M (također poznata kao B4 ili H1foo), pronađena u morskim ježevima, žabama, miševima i ljudima, koja je u embrionu zamijenjena somatskim izoformama H1A-E, i H10 koji liči na H5.[3][30][31][32] Uprkos tome što ima više negativnih naboja od somatskih izoformi, H1M se veže sa većim afinitetom za mitotske hromosome u ekstraktima jaja žaba ikz roda Xenopus.[19]
Remove ads
Posttranslacijske modifikacije
Kao i ostali histoni, porodica histona H1 je ekstenzivno posttranslacijsko modificirana (PTM). Ovo uključuje fosforilaciju serina i treonina, acetilaciju lizina, metilaciju lizina i ubikvitinaciju.[33] Ovi PTM-ovi služe različitim funkcijama, ali su manje proučeni od PTM-a drugih histona.
Također pogledajte
Reference
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads