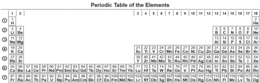
La tabla periódica ye la presentación, en forma de tabla, de los elementos químicos ordenaos polos sos númberos atómicos, configuraciones electróniques y propiedaes químiques recurrentes. Esta forma d'ordenalos amuesa tendencies periódiques: coloca a los elementos con comportamientu químicu asemeyáu na mesma columna, y conforma cuatro bloques rectangulares colos elementos con propiedaes químiques asemeyaes. Les files de la tabla nómense periodos, y les columnes grupos. De forma xeneral, dientru d'una misma fila (periodu) los elementos metálicos asítiense a la izquierda y los non metálicos a la derecha. Seis de los grupos tienen, amás del so númberu, un nome propiu d'usu y aceptación xeneralizaos; asina, los elementos del grupu 17 son los halóxenos, y los del grupu 18 los gases nobles.
| Tabla periódica | |
|---|---|
|
clasificacion química (es) | |
|
tabla (es) | |
 | |
| Más información | |
| Basáu en | propiedaes periódiques |
La tabla periódica puede usase pa derivar rellaciones ente les propiedaes de los elementos, y tamién pa predecir les propiedaes de nuevos elementos entá nun descubiertos o sintetizaos, y ye un marcu teóricu útil pa analizar el comportamientu químicu de los elementos, lo que fai que seya usada ampliamente neto en química que notres ciencies.
La primer tabla periódica reconocida ampliamente pola comunidá científica foi la espublizada pol químicu rusu Dimitri Mendeleyev en 1869. Fízola pa amosar les tendencies periódiques alcontraes nes propiedaes químiques de los elementos que se conocíen daquella, y la so ellaboración permitió-y tamién predecir algunes propiedaes de los elementos, entá por descubrir cuando la fizo, que teníen d'enllenar los güecos. La mayoría d'eses predicciones amosaron ser correutes cuando los elementos foron finalmente descubiertos. La tabla de Mendeleyev tien, de magar, espardíose, y foi afinándose col descubrimientu o síntesis de nuevos elementos y col desarrollu de nuevos modelos teóricos pa desplicar el comportamientu químicu.
Tolos elementos con númberu atómicu ente 1 (hidróxenu) y 118 (oganesón) tienen sío descubiertos o sintetizaos. Les caberes incorporaciones a esta llista (nihoniu, moscoviu, tenessiu y oganesón) foron confirmaes en 2015 pola Unión Internacional de Química Pura y Aplicada, y los sos nomes aprobaos oficialmente en 2016; con ellos tán completes les primeres siete fileres de la tabla periódica[1][2]. Los 94 primeros elementos alcuéntrase na Naturaleza, magar que dellos d'ellos alcuéntrense solo en forma de traces de forma natural y foron sintetizaos en llaboratoriu primeru de ser atopaos na naturaleza[nota 1]. Los esfuercios actuales céntrense na síntesis d'elementos con númberos atómicos más altos, y tamién na síntesis d'isótopos radioactivos d'elementos presentes na naturaleza.
| Grupu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| I | II | III | IV | V | VI | VII | VIII | |||||||||||||
| Periodu | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| * Lantánidos | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** Actínidos | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | Non metales | Halóxenos | Gases nobles |
Formes d'agrupación de los elementos de la tabla
Grupos
Nómase grupu o familia a caúna de les columnes verticales de la tabla periódica. Los grupos, xeneralmente, tienen tendencies periódiques más significatives que los periodos y los bloques, que han desplicase a continuación. Les modernes teoríes de mecánica cuántica sobro la estructura del átomu despliquen estes tendencies de grupu como'l resultáu del fechu de que los elementos dientro del mesmu grupu tienen, xeneralmente, la mesma configuración electrónica nes sos capes de valencia[3]. Consecuentemente, los elementos del mesmu grupu tienden a tener carauterístiques químiques comunes y amuesen una clara tendencia nes sos propiedaes pese a les diferencies importantes nel so númberu atómicu[4]. En dellos llugares de la tabla como los bloques d y f, por embargu, les semeyances horizontales pueden ser tanto o más importantes qu'estes semeyances verticales[5][6].

La denominación de los grupos, decidida por convención internacional aprobada pola IUPAC en 1988, numbera estos del 1 al 18 dende la columna más a la izquierda (la de los metales alcalinos) hasta la asitiada más a la derecha (los gases nobles)[7]. N'Estaos Xuníos, primero d'eso, yeren denomaos con numberales romanos, que díben siguíos d'una lletra "A" si'l grupu yera de los bloques s o p, y d'una "B" si yera del bloque d. Los numberales utilizaos coincidíen col últimu númberu de la denominación actual; asina, l'actual grupu 4 yera'l grupu IVB, y l'actual grupu 14 yera'l grupu IVA. N'Europa la denominación yera similar, sacante que la "A" usábase nos grupos que diben del 1 al 9, y la "B" nos grupos del 10 p'arriba. Amás, tanto nos Estaos Xuníos como n'Europa, los grupos 8, 9 y 10 considerábense xeneralmente como un grupu únicu col triple d'elementos, nomáu grupu VIII.
Los elementos del mesmu grupu tienden a amosar patrones similares no que cinca al so radiu atómicu, enerxía d'ionización y electronegatividá. D'arriba abaxu, dientru del mesmu grupu, aumenta el radiu atómicu de los elementos. Amás, como según baxamos nel grupu aumenta'l númberu atómicu y, poro, hai más niveles d'enerxía enllenos, los electrones de valencia tán cada vegada más alloñaos del nucleu. Eso fai que, no que cinca a la enerxía d'ionización, cada elemento socesivu, según baxamos na llista, tienla más pequeña, porque ye más fácil quitá-y un electrón. Por una razón asemeyada, dientru de cada grupu va menguando, d'arriba abaxu, la electronegatividá pola creciente distancia ente los electrones de valencia y el nucleu[8]. Sicasí, esti nun ye un patrón uniforme; por exemplu, nel grupu 11 la electronegatividá aumenta según baxamos na tabla dientro del grupu[9].
Periodos
Nómase periodu a caúna de les files horizontales de la tabla periódica. Magar que, como yá se dixera, los grupos tienen xeneralmente tendencies periódiques más significatives, hai rexones nes que les tendencies horizontales son más importantes. Asina asocede, por exemplu, nel bloque f, nel que los lantánidos y los actínidos conformen dos series horizontales importantes d'elementos[10].
Los elementos del mesmu periodu amuesen tendencies nel so radiu atómicu, enerxía d'ionización, afinidá electrónica y electronegatividá. Si mos movemos d'izquierda a derecha dientro d'un periodu el radiu atómicu, xeneralmente, mengua, porque cada elemento socesivu tien un protón y un electrón más que l'anterior, y eso fai que l'electrón sufra una mayor atraición hacia'l nucleu[11]. Esta mengua del radiu atómicu causa, a la so vegada, que la enerxía d'ionización aumente de la qu'avanzamos d'izquierda a derecha dientro d'un periodu, porque cuantes más compactu seya un elementu más enerxía fai falta pa quitá-y un electrón. La electronegatividá, pola mesma razón, aumenta tamién d'izquierda a derecha[12]. La afinidá electrónica amuesa tamién una llixera tendencia a lo llargo d'un periodu. Los metales, na fastera izquierda del periodu, tienen xeneralmente una afinidá electrónica menor que los non metales (fastera derecha), cola única esceición de los gases nobles[13].
Bloques

Nómanse bloques a rexones específiques de la tabla en razón de la secuencia d'enllenáu de les capes electróniques de los elementos que los formen. Cada grupu recibe'l so nome en función de la subcapa na que podemos alcontrar, utilizando'l sistema habitual de notación, el so «caberu» electrón. Hai, nostante, delles irregularidaes nesta convención. Asina, l'heliu inclúise nel bloque p magar que ye, realmente, un elementu del bloque s, y, por exemplu, la subcapa d del bloque d, qu'abarca hasta'l grupu 12, enllénase ya nel grupu 11.
- El bloque s abarca los dos primeros grupos (los metales alcalinos y los metales alcalinoterreos), amás de l'hidróxenu y l'heliu.
- El bloque p abarca los caberos seis grupos, los nomaos colos númberos que van del 13 al 18 na nomenclatura de la IUPAC, y contién, ente más otros, tolos metaloides.
- El bloque d abarca los grupos que van del 3 al 12, qu'inclúin tolos metales de transición.
- El bloque f, qu'aveza a representase embaxu del restu de la tabla periódica, nun inclúi grupos como tales, sinón namái a los lantánidos y a los actínidos[14].
Metales, metaloides y non metales
Los elementos pueden clasificase, acordies coles sos propiedaes químiques y físiques, en trés grandes categoríes: metales, metaloides y non metales. Los metales son, xeneralmente, sólidos brillantes y mui conductores que formen aleaciones ente ellos y compuestos iónicos asemeyaos a sales colos non metales (esceutu los gases nobles). La mayoría de los non metales son gases, incoloros o con color; los que formen compuestos con otros non metales faenlo al traviés d'enllaces covalentes. Ente los metales y los non metales tán los metaloides, que tienen propiedaes intermedies o mixtes[15].
Los metales y non metales pueden sodividise en categoríes qu'amuesen una gradación de les propiedaes metáliques y non metáliques, predominando les primeres na parte izquierda de les files y les segundes según avanzamos pa la derecha. Los metales sodivídense en metales alcalinos (perreactivos), alcalinoterreos (menos reactivos), lantánidos y actínidos, metales de transición y metales de postransición. Los non metales, pela so banda, sodivídense en poliatómicos, diatómicos y gases nobles. Los primeros, averaos a los metaloides, tienen ciertu carauter metálicu; los segundos son esencialmente non metálicos; y los gases nobles son elementos monoatómicos non metálicos y cuasimente inertes. Delles veces faese, dientro de los metales de transición, una sodivisión más: la qu'estrema los metales refractarios de los metales nobles[16].
Historia
Primeros intentos de sistematización

El primer intentu debémos-ylu a Antoine Laviosier, qu'espublizó en 1789 un llistáu con 33 elementos químicos, qu'agrupó nes categoríes de gas, metal, non metal y tierra.[17] Dempués d'elli, los químicos pasaríen el sieglu siguiente buscando un sistema de clasificación más precisu. En 1829 Johann Wolfgang Döbereiner decatose de que munchos de los elementos podíen agrupase en tríades pola semeyanza de les sos propiedaes químiques. Litiu, sodiu y potasiu, por exemplu, foron agrupaos nuna tríada, la de los metales llixeramente reactivos. Döbereiner vio tamién que, nes tríades, el pesu atómicu del elementu central de caúna yera aproximao la media del del primeru y el terceru[18]; n'honor a ellí llámase a estos grupos tríades de Döbereiner[19]. El quimicu alemán Leopold Gmelin siguió trabayando nesa llinia, y pa 1843 tenía identificaes diez tríades, tres grupos de cuatro elementos y un grupu de cinco. Poco dempués, en 1857, Jean-Baptiste Dumas espublizó un trabayu describiendo les rellaciones ente distintos grupos de metales. Sicasí, magar que dellos químicos teníen identificao, pa esta dómina, les rellaciones ente pequeños grupos d'elementos, taba entá por facer un esquema que los incluyera a toos[20]. En 1857 otru químicu alemán, August Kekulé, observó que'l carbonu aveza a tener, xuníos a él, otros cuatro átomos. El metanu, por exemplu, tien un átomu de carbonu y cuatro d'hidróxenu. A esti conceptu, al fechu de que los diferentes elementos suelen xunise con diferente númberu d'átomos d'otros, dio en llamáse-y valencia[21].
En 1862 el xeólogu francés Alexandre-Emile Béguyer de Chancourtois espublizó una tabla periódica, a la que llamó la héliz telúrica, porque'l teluriu yera'l elementu que quedaba na metá d'ella. Elli foi'l primeru que se decató de la periodicidá de los elementos. Asitiando estos n'espiral nún cilindru ordenaos de menor a mayor pol so peso atómicu, de Chancourtois demostró que los elementos con propiedaes similares apaecíen a intervalos regulares. La so tabla nun yera perfecha: incluyía, amás de los elementos, dellos iones y compuestos, usaba términos xeolóxicos más que químicos y nun incluyía un diagrama. De resultes de too ello, nun se-y prestó muncha atención hasta que Mendeleyev espublizó la so tabla[22].
En 1864 el químicu alemán Julius Lothar Meyer espublizó una tabla con 44 elementos organizaos pola so valencia. La tabla amosó que los elementos con propiedaes asemeyaes munches veces compartían la mesma valencia[23]. Al tiempu el químicu inglés William Odling espublizó otra tabla con 57 elementos ordenaos por pesu atómicu. Pese a alcontrar delles irregularidaes, decatose de que parecía haber una periodicidá de los pesos atómicos ente los distintos elementos, y qu'esto concordaba colos grupos que se-yos asignaben nes tables espublizaes hasta entonces[24]. Odling avanzó la idea de qu'esistía una llei periódica que permitía organizar los elementos, pero nun la buscó[25], proponiendo en 1870, en cuenta d'ello, una clasificación de los elementos basada nes sos valencies[26]

El químicu inglés John Newlands espublizó, ente 1863 y 1866, una serie de trabayos nos que demostró que cuando se facía una llista d'elementos ordenaos, n'orde creciente, según el so pesu atómicu, les sos propiedaes físiques y químiques repetíense a intervalos de ocho, y comparó esta periodicidá cola de les octaves musicales[27]. La so nomada Llei de les Octaves, nostante, foi ridiculizada polos sos contemporáneos, y la Chemical Society refugó espublizar el so trabayu[28]. Sicasí, foi capaz de redactar una tabla y usala pa predecir la esistencia d'elementos entá desconocíos d'aquella, como'l xermaniu[29]. El so trabayu habría d'esperar pol reconocimientu de la Chemical Society hasta cinco años dempués de que tuvieran reconocío el trabayu de Mendeleyev[30][31].
En 1867 el químicu danés asentáu n'Estaos Xuníos Gustavus Hinrichs espublizó un sistema periódicu espiral basáu nos pesos y espectros atómicos y nes asemeyances químicas. El so trabayu foi catalogáu como «idiosincráticu, ostentosu y llaberínticu», y esto pudo tener pesao nel so escasu reconocimientu y aceptación[32][33].
La tabla de Mendeléyev

El catedráticu de química rusu Dmitri Mendeléyev y el químicu alemán Julius Lothar Meyer publicaron caún, de forma independiente, les sos tables periódiques en 1869 y 1870 respeutivamente[34]. La de Mendeléyev foi la primer versión de les de so, mentantu que la de Meyer foi una versión estendida de la qu'espublizara en 1864[35]. Dambos construyeron les sos tables llistando los elementos en files o columnes en función del so pesu atómicu, y entamando una nueva fila o columna cuando les carauterístiques de los elementos entamaben a repetise[36].
El reconocimientu y la aceptación otorgaos a la tabla de Mendeléyev derívase de dos de les decisiones que tomó al facela. La primera foi dexar güecos na tabla cuando l'elementu que parecía corresponder a ellos nun se descubriera entá[37]. Elli nun foi'l primero en facelo, pero foi'l primeru al que se-y reconoz tener usao les tendencies descubiertes na so tabla periódica pa predecir les propiedaes de los elementos entá por descubrir, como'l galiu y el xermaniu. La segunda decisión foi ignorar ocasionalmente l'orde suxerido polos pesos atómicos, camudando elementos axacentes, como'l teluriu y el yodu, pa clasificalos meyor en families d'elementos. Más sero, en 1913, Henry Moseley estableció esperimentalmente los valores del númberu atómicu de cada elementu, demostrando que l'orde de Mendeléyev corresponde al orde de los elementos si los colocamos pol valor creciente del so númberu atómicu[38].
La importancia de los números atómicos pa la organización de la tabla periódica nun foi comprendida hasta que se descubrieron la esistencia de los protones y neutrones y les sos propiedaes. La tabla de Mendeléyev usó'l pesu atómicu en cuenta del númberu atómicu pa organizar los elementos. El pesu atómicu yera un datu muncho más útil que cualesquier otru daquella conocíu pa facer una organización de los elementos que permitiera predecir les propiedaes de los elementos entá desconocidos. La sustitución de los númberos atómicos, una vez entendida, permitió establecer una secuencia definitiva, basada en númberos enteros, de tolos elementos, y Moseley predició sobre esa base, en 1913, que los únicos elementos entá desconocidos ente l'aluminiu (númberu atómicu 13) y l'oru (númberu atómicu 79) yeren los de númberu atómicu 43, 61, 72 y 75, que seríen descubiertos posteriormente. La secuencia de númberos atómicos ye usada entá güei inclusive magar que se producen y estudien nuevos elementos sintéticos[39]
Segunda versión de la tabla y desarrollu posterior


En 1871 Mendeléyev espublizó la so tabla periódica nún nuevu formatu, colos grupos d'elementos similares ordenaos por columnes, en cuenta de por files. Les columnes numeroles, con numerales romanos, del I al VIII, acrodies col estáu d'oxidación de los elementos. Tamién incluyó predicciones detallaes de los elementos qu'elli descubriera que faltaben pero teníen qu'esistir[40]. Los güecos na tabla mendeleviana foron siendo enllenaos a medida que foron descubriéndose nuevos elementos presentes de forma natural na Tierra. Considérase davezu que'l caberu d'ellos foi'l franciu, nomáu por Mendeléyev eka-caesium, descubiertu en 1939[41]. Por embargu el plutoniu, producíu sintéticamente en 1940, foi alcontráu, en cantidaes perpequeñes (traces), na naturaleza en 1971[42].
La forma más popular de la tabla periódica, conocida como forma estándar, atribuise al químicu d'Estaos Xuníos Horace Groves Deming. Esti, en 1923, publicó una forma corta[43] y otra más amplia, con 18 columnes[44], de la tabla periódica[45], qu'acabó convirtiéndose na tabla estándar. Podemos alcontrar un antecedente de la tabla de Deming na ellaborada por Elliot Adams en 1911; esti omitía les tierres rares y lo que nomaba «elementos radioactivos» (esto ye, los actínidos), qu'asitiaba nún llugar aparte del cuerpu de la tabla, como se fai anguaño[46]. Merck and Company espublizó, en 1928, una versión de bolsillu de la tabla de Deming de 18 columnes que se fizo perpopular nes escueles estauxunidenses. Na década siguiente la tabla de Deming yá apaecía en llibros de testu de química ya n'enciclopedies[47][48].
Col desarrollu de les teoríes modernes de mecánica cuántica sobro la configuración electrónica dientro los átomos paeció evidente que cada periodu (fila) de la tabla correspondía col rellenáu d'una capa cuántica d'electrones. Los átomos mayores tienen más subcapes electróniques, polo que les tables posteriores tienen necesitao periodos progresivamente más llargos[49]
En 1945 el científicu d'Estaos Xuníos Glenn Seaborg suxirió que los elementos actínidos, neto que los lantánidos, enllenaben un subnivel f y nun formaben, como se creyía hasta entonces, que formaben una cuarta fila d'elementos del bloque d. Los colegas de Seaborg alvirtiéronlu que si espublizaba una idea tan radicalmente diferente al consensu científicu del momentu arruinaría la so carrera; elli consideró que nun tenía entá una carrera que pudiera desprestixase, y espublizolo. La so idea probose que yera correuta, y eso fizo que-y concedieran el premiu Nobel en 1951 como reconocimientu a les sos investigaciones na síntesis d'elementos actínidos[50][51][nota 2].
No que cinca a los elementos transuránicos, magar que pueden alcontrase traces d'ellos de forma natural, toos fueron descubiertos en llaboratoriu primeru de ser atopaos na naturaleza. Dende la síntesis del primeru d'ellos, el neptuniu, en 1939[52], el descubrimientu progresivu de los demás espandió significativamente la tabla periódica. Estos elementos, perinestables y que se descomponen mui rápidamente, son perdifíciles de detectar y de carauterizar cuando se sinteticen. El descubrimientu de caún traxo, xeneralmente, controversies sobre quién foi'l primeru en sintetizalu, faciendo necesaria la intervención de revisores independientes del trabayu de caún de los grupos que s'atribuíen el descubrimientu pa decidir quién ye'l primer sintetizador d'un elementu y tien, poro, el derechu a poné-y nome[53]. En 2010 un grupu conxuntu d'investigadores rusos y estauxunidenses reclamaron tener sintetizao seis átomos de tenesín (elementu 117). Esti, que ye'l caberu elementu descubiertu, recibió'l so nome oficialmente, xunto col nihoniu, el moscoviu y l'oganesón, el 28 de payares de 2016[54].
Ver tamién
- Dimitri Mendeleyev, l'inventor de la tabla periódica.
- Tabla periódica enantada
Notes
- Dende 1892 hubo autores que defendieron la creación d'una segunda fila extraperiódica p'asitiar nella elementos, conocíos dalgunos y otros entá por descubrir, de pesu atómicu mayor que'l bismutu (por exemplu el toriu, el protactiniu o l'uraniu. La mayoría de los investigadores, sicasí, consideraben qu'esos elementos yeren análogos a los elementos de transición de la tercer serie (hafniu, tantaliu y wolframiu). La esistencia d'una segunda serie de transición interna, na forma d'actínidos, nun foi aceptada hasta que quedó demostrada la so semeyanza coles estructures electróniques de los lantánidos (Ver: van Spronsen, J. W., The periodic system of chemical elements, páxs. 315–6. Amsterdam: Elsevier, 1969. ISBN 0-444-40776-6.)
Referencies
Enllaces esternos
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
