Loading AI tools
傳染病,中華民國法定第二類傳染病 来自维基百科,自由的百科全书
登革熱(法語:la fièvre de la dengue ; 英語:dengue fever,星馬作骨痛溢血熱症,又稱斷骨熱、天狗熱、登革熱)是一種由登革熱病毒引起的由蚊媒熱帶病[1]。患者大約會在感染後3到14天後發作[2],症狀包括發燒、頭痛、肌肉和關節痛,還有典型性的麻疹樣皮疹[1][2]。一般會於2至7天痊癒。少部分患者病情可進一步惡化,出現危及生命的登革出血熱,患者有出血、血小板減少和血漿蛋白滲出,或者進展為登革休克症候群,此時會出現致命性的低血壓休克[2]。
| 登革熱 | |
|---|---|
| 又稱 | 登革熱、骨痛熱症[1][2] |
| 登革熱患者常見的皮疹 | |
| 讀音 | |
| 症狀 | 發燒、頭痛、關節痛、紅疹[1][2] |
| 併發症 | 出血、血小板低下、血壓過低[2] |
| 起病年齡 | 暴露後3-14日[2] |
| 病程 | 2-7日[1] |
| 類型 | 病毒感染、黃病毒屬感染疾病[*]、被忽視熱帶病、疾病、蚊子傳播的疾病 |
| 病因 | 白線斑蚊及埃及斑蚊散佈的登革熱病毒 |
| 診斷方法 | 偵測對抗病毒或其RNA的抗體[2] |
| 鑑別診斷 | 瘧疾、黃熱病、病毒性肝炎、鉤端螺旋體病[3] |
| 預防 | 登革熱疫苗、防蚊[1][4] |
| 治療 | 支持療法、靜脈注射、輸血[2] |
| 盛行率 | 每年5000萬至5.28億例[5] |
| 死亡數 | ~20,000例[6] |
| 分類和外部資源 | |
| 醫學專科 | 感染科 |
| ICD-11 | 1D2Z |
| ICD-10 | A97 |
| ICD-9-CM | 061 |
| OMIM | 614371 |
| DiseasesDB | 3564 |
| MedlinePlus | 001374 |
| eMedicine | 215840 |
| Orphanet | 99828 |
登革病毒由黑斑蚊屬的幾種蚊子傳播,主要是埃及斑蚊(A. aegypti)[1]。登革熱病毒有五型[7];感染後對同型病毒可獲得終身免疫,但對異型病毒免疫力維持時間較短。且感染異型病毒會增加嚴重併發症的風險[1],目前的篩檢方式包含偵測血液中是否存有對抗病毒或其RNA的抗體[2]。
目前已有多種登革熱疫苗在某些國家上市[4]。其他預防方式包含減少斑蚊滋生地及斑蚊數目,以及避免蚊蟲叮咬。方法包含移除積水或、靜水加蓋,以及穿著包覆衣物[1]。輕度或中度的急性登革熱的治療方式包含支持治療,包含口給輸液或靜脈注射,重症則必須輸血[2]。全球約有50萬人因此病住院[1]。布洛芬等非類固醇抗發炎藥(NSAIDs)不建議使用[2]。
登革熱自第二次世界大戰之後就成為嚴重的全球公眾衛生議題,遍及全球110國[8][9][10]。每年有5000萬至5.28億人感染,約20,000人會因此死亡[11][5][6][12]。該病最早的爆發紀錄為1779年[9],至20世紀初,人們已經了解此病由病毒引起,且經由蚊子傳播[13][14]。除了滅蚊計畫之外,目前科學界也致力研發直接對抗病毒的藥物[15]。該病被歸類於被忽視熱帶病之一[16]。

一般來說,登革病毒感染者80%都無症狀,或者只有輕度症狀如簡單的發燒[11]。其它感染者中5%有嚴重臨床症狀,其中一小部分患者生命會受到威脅[11][17]。登革熱潛伏期(從接觸病毒到出現臨床症狀的時間)為3-14天,但通常為4-7天[18]。因此,從流行區域旅行歸來者如果在到家後14天內沒有發燒或其它臨床症狀,那就不太可能感染登革病毒[8]。兒童感染後常有與普通感冒或腸胃炎類似的症狀(嘔吐和腹瀉)[19]。雖最初症狀一般較輕但包括高燒,且出現嚴重併發症的風險更高[20]。

登革熱的特徵性臨床表現是突發高熱,頭痛,後眼窩痛,肌肉及關節痛和皮疹。因為它可以導致肌肉和關節痛,所以又稱為「斷骨熱」[11][22]。感染過程分為三個時期:急性發燒期,極期和恢復期[21]。
急性發燒期患者高熱,體溫可達40 °C(104 °F),伴有全身疼痛和頭痛,通常會持續2-7天[21][22]。也可有噁心、嘔吐[20]。50-80%患者中,出現症狀[22][23]的第一或第二天會出現皮疹,皮膚發紅,或者在病程靠後(4–7天)出現麻疹樣皮疹[23][24]。也有觀察到中央發白周圍發紅的皮疹[25]。此時,一些瘀點(小的紅斑,壓之不褪色,由毛細血管破裂所致[21])會出現,伴隨口腔和鼻腔黏膜的少量出血[8][22]。發燒為典型的雙峰或馬鞍熱,發燒1-2天後體溫降至正常[24][25]。
在高燒消退後,一些病人的病情進展到極期[20]。在這一時期,有血漿蛋白滲出,一般持續1-2天[21]。這可能導致液體積聚在胸腹腔,循環系統中液體量減少,重要器官的血液供應量減少[21]。也可能會發生器官功能障礙和嚴重出血,特別是消化道出血[8][21]。僅有不到5%的患者會出現休克(登革休克症候群)和出血(登革出血熱)[8],然而曾感染過其他血清型登革病毒的患者(二次感染)休克和出血的風險會增加[8][26]。極期,雖然罕見,但相對來說在兒童和青少年中更常發生[20]。

接著出現恢復期,滲出的液體被重吸收入血[21],這通常持續2-3天[8]。改善往往非常明顯,可伴有嚴重瘙癢和心跳過緩[8][21]。另一種皮疹為斑丘疹或血管炎樣,隨之有脫皮[20]。在此期,可能發生體液過多,如果影響到了大腦,可能會導致意識水平下降或癲癇[8]。成年人的乏力感可能持續數周[20]。
登革熱偶爾會影響其他身體系統[21],單獨或伴隨著典型的登革熱症狀[19]。嚴重病例中0.5-6%會發生意識不清,這是由病毒導致的腦組織發炎所致或重要器官例如肝臟的損傷間接引起[19][25][27]。
在登革熱中,其他神經系統疾病已被報道,如橫貫性脊髓炎和格林-巴利症候群[19][27]、飛蚊症[28]。罕見的併發症有心臟感染和急性肝衰竭[8][21]。
登革熱病毒(DENV)為核糖核酸病毒(RNA)病毒,屬於黃病毒科(Flaviviridae)中的黃病毒屬(Flavivirus)。同屬的其它病毒包括黃熱病毒、西尼羅河病毒、聖路易斯腦炎病毒、日本腦炎病毒、蜱傳腦炎病毒、科薩努爾森林病病毒和鄂木斯克出血熱病毒[25]。它們多通過節肢動物(蚊子或蜱)傳播,因此被稱為蟲媒病毒(節肢動物傳播的病毒)[25]。
登革病毒基因組(遺傳物質)包括大約11,000個核苷酸鹼基,編碼形成病毒顆粒的三種不同蛋白質分子(C、prM和E)和七種其它蛋白質分子(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5),這七種蛋白分子只在受感染宿主細胞內可見,是病毒複製所需[26][29]。有五個[30]病毒株,稱為血清型,其中前四種稱為DENV-1、DENV-2、DENV-3和DENV-4[31],第五種血清型在2013年被宣布[30]血清型之間的差異是基於他們的抗原性[32]。

登革病毒主要由黑斑蚊傳播,特別是埃及斑蚊[31]。這些蚊子通常生活在北緯35度到南緯35度海拔1,000公尺(3,300英尺)以下[31]。他們一般白天叮咬,特別是清晨和傍晚[33][34],但是全年任何時間他們都可以叮咬並傳播病毒[35]。其它傳播該疾病的斑蚊包括白線斑蚊(A. albopictus)、玻里尼西亞斑蚊(A. polynesiensis)和盾板斑蚊(A. scutellaris)[31]。人類是該病毒的主要宿主[31][25],但其也在非人類的靈長目動物中傳播[36],叮咬一次即可感染[37]。雌蚊從登革熱患者處吸入帶病毒血液,在最初的2-10天發燒期,蚊子自身感染病毒,病毒在其消化道細胞中[38],大約8-10天後,病毒到了蚊子的唾液腺等其它組織,隨後被釋放在唾液中。病毒對蚊子似乎沒有有害作用,蚊子可終生保持感染狀態。埃及斑蚊最易傳播病毒,因為他們更喜歡在人造水容器中產卵,生活在人類附近,以人而不是其它脊椎動物為食[18]。
登革病毒也可以通過被感染的血製品及器官捐贈來傳播[39][40]。在新加坡等國,登革熱流行,據估計每10000次輸血中有1.6到6次可能感染登革病毒[41]。懷孕或分娩過程中的垂直傳播(從母親到胎兒)已有報道[42]。其它人對人的傳播方式也有報道,但很少見。[22]登革病毒的遺傳變異有地區特異性,提示在新的區域形成流行很罕見,儘管數十年來登革熱正在新的區域出現[20]。
嬰幼兒中重型登革熱更常見,和許多其它感染相比,登革熱在相對營養良好的兒童中更常見,其它導致重型登革熱的危險因素包括女性,高的身高體重指數[20]和病毒載量[43]。雖然每個血清型都能導致所有該病的臨床表現[26],但病毒株(血清型)是一個危險因素[20]。人們認為感染某一血清型後會對該型產生終身免疫,但對其它三型的保護免疫只有較短時間[31][22]。如果曾經感染過血清型DENV-1的人又感染了DENV-2或DENV-3,或者之前感染過DENV-3的人又感染了DENV-2,發生重型感染的風險會增加[29]。對於患有糖尿病和氣喘等慢性病的人群,登革熱具有生命威脅[29]。
某些特定基因的多態性(正常變異)與登革熱嚴重併發症的風險增加有關聯,例如編碼TNFα、甘露聚糖結合凝集素[11]、CTLA4、TGFβ[26]、DC-SIGN、PLCE1這些蛋白的基因及HLA-B基因變異後產生的特殊形式的人類白細胞抗原[20][29]。特別是在非洲人中,一種常見的葡萄糖-6-磷酸脫氫酶缺乏症似乎會增加此風險[43]。而編碼維生素D受體和FcγR 的基因似乎可以防止患者在二次感染中發生嚴重併發症[29]。
當攜帶登革病毒的蚊子叮咬人,病毒會隨其唾液進入皮膚,與白血球結合並進入,隨白血球在全身循環並在其內增殖,白血球對病毒做出反應,產生大量信號蛋白,如細胞因子和干擾素,他們導致許多臨床症狀,如發燒、流感樣症狀和劇痛。在嚴重感染時,體內產生的病毒數量大大增加,更多器官(如肝和骨髓)會受累。由於血管通透性增加,血管內液從小血管滲出進入體腔。結果血管內循環血量減少,血壓變得很低不能給重要器官供應足夠血液。而且骨髓基質細胞受感染導致骨髓功能障礙,凝血必需的血小板數目減少,這使另一個主要的登革熱併發症—出血的風險增加[43]。
進入皮膚後,登革病毒結合於蘭格漢氏細胞(皮膚內識別病原體的一群樹狀細胞)[43],通過病毒蛋白與蘭格漢氏細胞膜蛋白-特別是稱為DC-SIGN的C-型凝集素、甘露糖受體和CLEC5A的結合,病毒進入細胞內[26]。DC-SIGN是樹突狀細胞上異物的非特異性受體,似乎是病毒進入的主要途徑[29]。樹突狀細胞遷移到最近的淋巴結,同時,病毒基因組在內質網上的有膜的囊泡內轉變,內質網是細胞的蛋白合成裝置,產生新的病毒蛋白用於病毒RNA複製和形成病毒顆粒。未成熟的病毒顆粒轉運到高爾基體,在那裡一些蛋白會獲得必需的糖鏈(形成醣蛋白)。之後病毒成熟,通過出芽方式到感染細胞表面,經胞吐作用釋放。這時他們有能力進入其他白血球,如單核細胞和巨噬細胞[26]。
受感染細胞的第一反應是產生干擾素,其為細胞因子,通過作用於先天免疫系統,增加JAK-STAT信號通路介導的一大群蛋白質的產生來增強對病毒感染的防禦。一些血清型的登革病毒似乎有辦法減緩這一進程。干擾素也可以激活後天免疫系統,導致抗病毒抗體產生、T細胞直接攻擊受病毒感染的細胞[26]。機體產生了各種抗體,有些和病毒蛋白緊密結合,標記病毒以供吞噬(特定細胞攝入並破壞病毒),但有些和病毒結合不夠緊密,介導病毒進入一部分吞噬細胞後病毒不會被破壞,反而會進一步增殖[26]。
二次感染時感染異型登革病毒導致登革出血熱和登革休克症候群的風險增加,但原因尚不完全明確。普遍認可的假說是抗體依賴性增強作用(ADE),但其背後的具體運作機制還不清楚。可能是由於非中和性抗體和病毒結合不夠緊密,且進入白血球內錯誤的細胞器,而這些白血球已經吞噬了並準備殺傷病毒[26][29]。人們懷疑ADE不是嚴重的登革相關併發症的唯一致病機制,[11][27]不同研究都提示T細胞和可溶性分子如細胞因子和補體系統也可能發揮作用[43]。
重型登革熱的特點是毛細血管通透性(允許正常情況下存在於血液中的液體和蛋白穿過血管壁)增加和凝血功能障礙[19][20]。這些改變和內皮細胞糖萼的異常有關,糖萼是血液成分的分子篩[20]。人們認為毛細血管滲漏(和極期)是由免疫反應所致[20]。其它人們感興趣的過程包括受感染細胞壞死影響了凝血和纖溶系統(參與凝血和溶血的兩個對立系統)和參與正常凝血過程的血小板數目減少[43]。
| 不斷加劇的腹痛 | ||||
| 持續嘔吐 | ||||
| 肝臟腫大 | ||||
| 黏膜出血 | ||||
| 血細胞壓積偏高,血小板減少 | ||||
| 嗜睡或者焦慮 | ||||
| 漿膜腔積液滲出 | ||||
登革熱確診一般基於臨床表現和體格檢查,特別是在疫區[11]。但是感染早期可能很難和其他病毒感染相鑑別[8]。當發現生活在疫區的人有發燒和以下症狀(噁心和嘔吐、皮疹、全身痛、白血球計數減少、束臂試驗陽性,或者任何警示信號(見表格))中的兩種,可能性診斷就是感染了登革病毒[44]。警示信號通常出現在嚴重登革熱之前[21]。在沒有條件做實驗室檢查時,束臂試驗非常有用,用血壓袖帶對前臂局部加壓五分鐘,壓力在舒張壓和收縮壓之間,然後計數新的點狀皮下出血;如果出血點數目大於每平方英寸10到20(1平方英寸等於6.25平方厘米),患者就可能患有登革熱[21][45]。
任何人在熱帶或亞熱帶地區兩周內出現發燒症狀都應該考慮診斷為登革熱[20]。鑑別登革熱和基孔肯雅熱可能很困難,因為基孔肯雅熱和登革熱皆為病毒感染,有許多相同症狀,流行地區也和登革熱類似[22]。通常需要通過實驗室檢查來排除其它可導致類似症狀的疾病,如:瘧疾、鉤體病、病毒性出血熱、傷寒、球菌性腦膜炎、痲疹和流感[8][46]。
實驗室檢查可見的最早改變是白血球計數減少,隨之可能有血小板減少和代謝性酸中毒[8]。肝臟轉氨酶AST(穀草轉氨酶)和ALT(谷丙轉氨酶)水平中度升高通常和血小板、白血球減少有關[20]。在重型登革熱中,血漿滲出導致了血細胞壓積和低白蛋白血症[8]。胸腔積液或腹水在量多時體檢可發現[8],但是超聲下看到積液可能有助於登革休克症候群的早期確診[11][8]。但在很多情況下,都沒有超聲設備可供使用[11]。病人血壓下降到登革休克症候群≤ 20 mm Hg和外周血管塌陷則說明出現了登革休克症候群[20]。在兒童中,毛細血管再灌注延遲,心率加快,四肢厥冷則可判斷出現了外周血管塌陷[21]。儘管警示信號是早期檢測到潛在的嚴重登革熱的一個重要方面,但沒什麼特定的臨床或實驗室檢測指標可以提供證據[47]。
世界衛生組織2009年頒布的分類法把登革熱分為兩組:普通型登革熱和嚴重登革熱[11][44]。WHO 1997年的分類法雖然因為太局限且複雜,被其取代,但還在廣泛使用[44],包括WHO東南亞地區辦事處直到2011年還在使用該舊的分類法[48]。嚴重登革熱之所以嚴重是因為它和嚴重出血、嚴重器官功能障礙或嚴重血漿滲出有關,而其他病例都屬於普通型[44]。1977年的分類法將登革熱分為:未分類發燒,登革熱和登革出血熱,登革出血熱又被進一步分為I–IV級[8][49]。Ⅰ級指患者發燒,容易有瘀傷或束臂試驗陽性,Ⅱ級指出現皮膚及其它部位自發性出血,Ⅲ級指有臨床休克表現,Ⅳ級指嚴重休克以致監測不到血壓和脈搏[49]。III 和 IV級稱為「登革休克 症候群」[44][49]。

微生物實驗室檢查可確診登革熱[44][50]。可以通過細胞培養分離病毒,PCR檢測病毒核酸,病毒抗原(如NS1)檢測或特異性抗體檢測(血清學檢測)[29][46]。病毒分離和核酸檢測比抗原檢測精確的多,但是因為費用昂貴沒有得以廣泛使用[46]。在初次感染的發燒期檢測NS1敏感性可能超過90%,但再感染時檢測的敏感性只有60-80%[20]。在該病早期可能所有檢測都是陰性[8][29]。在感染最初7天內,PCR和病毒抗原檢測要更精確[20],而2012年出現了一種PCR檢測法,可以在用於診斷流感的儀器上進行,這可能會使用PCR診斷變得更容易[51]。
除了血清學檢查外,其它這些實驗室檢查都只在該病急性期有診斷價值。在感染後期,檢測登革病毒特異的IgG 和 IgM 抗體,有助於確診。初次感染後檢測到的 IgM 滴度最高,但再次感染時也會產生IgM。初次感染後30-90天 IgM 就檢測不到了,但再次感染後時間要短些。相比之下 IgG 陽性可持續超過60年,在沒有臨床症狀時,IgG 提示既往感染。在初次感染中,血中 IgG 在14-21天後達到高峰。再感染時,IgG 達到峰值更早,滴度也通常更高。IgG 和 IgM 都可以提供對所感染的這個血清型的病毒的免疫保護[18][22][29]。在檢測 IgG 和 IgM 時,可能會和其它黃病毒發生交叉反應,導致近期感染後或接種黃熱病毒和日本腦炎病毒後出現假陽性[20]。單獨 IgG 檢測陽性不能確診,除非每隔14天收集血液樣本,檢測到特異性 IgG 滴度增加四倍以上。有症狀者,檢測到 IgM 具有診斷意義[18]。

WHO推薦了一個綜合傳病媒介控制計劃,包括以下5個元素:[33]
控制埃及斑蚊的主要方法是消滅其滋生地[33],具體措施是清除開放水源,如果不行,就噴灑滅蚊劑或生物控制劑[33]。一般噴灑的是有機磷酸酯或擬除蟲菊酯類殺蟲劑,雖然其效益備受質疑(台灣常有噴藥造成嚴重困擾但沒幾天蚊子就回復原數量的抱怨)[17]。考慮到殺蟲劑對健康的負面影響、容易殺死寵物、流浪動物甚至破壞生態(毒性較低的除蟲菊精類對貓及水生生物仍是劇毒,在法規允許破門噴藥的台灣已造成多起悲劇)、抗藥性問題及生物控制劑使用上更大的物流困難,通過改善環境減少積水是首選控制措施[33]。人們可以通過穿完全遮蓋皮膚的衣服,休息時使用蚊帳,或使用驅蟲劑(最有效的是DEET)來防止被蚊子叮咬[37]。然而,這些方法看上去還不夠有效,因為一些地區登革熱爆發的頻率似乎還在上升,這可能使因為城鎮化增加了埃及斑蚊的棲息地。可能是由於氣候變化,發病的區域範圍貌似還在擴大[30]。
較為治本的方法則是改善都市中道路及排水溝的洩水坡度,移除廢棄輪胎跟盆栽、大水缸及填平閒置庭院中的水池,減少積水情況的發生,才能徹底隔離蚊子跟人的生活場域。
登革熱病毒沒有獲得批准的疫苗[11],因此預防依賴於避免被傳播病毒的蚊子叮咬[33][52]。 即將上市的登革熱疫苗是降低登革熱發病率及嚴重性的新希望。
2016年,一隻只有部分效力的由骨痛熱症疫苗在菲律賓與印尼開始發售[4][53];而在墨西哥、巴西、薩爾瓦多、哥斯大尼加、新加坡及巴拉圭亦已批准這種疫苗的使用[53][54]。在印尼,要注射這三劑疫苗需要美金207元[53]。
但法國賽諾菲巴斯德研發的抗登革熱疫苗Dengvaxia在菲律賓使用時疑似出現14名兒童死亡。賽諾菲則表示,Dengvaxia對患過登革熱的接種人有效,但它不能對抗所有登革熱毒株[55],另外未感染者接種後可能出現更嚴重的症狀,並堅稱接種疫苗不會死亡。菲律賓衛生部最終在2018年1月停止了Dengvaxia的接種和銷售[56]。
國際抗登革熱日為每年6月15日[57]。這一想法在2010年首次達成一致,第一個抗登革日是2011年在印度尼西亞的雅加達舉行的[57]。2012年是在緬甸仰光,2013年是在越南[57]。設立這一日期的目的是提高對登革熱的公眾意識,調動資源對其進行預防和控制,還有表明亞洲地區戰勝這一疾病的決心[58]。
針對登革病毒沒有特異的抗病毒藥,但是保持體液平衡很重要[20]。治療取決於臨床表現[59]。可以喝水,排尿的病人,沒有「警示信號」,身體其它方面健康的話,可以在家中治療,每天隨訪,口服補水液治療[59]。有其他健康問題的患者,有「警示信號」或不能做到定期隨訪,應該住院接受治療[8][59]。患有重型登革熱者應該待在靠近ICU的地方[59]。
如果需要對患者進行靜脈補液,一般只持續一兩天[59]。通過滴定補液確保尿量為0.5–1 mL/kg/h,生命徵象平穩,紅血球壓積正常[8]。建議注射最小的所需量[59]。鑑於出血風險高,避免進行侵入性醫療措施如鼻胃管插管、肌內注射和動脈穿刺[8]。用撲熱息痛(乙醯胺酚)來治療退燒及不適,而NSAIDs(非類固醇抗發炎藥)例如布洛芬和阿斯匹靈要避免用因為他們可能會加重出血風險[59]。當病人生命體徵不平穩,血細胞壓積減少時,不用等血紅蛋白濃度下降到預定的「輸血指針」的水平,而是應該及早輸血[60]。推薦輸濃縮紅血球或全血,一般不輸血小板和新鮮冷凍血漿[60]。沒有足夠證據確定皮質類固醇在登革熱中的作用是正面還是負面[61]。
在恢復期,要停止靜脈補液,以免出現液體超負荷狀態[8]。如果出現了液體超負荷而重要器官狀態平穩,可能只需要停止繼續補液就可以[60]。如果病人不在極期,可以用袢利尿劑例如呋塞米頭來減少循環系統中的液體量[60]。
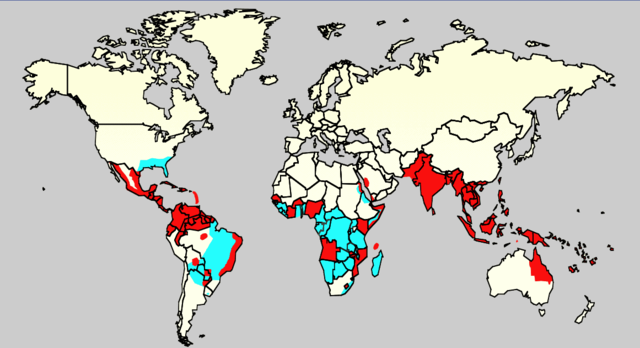
多數登革熱患者康復後沒有任何後續症狀[44]。病死率為1-5%[8],治療充分的話病死率小於1%[44];但是那些血壓嚴重降低的患者病死率可能高達26%[8]。登革熱在110多個國家中都很常見[8]。世界範圍內一年有5000萬到5億2800萬人被感染,導致50萬人住院[11][5]。大約25000人死亡[19]。在21世紀前十年,據估計南亞12個國家每年有大約300萬人感染登革病毒,6000人死亡[62]。非洲至少22個國家報道有登革熱病例,但是似乎在所有非洲國家都有登革熱出現,20%的人有感染危險[63]。這使登革熱成為世界上最常見的蟲媒傳播病之一[47]。
感染最常發生在城鎮環境中[18]。最近幾十年,由於農村、鄉鎮和城市的擴張,而這些地方登革熱常見,加上人員流動性的增強,都增加了傳染病和流行病毒的數量。因此,登革熱這個過去僅局限於南亞的傳染病,現在已經播散到了中國南方、太平洋和美洲的國家[18],也可能會對歐洲構成威脅[17]。
在1960年到2010年間,登革熱感染率增加了30倍[64]。這是城市化、人口增長、跨國旅行增加和全球暖化幾個因素的綜合作用[11]。該病地理分布圍繞赤道。在登革熱常見地區居住的25億人中,70%來自亞洲和太平洋[64]。從開發中國家旅行歸來的人如果出現發燒,最先考慮的是瘧疾,其次就是登革熱[22]。登革熱是最常見的由節肢動物傳播的病毒性疾病[26],每100萬人的疾病總量估計在1600失能調整生命年[29]。世界衛生組織(WHO)將登革熱計入17個被忽視的熱帶病之一[65]。
和大多數蟲媒病毒一樣,在自然界中,登革病毒的傳播以吸血節肢動物作為媒介,脊椎動物為宿主[18]。病毒主要在南亞和非洲森林中從雌性斑蚊-除了埃及斑蚊之外的屬-傳播給它們的後代和較低級靈長類動物[18]。在城鎮,病毒主要通過高度居家的埃及斑蚊來傳播,在農村,病毒通過埃及斑蚊和其它斑蚊屬如白線斑蚊傳播給人[18]。這兩個斑蚊屬在20世紀後半期所在地區範圍都擴大了[20]。在所有環境中,被感染的低級靈長類動物和人以一種稱為擴增的方式使流行的登革病毒數量增加[18]。
第一個可能的登革熱病例在中國晉朝時的一本醫學百科全書中有記載,該書稱之為和飛蟲有關的「水毒」[66][67][9]。一部分是由於全球化,其次是奴隸貿易,在15到19世紀,主要的傳播媒介埃及斑蚊從非洲向別的地方散布[20]。在17世紀已有登革熱流行的描述,但最可信的關於登革熱流行的早期報道是來自1779和1780年,那時該傳染病席捲了亞洲、非洲和北美[9]。從那時起直到1940年,登革熱流行就少見了[9]。
在1906年,人們確認登革熱由斑蚊傳播,在1907年,登革熱是繼黃熱病之後第二個被證明是由病毒所致的疾病[13]。約翰·伯頓·克萊蘭和約瑟夫·富蘭克林·塞勒的進一步研究使對登革病毒傳播方式的基本理解更加完整[13]。
1993年學者也證實白線斑蚊確實具有傳播一型骨痛熱病毒之能力,白線斑蚊在台灣之分佈較埃及斑蚊廣,且大部份地區密度均高於埃及斑蚊,故白線斑蚊仍為不可忽視的骨痛熱病媒蚊之一[68]。
2014年中國廣東一帶爆發,截止至2014年9月29日零時全省公確診病例 11867 例,比去年同期(663例)大幅上升1689.89%,死亡病例累計4例(其中廣州3例,佛山1例),是廣東首次出現破萬的確診病例,也是廣州近十年來首次出現死亡病例[69]。
2015年臺南市登革熱疫情較為嚴重, 已確診病例4萬人[70],死亡病例218人[70]。
二戰期間和之後登革熱的顯著播散被認為是因為生態的破壞,這同樣也導致了不同血清型的病毒播散到了新的地區,也導致了登革出血熱的出現。這一登革熱的嚴重類型第一次報道是在1953年的菲律賓;到20世紀70年代,登革熱已經變成了兒童病死的主要原因,也已經出現在太平洋和美洲[9]。在1981年的中南美洲,科學家發現,數年前感染過DENV-1的人,不但沒有對於DENV-2產生免疫力,反而誘發更致命的症狀,於是將其命名為登革出血熱和登革休克症候群[25][71]。

「登革」的名稱是從西班牙文「Dengue」音譯而來,但詞彙的起源眾說紛紜。最普遍的說法是來自斯瓦希里語的短語「Ka-dinga pepo」中的dinga,這個短語描述該病是由邪靈導致的[67]。
在台灣,書面語稱之為登革熱,臺灣話則稱天狗熱,源自於日文「デング」(亦為Dengue的音譯),「デング」與「天狗」諧音,是一種不祥的妖怪,象徵其病之難治;而中國大陸和港澳地區稱為登革熱。在新馬被稱為骨痛熱症或蚊症。在越南通稱為熱出血症。據說西印度群島上感染過登革熱的奴隸據說走路的姿勢像花花公子,所以該疾病被稱為「花花公子熱」[72][73]。
在美國一篇1789年的關於費城登革熱流行的報告中,內科醫生同時也是美國的建國之父班傑明·拉什使用了「斷骨熱」(「骨折熱」)這一術語。在報告標題中他使用了更正式的術語「膽汁質緩解發燒」[74]。登革熱這一術語在1828年後才開始通用[73]。其它歷史上的術語還包括「breakheart fever」和「la dengue」[73]。描述重型登革熱的術語包括「感染性血小板減少性紫癜」和「菲律賓出血熱」、「泰國出血熱」或「新加坡出血熱」[73]。

預防和治療登革熱的研究包括通過各種方式控制傳播媒介[75],開發疫苗和研究抗病毒藥[76]。
至於傳播媒介的控制,很多新方法已用於減少蚊子數量,取得了一些成效,包括:將孔雀魚和橈足蟲放在積水中來吃蚊子幼蟲[75]。人們也在嘗試用沃爾巴克氏體屬細菌感染蚊子種群,使蚊子對登革病毒部分排斥[20][77],也嘗試了對雄性埃及斑蚊進行基因改造,然後釋放到自然界與雌性交配,使他們的後代飛不起來[78]。
有一些進行中的項目在研製可以一次抵禦所有四種血清型的登革疫苗[52],現在需要把第五種血清型算進來[30]。人們的擔心是:疫苗可能通過抗體依賴性增強(ADE)增加重型登革熱發生的風險[79]。理想的疫苗是:接種一次或兩次後安全有效、 覆蓋所有血清型、不會導致ADE、方便運輸和儲藏、價格實惠且性價比高[79]。2012年起,人們對很多登革疫苗進行試驗[34][79],最成熟的一種疫苗是黃熱病毒和四種登革熱病毒血清型的弱毒株的混合物[34][80]。兩項關於一種登革疫苗的研究發現它有效率為60%,重型登革熱病例的80-90%可得以避免[81][82]。該疫苗的第一個產品有望在2015年上市[52]。
除了努力控制埃及斑蚊的播散及開發登革疫苗外,人們也在努力研製抗病毒藥物,這些藥物可用於治療登革熱及避免嚴重併發症的發生[83][15]。發現病毒蛋白結構可能對開發有效藥物有幫助[15]。第一種方法是抑制病毒的RDRP(RNA依賴的RNA聚合酶,由NS5編碼),該酶可以用核苷類似物複製病毒的遺傳物質,第二種是開發特異的接合病毒蛋白的病毒蛋白酶(由NS3)的蛋白酶抑制劑[84]。最後,也可以開發進入抑制劑,阻止病毒進入宿主細胞,或者開發針對病毒複製所需的5'端帽過程的抑制劑[83]。
近期研究發現 , 如抗體結合點位為表面E醣蛋白的結構域I和II , 則不但抗體中和效力差且會和登革熱其他型及其他黃病毒科如西尼羅河病毒(WNV) 、黃熱病病毒(YFV)及茲卡病毒產生抗體依賴性增強(antibody dependent enhancement,ADE)導致更嚴重的症狀(如登革出血熱DHF)。但如果抗體結合點位為表面E醣蛋白結構域III , 則為特異性抗體具強中和性且不會和其他黃病毒科產生ADE , 是未來疫苗研發須注意的重點。[85]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.