二氧化氯(英语:Chlorine dioxide)是一种无机化合物 ,化学式 ClO2 。它在 11 °C 以上是一种黄绿色气体,在 −59 °C 到 11 °C 之间是一种红棕色液体,更低温下是橙色的固体。 它是一种氧化剂,能够将氧转移到各种基质上,同时通过氧化还原反应获得一个或多个电子。 它进入水时不水解,通常作为水溶液中的溶解气体处理。 二氧化氯的潜在危害包括健康问题,爆炸性和可燃性。 [5]它常用于漂白剂。二氧化氯是氯的最稳定的氧化物,也是唯一大量生产的卤素氧化物[6]。
| 二氧化氯 | |||
|---|---|---|---|
| |||

| |||

| |||
| IUPAC名 Chlorine dioxide | |||
| 识别 | |||
| CAS号 | 10049-04-4 | ||
| PubChem | 24870 | ||
| ChemSpider | 23251 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | OSVXSBDYLRYLIG-UHFFFAOYAC | ||
| Gmelin | 1265 | ||
| EINECS | 233-162-8 | ||
| ChEBI | 29415 | ||
| RTECS | FO3000000 | ||
| MeSH | Chlorine+dioxide | ||
| 性质 | |||
| 化学式 | ClO2 | ||
| 摩尔质量 | 67.45 g·mol−1 | ||
| 外观 | 黄色气体 | ||
| 气味 | 辛辣 | ||
| 密度 | 2.757 (液体)[1]g·mL-1 | ||
| 密度 | 3.04 (气体)kg·m-3 | ||
| 熔点 | -59 °C(214 K) | ||
| 沸点 | 11 °C(284 K) | ||
| 溶解性(水) | 8 g dm-3(20 °C) | ||
| 蒸气压 | >1 atm[2] | ||
| pKa | 3.0(5) | ||
| 热力学 | |||
| ΔfHm⦵298K | 104.60 kJ mol-1 | ||
| S⦵298K | 257.22 J K-1 mol-1 | ||
| 危险性 | |||
| MSDS | ICSC 0127 | ||
| 欧盟编号 | 017-026-00-3 | ||
| H-术语 | H271, H314, H300+310+330, H372 | ||
| P-术语 | P210, P220, P280, P283, P260, P264, P271, P284, P301+310, P304+340, P306+360, P305+351+338, P371+380+375, P403+233 | ||
| NFPA 704 | |||
| PEL | TWA 0.1 ppm (0.3 mg/m3)[2] | ||
| 致死量或浓度: | |||
LD50(中位剂量)
|
94 mg/kg (大鼠口服) [3] | ||
LCLo(最低)
|
260 ppm (大鼠,2小时)[4] | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
二氧化氯是在1811年首次制备,广泛的用在造纸业以及饮用水处理中。近期也将二氧化氯应用在食品处理、住所和车辆消毒、除霉、空气消毒及去异味、游泳池水处理、牙医消毒以及伤口清洁上。
二氧化氯被广泛用于消毒及杀毒。但近来有人利用二氧化氯进行诈骗,将二氧化氯宣传为可治疗多种疾病(包括儿童自闭症[7]及COVID-19[8][9][10])的食用药物。有儿童为治疗自闭症而接受二氧化氯的灌肠,以致危及性命[7]。美国食品药品监督管理局(FDA)提出除了在牙科医师监督下用二氧化氯清洗口部之外,其余食用二氧化氯或在体内使用二氧化氯的作法对身体没有好处,不应该使用[11][12]。
制备方法
| 制备型态 | 备注 | 产物特性 |
|---|---|---|
| 酸制法:
5ClO2− + 4H+ → 4ClO2 + 2H2O + Cl− 5NaClO2 + 4HCl → 4ClO2(aq) + ClO3− |
在酸性环境中反应可产生氯酸根离子,反应速率缓慢。 |
1.需要与进料泵连结。 2.产量限制:25~30 lb/day。 3.最大有效产率约80%。 |
| 液氯-亚氯酸钠:
Cl2 + H2O →HOCl/ HCl HOCl/ HCl+ NaClO2 → ClO2 + H/OCl− + ClO3− + NaOH |
在酸性环境中反应可能产生氯酸根离子反应速率稍慢,须加过量氯和酸与NaOH中和。 |
1.流出液呈酸性(pH~2.8-3.5)。 2.产量限制:~1000 lb/day。 3.最大有效产率约80-92%。 |
| 液氯-亚氯酸钠 (循环式):
2HOCl + 2NaClO2 → 2ClO2 + Cl2 + 2NaOH |
须加过量氯和酸与NaOH中和饱和液,氯在与亚氯酸钠混合前须先经过在循环反应槽。 | |
| 液氯-亚氯酸钠溶液 (真空式):[13]
NaClO2(aq)+ Cl2(g) → ClO2(aq)+NaCl |
在中性环境中反应反应速度快速,氯气与25%亚氯酸钠溶液经喷射器注入真空式反应槽,无须泵辅助。 |
1.产量5-120000 lb/day。 2.流出液呈中性。 3.低余氯产生量(<2%)。 4.最大有效产率约95-99%。 5.须维持内压至少40 psig。 |
| 氯气-固态亚氯酸钠:[13]
NaClO2(s) + Cl2(g) → ClO2(aq) + NaCl |
反应速度快速。
氯气经氮气或过滤后,空气稀释后再参与反应,可产生~8%二氧化氯蒸汽。 |
1.最大有效产率约>99%。 2.总产量>10000 lb/day。 |
| 电化学法:
ClO2− → ClO2 + e− [14] |
电解25%亚氯酸钠溶液。 | |
| 氯酸根离子还原法:[15]
2NaClO3 + H2O2 + H2SO4 → 2ClO2 + Na2SO4 + 2H2O + O2 |
在酸性环境中反应。 |
二氧化氯是一种与稀释物质分离时会剧烈分解的化合物。因此,通常优选涉及不经过气相而制备溶液的制备方法。二氧化氯必须以安全的方式安排处理。
在实验室, ClO2 可以由亚氯酸钠和氯气化合而成:[13]
- 2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
传统上,消毒剂应用中的二氧化氯是由亚氯酸钠或亚氯酸钠-次氯酸钠方法制成的:
- 2 NaClO2 + 2 HCl + NaOCl → 2 ClO2 + 3 NaCl + H2O
或是亚氯酸钠–盐酸法:
- 5 NaClO2 + 4 HCl → 5 NaCl + 4 ClO2 + 2 H2O
或是亚氯酸盐–硫酸法:
- 4 ClO−
2 + 2 H2SO4 → 2 ClO2 + HClO3 + 2 SO2−
4 + H2O + HCl
这三种方法均可以产生具有高亚氯酸盐转化率的二氧化氯。与其他方法不同,亚氯酸盐-硫酸法可生产完全不含氯的二氧化氯,要生产等量的二氧化氯,其亚氯酸盐的含量要多25%。此外,过氧化氢可有效地用于小规模的应用。[15]
- 2 KClO3 + 2 H2C2O4 → K2C2O4 + 2 ClO2 + 2 CO2 + 2 H2O
- 2 KClO3 + H2C2O4 + 2 H2SO4 → 2 KHSO4 + 2 ClO2 + 2 CO2 + 2 H2O
今天,超过 95% 的二氧化氯是由氯酸钠还原而成, 用于木浆漂白。 它可以在强酸溶液中以合适的还原剂(例如甲醇,过氧化氢,盐酸或二氧化硫)反应高效生产。 [15]现代技术基于甲醇或过氧化氢,因为这些化学方法可实现最佳经济性,并且不会产生氯气。 它的反应可以写为:[16]
- 氯酸盐 + 酸 + 还原剂→ 二氧化氯 + 副产物
作为一个典型示例,人们认为氯酸钠与盐酸在单个反应器中的反应通过以下途径进行:
- ClO−
3 + Cl−
+ H+
→ ClO−
2 + HOCl - ClO−
3 + ClO−
2 + 2 H+
→ 2 ClO
2 + H
2O - HOCl + Cl−
+ H+
→ Cl
2 + H
2O
总反应为:
- 2 ClO−
3 + 2 Cl−
+ 4 H+
→ 2 ClO
2 + Cl
2 + 2 H
2O.
商业上更重要的生产路线使用甲醇作为还原剂,并使用硫酸进行酸度调节。 不使用基于氯化物的工艺的两个优点是它不会形成有害的氯气,而副产物硫酸钠对制浆厂而言是一种有价值的化学品。 这些基于甲醇的方法可提供很高的效率,并且非常安全。 [15]
自1999年以来,由于使用氯酸盐,过氧化氢和硫酸进行的工艺生产效率高,因此已越来越多地用于水处理和其他小规模的消毒剂应用。
高纯二氧化氯可以由亚氯酸盐的电解而成:[14]
- 2 NaClO2 + 2 H2O → 2 ClO2 + 2 NaOH + H2
气固法可产生高纯度的二氧化氯气体(空气或氮气中为7.7%),该方法使稀氯气与亚氯酸钠固体反应: [14]
- 2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
性质

二氧化氯是一种电中性的氯化合物。 它的结构和性质都和氯气有很大的差别。[15]二氧化氯有着高水溶性,尤其是在冷水中。 二氧化氯不会水解,有着氯气溶解度的10倍[15],但在光照条件下会在水中发生歧化:6ClO₂+3H₂O→HCl+5HClO₃
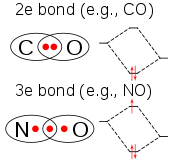
ClO2 的价电子数量是奇数,因此它是顺磁性的自由基。它的电子结构一直困扰着化学家,因为没有一种路易斯结构令人满意。 1933年,L.O.Brockway提出了一种涉及三电子键的结构。 [17]化学家莱纳斯·鲍林进一步发展了这个想法,并得出了两个共振结构,它们的一面是双键,另一面是单键加三电子键。 [18]在鲍林的观点中,后一种组合应该是比双键稍微弱的键。 在分子轨道理论中,如果将第三个电子置于反键轨道上,这种想法是常见的。 后来的工作证实了HOMO确实是一个不完全填充的反键轨道。 [19]
二氧化氯化学分子式为ClO2,分子质量为67.452。在常温下为一种黄绿色到橙色的气体,沸点为11°C,熔点为-59°C 。当二氧化氯含量达到 14~17 ppm时,一般人就会察觉到它的存在,而浓度达到 45 ppm时,对于嗅觉感官会产生刺激性伤害。二氧化氯具有强氧化的特性,若以其他氧化剂相比,其标准电位值约在1.50伏特之间。而二氧化氯在水中的四个主要氧化还原反应为电中性化合物。在饮用水消毒中,亚氯酸盐 (ClO2−) 是主要反应的产物,有70%是由二氧化氯转换,其余则为氯酸盐 (ClO3−) 及氯化物 (Cl−) 。而二氧化氯对于微生物的杀菌效用,不受高pH、氨水、含氮化合物及有机化合物的影响,不会引起溴化物 (次溴酸) 及提供有机溴化合物的组成。
存放性质
在压力超过 10 kPa[15](或STP下空气中气相浓度大于10%的体积)下,ClO2 可能会猛烈地爆炸,分解形成氯气 和氧气。 分解可以通过光,热点,化学反应或压力冲击来引发。因此,二氧化氯气体绝不会以浓缩形式处理,而是几乎总是以0.5至10克/升的浓度范围溶解在水中作为溶解气体。 它的溶解度在较低的温度下会增加,因此,当以高于3克/升的浓度存储时,通常使用冷水(5℃)。 在许多国家,例如美国,二氧化氯气体可能不会以任何浓度输送,并且几乎总是使用二氧化氯发生器在现场产生。 [15]在某些国家,浓度低于3克/升的二氧化氯溶液可以通过陆路运输,但是它们相对不稳定,并且变化的速度很快。
纯度与产制之规范标准
美国国家环境保护署(Environmental Protection Agency,缩写:EPA)对二氧化氯各种制备有明确规定纯度必须大于95%,余氯量最好小于2%,生成产量、氯残留量及纯度的计算公式,如下公式所列:
A.产量计算公式:
- Yield=[ClO2]× 100% ÷[ClO2]+[ClO2−]+ ()[ClO3−]
ClO2− ÷ ClO3−之平均分子量比值为 (),浓度单位为ppm。
B.氯的残留量计算公式:
- Excess Cl2=[Cl2]× 100% ÷[ClO2]+[ClO2−]+ ()[ClO3−]× ( × 67.45)
Cl2 ÷ ClO2−之平均分子量比值为 × 67.45,上式在纯度公式中以FAC表示。借此可以了解反应是否完全。
C.纯度计算公式:
- Purity=[ClO2]×100% ÷[ClO2]+[FAC]+[ClO2−]+[ClO3−]
二氧化氯的消毒杀菌机制
二氧化氯本身是一种高选择性的氧化剂,其杀菌作用机制会依作用物质不同而有不同的反应路径。由于其具有强氧化能力,几乎百分之百以分子态存在,除了利用其特殊的单一电子转移机制,而释放出新生态的氧原子,利用氧原子本身的强氧化作用及渗透压差,穿透细菌细胞膜以抑制其呼吸作用,并使磷酸转移酶失去活性,影响其代谢,藉以杀灭细菌。也可透过将葡萄糖氧化酶 (如硫氢氧化酶) 之双硫键氧化,破坏其键结,使蛋白质失去活性,让细菌无法生存。
一般而言,使用化学药剂的杀菌消毒机制,可分成下列四种 :
- 破坏细菌及病毒的细胞壁,使其不能分裂生长。
- 伤害其细胞壁的渗透性,而使之无法吸收养分,分泌物无法排出。
- 使其蛋白质变性、凝固,进而丧失其机能。
- 使产生能量的酵素受损,失去活性,进而影响其代谢。
各种消毒剂之优缺点
| 种类 | 优点 | 缺点 |
|---|---|---|
| 二氧化氯 |
|
|
| 氯 |
|
|
| 臭氧 |
|
|
| 氯胺 |
|
|
分析方法
一般针对氧化剂这类反应速率极快之化学物质,分析方法之选择依据常为灵敏度的高低、干扰物质的严重性及方法的简易性。因此当气态二氧化氯溶入于水中时,该二氧化氯溶液极易因操作环境等因素而使得溶液中同时存在有氯、二氧化氯、氯酸根离子及亚氯酸根离子,因此于二氧化氯之浓度与纯度分析上较氯之分析来得复杂。基于二氧化氯不稳定之物化特性,于取样分析之过程中需特别注意避免发生扰动而造成曝气情形导致二氧化氯挥发溢散,亦需同时有妥善之遮光保存以避免因光照而发生二氧化氯光解反应。由于二氧化氯以高浓度之溶液状态进行储备时,亦易因环境因素而有自解并浓度下降之趋势,因此建议应于产制过程即时量测较为准确,如无可避免需进行储备时,因妥善避光并储存于低温环境,同时于取用时均需重复量测该储备液之浓度值。以下就水中二氧化氯浓度之分析方法简述。而国际上所采用之二氧化氯分析方式属碘滴定法(五步碘量法)之一,系依据Aieta等人于1984年所提出同时测定水中氯、二氧化氯、氯酸根离子及亚氯酸根离子之方法。
“五步碘量法”原理:ClO2、Cl2、ClO2−和ClO3− 有自己最适合与I−反应的pH值,藉以硫代硫酸钠标准溶液滴定电离的I2,以区分出ClO2、Cl2、ClO2−和ClO3−,如下表所示:
| 化学反应 | pH值范围 | 添加试剂 |
|---|---|---|
| 2ClO2 + 2I− → I2 + 2ClO2− | =7.0~8.5 | 磷酸缓冲溶液 |
| Cl2 + 2I− → I2 + 2Cl− | <7.0~8.5 | 磷酸缓冲溶液 |
| 2ClO2 + 10I− + 8H+ → 5I2 + 2Cl− + 4H2O | ≦2.0 | 2.5N HCl溶液 |
| ClO2− + 4I−+4H+ → 2I2 + Cl− + 2H2O | ≦2.0 | 2.5N HCl溶液 |
| ClO3− + 6I−+6H+ → 3I2 + Cl− + 3H2O | ≦0.1~0.5 | 2.5N HCl溶液 |
从上表中可见,当pH值=7.0~8.5时,ClO2转移1摩尔的电子被还原为ClO2−,相当于ClO2被还原为1/5 (按终产物Cl−计);当pH值<7.0~8.5条件下,Cl2会被I−还原为Cl−。在pH值≦2.0时,ClO2转移5摩尔的电子,完全被I−还原为Cl− (包含原有的ClO2−和ClO2转化成ClO2−的剩下4/5都被还原)。而pH值≦0.1~0.5时,I−还原全部的ClO3−转变为Cl− (包括Cl2、ClO2和ClO2−等)。
用途
- 二氧化氯是一种人工制造出来的气体,对细菌、病毒、霉菌的细胞壁有较强的吸附和穿透能力,能抑制蛋白质合成,达到抑菌、杀菌效果,而且是一种对环境、人体和动物比较友善的绿色消毒剂,通常用在自来水消毒,也是合法的食品用洗洁剂。[20]
- 二氧化氯的主要用途在自来水的消毒,和面粉与木质纸浆的漂白。[21][22]:4-1[23]
- 作为消毒剂,由于其独特的品质,二氧化氯即使在低浓度下也有效。[15][22]
- 由于它能氧化及分解蛋白质,能很有效地对抗病毒、细菌和包括梨形鞭毛虫(学名:Giardia lamblia)与隐孢子虫(Cryptosporidium)等原生动物所引起的囊肿与卵囊。
- 从1956年比利时的布鲁塞尔把自来水消毒剂由氯气改成二氧化氯后,二氧化氯开始被广泛地使用。
- 台湾国立屏东科技大学研发团队研发出超高纯度99%与极高浓度3000ppm之二氧化氯相关产品,可对于大环境脏污细菌污染进行99%彻底杀菌。[24]。
- 2005年8月,在袭击新奥尔良的飓风卡特里娜过后,二氧化氯就被用来清除被洪水淹没后房屋上的危险霉菌。而中华民国政府也于2006年3月6日预告二氧化氯为自来水消毒剂。[1]
- 近年也有应用于空调系统及空气清新机的滤网,以为较多人使用的空间进行空气消毒杀菌。
- 香港科技大学研究团队研发出以有机微胶囊包裹二氧化氯的技术(Germagic),透过微胶囊慢慢释放二氧化氯分子,可长效杀灭及抑制细菌病毒生长[25]。
有时将二氧化氯与氯结合用于木浆的漂白,但在ECF(无氯元素)漂白过程中单独使用。它在中等酸性(pH3.5至6)下使用。二氧化氯的使用使所产生的有机氯化合物的量最小化。[26]目前,二氧化氯(ECF技术)是全球最重要的漂白方法。 所有漂白的牛皮纸中约有95%是使用二氧化氯按ECF漂白顺序生产的。[27]
尼亚加拉瀑布城水处理厂于1944年首次使用二氧化氯进行饮用水处理,以销毁产生味道和气味的酚。 [22]:4-17[23]1956年,比利时的布鲁塞尔-首都大区从氯气改为二氧化氯,将二氧化氯作为饮用水消毒剂大规模使用。 [23]它在水处理中最常见的用途是作为饮用水氯化之前的氧化剂,以破坏天然水的有机杂质,否则这些杂质会在接触游离氯气时产生三卤甲烷。 [29][30][31]三卤甲烷是致癌的消毒副产物 [32],它的产生与水中自然含有的有机物的氯化反应有关。 [31]在pH 7以上操作时,二氧化氯优于氯气, [22]:4-33 它也可以在氨和胺的存在下用于控制供水系统中的生物膜。 [31]二氧化氯在许多工业水处理应用中用作杀菌剂,包括冷却塔,工艺用水和食品加工。 [33]
二氧化氯作为氧化剂或消毒剂时有许多用途。 [15]二氧化氯可用于空气消毒, [34]并且是2001年美国炭疽攻击事件后用于美国建筑物净化的主要试剂。[35]在新奥尔良,路易斯安那和周围的墨西哥湾沿岸发生2005年飓风卡特里娜灾难之后,都会使用二氧化氯清除被淹没的房屋中危险的霉菌。 [36]
在COVID-19大流行时,美国国家环境保护局已发布了许多符合其针对病原体COVID-19的环境措施标准的消毒剂清单。 [37][38]尽管每种产品使用不同的配方,但有些是基于可被转化为二氧化氯的亚氯酸钠。 EPA清单上的许多其他产品均包含次氯酸钠(英语:Sodium hypochlorite),其名称相似,但不应与亚氯酸钠(英语:Sodium chlorite)混淆,因为它们具有非常不同的化学作用方式。
二氧化氯可以用作熏蒸剂处理,以消毒诸如发霉和发酵的蓝莓,树莓和草莓等水果。 [39]
二氧化氯可用于在屠宰家禽后通过喷雾或浸泡将其消毒。 [40]
二氧化氯可以用于内视镜的消毒,例如商品名为Tristel的产品。 [41]它也可以三者组合使用,其中包括预先用表面活性剂进行预清洗,然后用去离子水和低浓度的抗氧化剂冲洗。 [42]
该化合物已被欺诈性地用于治疗多种疾病,包括儿童自闭症[7]。一些人也声称可饮用二氧化氯溶液以预防及治疗COVID-19[44][9][10]。但需在水溶液下才能杀灭,也不能服用及接触皮肤。一些人声称能杀灭COVID-19的配戴式产品含有二氧化氯,但其效能存疑[45]。[需要可靠医学来源] 被认为是治疗儿童自闭症的方法之一:用二氧化氯对儿童进行灌肠已经发现可以危及生命。 [7] 美国食品药品监督管理局(FDA)指出,二氧化氯的摄入或其他内部使用(除了可能在牙医监督下进行的口腔冲洗以外)对健康没有好处,并且出于任何原因都不得在身体内部使用[11][12]。
二氧化氯的灌肠被认为可以治愈儿童时期的自闭症,导致FDA投诉称其威胁生命, [46]甚至是死亡。[47] 二氧化氯被标记为多种品牌名称,包括但不限于MMS,Miracle Mineral Solution和CD protocol。 [48]二氧化氯的医学特性没有科学依据,且FDA已警告不要使用二氧化氯。 [12][49]
二氧化氯被用作氧化剂,以破坏废水流中的酚,并用于控制动物副产品(提炼)工厂的空气洗涤器中的气味。 [22]:4-34 它也可以用作汽车和船上的除臭剂,并被水活化并在船上或汽车中过夜放置,从而产生二氧化氯。
安全性
二氧化氯是有毒的,因此需要限制其接触以确保其安全使用。 美国环境保护署已将饮用水中的二氧化氯的最高含量定为0.8毫克/升。[50]美国劳工部的机构职业安全与健康管理局(OSHA)已将空气中二氧化氯的8小时允许暴露极限设置为(0.3 mg/m3)[51]
2010年7月30日以及2010年10月1日,美国食品药品监督管理局都警告不要使用产品奇迹矿物补充剂,又称 MMS。该产品必须按照说明进行配制产生二氧化氯。 MMS已被推销为多种疾病的治疗方法,包括HIV,癌症,自闭症和痤疮。 FDA警告告知消费者,MMS可能对健康造成严重伤害,并表示已收到大量关于因脱水引起的恶心,腹泻,严重呕吐和危及生命的低血压的报道。[52][53]此警告于2019年8月12日第三次重复,于2020年4月8日第四次重复,指出摄入MMS与喝漂白剂相同,并敦促消费者不要出于任何原因使用它们或将这些产品送给孩子。[12]
参考资料
扩展阅读
外部链接
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.





