热门问题
时间线
聊天
视角
氯胺
消毒 来自维基百科,自由的百科全书
Remove ads
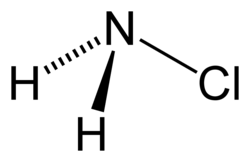
氯胺,又称氯代氨,是一种无机化合物,为氨中一个(一氯代氨)、二个(二氯代氨)或者三个(三氯化氮)氢原子被氯取代之后得到之氨衍生物。氯胺一词也指一系列化学式为 R2NCl 及 RNCl2 的有机化合物。
一氯代氨的化学式是NH2Cl,为不稳定的无色液体,熔点−66 °C(−87 °F),通常以水溶液的形式储存和使用。该溶液有时被用作消毒剂。由于其不稳定性,其沸点无法测量。[1]
Remove ads
水处理
低浓度的NH2Cl在市政供水系统中作为二级消毒剂。其应用与日俱增,并逐渐取代氯气(在水处理过程中被称为游离氯)。NH2Cl远比游离氯稳定,且不易在水中被浪费。相对比起游离氯,其与有机化合物反应形成有机氯化合物的趋势较小,但依旧存在;这些有机氯化合物包括氯仿和四氯化碳;这些物质在已被确定为致癌物质,美国国家环境保护局从1979年起开始管控饮用水中的这些有机氯化合物的浓度。[2]
与此同时,一些不受管制的副产品有可能造成更大的健康风险。[3]以氯胺净水亦可能增加饮用水中铅含量,尤其是对于老旧住宅而言。暴露于此种高铅浓度的条件下,或导致血液中铅含量增加,并可能造成重大健康风险。[4]
在游泳池中,氯胺通过游离氯与诸如尿液、汗液、皮肤细胞等物质当中的有机物反应而生成。相对比起游离氯,其杀菌效果较差;而且若不能适当地控制,其对于游泳者的眼睛亦会具有更强的刺激性。氯胺也是游泳池中独特的“氯”的味道的来源。[5][6]一些为私人游泳池设计的测试工具无法区分游离氯与氯胺,这或导致游泳池中的氯胺浓度不适当。[7]亦有证据显示,暴露于氯胺会引起游泳者的呼吸道问题,包括哮喘。[8]对于竞技游泳运动员,呼吸道问题常见而普遍。[9]
安全性
基于过往数据,美国国家环境保护局(EPA)制定的饮用水水质标准限制公众供水系统中氯胺含量不得多于 4 ppm。 为了达到EPA规定的卤化消毒副产物限量标准,许多公用事业部门正在把净化方式从氯化转向氯胺化。虽然氯胺化产生的卤化消毒副产物较少,但可产生更高浓度的未受管控的含碘副产物及N-亚硝基二甲胺;[10][11] 此二者皆已被证明具有遗传毒性[11]。
用作血液透析[12]、养殖、水耕栽培[13]及自酿啤酒时,应当设法除去水中的氯胺。 在用作透析时,若氯胺进入血液中,可能会导致溶血性贫血。[12] 若水耕栽培的培养液中混入氯胺,则会延缓植物的生长。[13]
制备
氯胺可以透过氨与次氯酸根反应制得:NH3 + ClO− → NH2Cl + OH− [14]。此反应必须在弱碱性 (pH 8.5–11)的环境下进行。进行反应的氯化剂是次氯酸,其通过氢离子和次氯酸根反应生成,而后参与氨取代产生氢氧根的亲核取代反应。此反应在 pH 约为8时反应最快;若 pH 过高,则次氯酸浓度过小;若 pH 过低,则氨形成铵根,而后者不发生上述反应。氯胺可通过真空蒸馏,并将蒸汽通过碳酸钾(干燥剂)浓缩。氯胺也可以通过乙醚萃取。
气态氯胺亦可通过氨气和氯气反应得到(过程中用氮气稀释):
- 2 NH3(g) + Cl2(g) ⇌ NH2Cl(g) + NH4Cl(s)
- 2 NH2F + CaCl2 → 2 NH2Cl + CaF2
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads