VDAC1
来自维基百科,自由的百科全书
電壓依賴性陰離子選擇性通道1(VDAC1)是一種β桶蛋白,在人類中是由5號染色體上的VDAC1基因所製造[4][5]。此蛋白質會在線粒體外膜(OMM)和細胞膜中形成離子通道:在OMM上,ATP通過該離子通道而能自線粒體擴散至細胞質;在細胞膜中,VDAC1則參與體積的調節。在所有真核細胞中,線粒體皆負責ATP的合成,並同時合成其他細胞存活所需的代謝物,VDAC1也因而參與線粒體和細胞間的通信,進而調節細胞代謝和死亡之間的平衡。除代謝物的滲透外,VDAC1還可作為己糖激酶等蛋白質的支架,參與代謝過程的調節。[6]
此條目翻譯品質不佳。 (2018年8月15日) |
該蛋白質是電壓依賴性陰離子通道,與其他VDAC同種型(VDAC2和VDAC3)具有高度結構同源性,其參與細胞代謝、線粒體凋亡和精子發生的調節。[7][8][9][10]該通道的過度表達和錯誤調節可導致細胞凋亡,導致體內多種疾病。特別是,由於VDAC1是主要的陰離子離子轉運通道,其功能障礙與癌症,柏金遜症(PD)和阿茲海默症有關。[11][12][13]
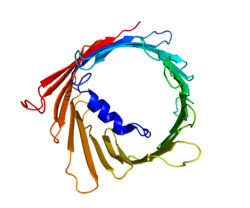
結構
三種VDAC同種型(VDAC1,VDAC2和VDAC3)具有高度保守的DNA序列以及形成寬β-桶結構的3D結構,其中α螺旋N-末端區段駐留以部分閉合通道。[14]VDAC1的結構由3個獨立的實驗室通過X射線晶體學,核磁共振(NMR)光譜學或兩者的組合來解決。這些結構研究中的兩個用於確定人VDAC1(hVDAC1)結構,而X射線晶體學用於解決鼠VDAC1(mVDAC1)結構,其僅與hVDAC1相差僅兩個殘基。[15][16][17]這些確定的結構與先前的圓二色研究一致,該研究預測了α螺旋和β鏈結構域的存在。[18]
mVDAC1的結構分析顯示由19個兩親性β-鏈組成的桶狀通道,其N-末端和C-末端均朝向線粒體的膜間隙。[19][20]β-鏈通過環轉連接並以反平行模式排列,除了平行的β-鏈1和19。[17]通道的高度為40Ẳ,在開口處跨越27Ẳ-20Ẳ的距離,並在打開狀態下在N端α-螺旋段處逐漸減小至20Ẳ×14Ẳ。[21]閉合狀態構象尚未被確定。另外,N-末端具有α螺旋區段,其通過與β-摺疊8-18鏈上的殘基的疏水相互作用而保持在通道的內壁。[17]該N-末端可以用作離子移動或蛋白質附着的支架。一個這樣的例子被看作是HK1結合的位點。[6]要指出的重要殘基是位於氨基酸鏈上第73個殘基的穀氨酸(E73)。該殘基存在於VDAC1和VDAC2中,但不存在於VDAC3中。該帶電殘基的側鏈指向磷脂雙層,這通常會引起排斥力。然而,E73與VDAC1功能和相互作用有關。[22]
功能
VDAC1屬於線粒體孔蛋白家族,並且預測與其他VDAC同種型具有相似的生物學功能。[23]在三種同種型中,VDAC1是主要的鈣離子轉運通道,並且轉錄最多。[12][24]VDAC1通過在線粒體外膜(OMM)上運輸ATP和其他小代謝物參與細胞代謝,從而允許調節TCA循環,並通過延伸,調節活性氧(ROS)的產生。[11]在酵母細胞中,ROS響應於氧化應激而累積,這導致線粒體功能受損和「小」表型。然而,小型酵母細胞表現出比野生型細胞更長的壽命,並且表明VDAC1在例如衰老類似情況下的保護功能。[6][24]
臨床意義
電壓依賴性陰離子通道在離子和代謝物轉運中都起作用,儘管它們的生理作用是不同的。由於它們的作用,通道的功能障礙可導致各種疾病。 VDAC1通過與抗凋亡蛋白家族,Bcl-2蛋白,特別是Bcl-xl和Mcl-1的相互作用而與癌症有關,這些蛋白在癌症過程中過表達。這兩種Bcl-2蛋白與VDAC1相互作用以調節穿過OMM的鈣離子轉運,並最終調節ROS的產生。雖然高水平的ROS誘導細胞死亡,但非致死水平會干擾信號轉導通路,從而促進癌細胞的細胞增殖,遷移和侵襲。[11]此外,VDAC1過表達與增加的凋亡反應和抗癌藥物和治療功效相關,進一步支持VDAC1作為癌症治療的治療靶標。[11][25]
VDAC1在鈣離子轉運中的功能也與神經退行性疾病有關。在PD中,VDAC1增加線粒體內的鈣離子水平,導致線粒體通透性增加,線粒體膜電位破壞,ROS產生增加,細胞死亡和神經元變性。[12]已顯示VDAC1與澱粉樣蛋白β(Aβ)相互作用,導致通道的電導增加並最終導致細胞凋亡。[13]
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.