威廉·奧士華
物理化学家(1853-1932) 来自维基百科,自由的百科全书
腓特烈·威廉·奧士華(德語:Friedrich Wilhelm Ostwald,拉脫維亞語:Vilhelms Ostvalds;1853年9月2日—1932年4月4日),出生於拉脫維亞的德國籍物理化學家。他提出了稀釋定律,對電離理論和質量作用定律進行了驗證。他將熱力學原理引入結晶學和催化現象的研究中,解釋了自然和生產中的許多現象,並成功地完成了催化劑的工業應用,提出了奧士華過程[1]。
此條目需要補充更多來源。 (2015年3月1日) |
他也是出色的教材作者和卓越的學術組織者,創立過多種期刊,培養了大量的年青研究者,使得物理化學得以成為一門獨立的科學和其他化學的理論基礎,因此被認為是物理化學的創立者之一[2]。另外他在顏色學、科學史和哲學方面也有獨到的貢獻[3]。1909年因其在催化劑的作用、化學平衡、化學反應速率方面的研究的突出貢獻,被授予諾貝爾化學獎 [4]。
早年研究
1853年,奧士華出生於利沃尼亞地區的里加(當時屬俄羅斯帝國管轄,現為拉脫維亞首都),父親是一個箍桶匠,母親是麵包師的女兒,兩人都是波羅的海德意志人[5]。奧士華是他們的次子。奧士華少年時被送入自然科學教育和實用技術並重的一所文實中學(Realgymnasium)進行學習,這使得他比較早的接觸到了自然科學知識。1872年1月他進入利沃尼亞地區歷史最悠久的多帕特大學(現屬愛沙尼亞)就讀,在化學家卡爾·施密特和施密特的助手Johann Lemberg的影響下對化學產生了濃厚的興趣,學會了有機與分析化學中常用的各種定量分析方法和關於化學親和力、化學平衡和反應速率方面的基本原理[4]。
大學畢業後,奧士華留在多帕特大學,在物理學家阿瑟·范·奧丁根的指導下,進行了各種物理分析手段的訓練,這奠定了他之後一直堅持的研究方向與方法:結合物理手段與化學分析來進行科學研究。他開始對丹麥物理學家尤利烏斯·湯遜(Julius Thomsen)提出的通過測量反應放出的熱量來比較化學親和力的假設產生興趣[5],希望類似的通過測量化學過程中的體積變化和折射率的變化來比較物質的化學親和力,為此他作了大量的實驗,在1878年底以《體積化學與光化學研究》的論文取得博士學位。奧士華在這一階段所做的獨創性研究,使得他的研究工作開始被科學界所重視。[3]1880年奧士華和海蓮內·馮·賴黑爾(Helene von Reyher)結婚,生有五個孩子,其中的胡爾夫岡·奧士華後來成為膠體化學研究的核心人物。
里加時期的研究

1881年奧士華回到里加,擔任里加綜合技術學院(現里加技術大學)的化學教授。他開始建立實驗室和開展他感興趣的化學動力學的研究工作,希望可以通過比較化學反應的速率來比較各種物質的化學親和力,為此他在1883年1月對歐洲大陸的先進實驗室進行和考察,並和當時一流的化學家亥姆霍茲和拜耳等人進行了交流。1884年他讀到了烏普薩拉大學博士生斯凡特·奧古斯特·阿倫尼烏斯的畢業論文。阿倫尼烏斯在論文中提出了電離假設,不被教授們接受,只得到了很低的分數。奧士華則很感興趣,當年夏天,已經在化學界小有名氣的奧士華前往瑞典和阿倫尼烏斯見面,這被認為是對初生的電離理論的支持[6]。1885年起奧士華設計和進行了大量實驗,提出通過測量電導來估計弱酸弱鹼在稀溶液中的電離度的方法。
奧士華在里加的另一個重要工作是編寫與翻譯化學著作。他從1880年開始寫作《普通化學概論》這一教科書,並不斷希望用新的物理化學進展來詮釋其中的概念。同時他努力宣傳阿倫尼烏斯和荷蘭物理化學家雅各斯·亨里克斯·范托夫關於化學動力學的工作,這些著作出版後大受歡迎,但也受到不少學者的反對[3]。因為當時歐洲大陸很多學者囿於有機化學和分析化學的經驗,認為只有發現元素和合成新物質是化學家的工作,而稱奧士華等人為「離子家」[1]。面對這種責難,奧士華創辦了世界第一種物理化學期刊《國際物理化學與化學物理研究》(德語:Zeitschrift für Physikalische Chemie),努力將物理化學從有機和分析化學中獨立出來,他自己一直主編這本刊物到1922年[4]。
萊比錫時期
1887年奧士華接受聘請,擔任德國萊比錫大學的化學教授,他一直任此職到1906年。在這將近二十年的時間中,奧士華的傑出的研究能力和學術組織才能充分體現了出來。他組建了先進的物理化學實驗室,吸引了整個歐洲各地乃至美國的年輕研究者前來。在他的領導下,萊比錫大學成為當時歐洲物理化學研究的一個中心,正如他的學生弗里德里克·唐南所說的「當你遇到困難時,他總會解決的辦法;當你沒有困難時,他總能給你新的思路」[7]。這一階段他的研究方向主要有化學熱力學、動力學、溶液的依數性和催化現象等

奧士華曾邀請阿倫尼烏斯和范托夫前來萊比錫大學訪問和工作;邀請電學理論和實驗基礎都很紮實的瓦爾特·能斯特作為助手以繼續對於電離理論和質量作用定律的實驗論證[8]。1888年奧士華從質量作用定律和電離理論出發推導出描述電導、電離度和離子濃度關係的奧士華稀釋定律,並且通過大量實驗數據驗證了這一關係[2]:
Kp:在溶液極稀時近似為常數。電離度:c(A−) 陰離子濃度:c(K+) 陽離子濃度:c0:弱酸或弱鹼的整體濃度 c(KA):電離後電解質的濃度。
這一定律使質量作用定律和電離理論成功地應用在處理部分電離弱酸弱鹼體系,為這兩個當時尚是假設的觀點提供了支持。同時奧士華敏銳的感覺到化學反應的級數問題,和范托夫共同提出了通過濃度隨時間的變化來估算化學反應級數的方法,自己又提出了孤立法以解決複雜反應的級數問題。1891年奧士華又使用電離理論成功解釋了酸鹼指示劑的原理。
在對溶液的物理化學研究方面,奧士華遇到了難以控制穩定溫度的問題,於是他邀請恩斯特·奧托·貝克曼作為助手設計精確的溫度測量設備(即後來所稱的貝克曼溫度計)和恆溫槽,以便精確的研究稀溶液的依數性,如溶液加入電解質或者其他組分之後產生的蒸氣壓下降、沸點上升、凝固點下降等現象。他們用這套設備驗證了拉烏爾定律,並對范托夫當時提出的滲透壓等概念進行了測量[5]。1900年左右奧士華在對溶液粘度性質的測量時,發明了奧士華黏度計,至今仍然被廣泛使用[5],另一說是由他的兒子胡爾夫岡·奧士華所發明。
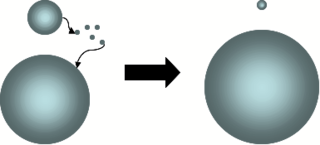
另外他還使用精確的溫度測量設備進行了大量的結晶學研究,將物理化學中的自由能概念引入對結晶過程的分析,提出了兩個至今常用的概念,一是奧士華規則,即液體在結晶過程中,並不會直接生成最穩定的晶相,而是先生成最不穩定的晶相,然後隨着溫度的繼續降低或者時間的推移,逐步向更穩定的晶相轉變,所以在晶體中會存在多中晶相共存的情況[9]。另一個是奧斯瓦爾德熟化(Ostwald Ripening)。如同右圖中描述的,溶液中產生的較小的晶體微粒因曲率較大,能量較高,所以會逐逐漸溶解到周圍的介質中,然後會在較大的晶體微粒的表面重新析出,這使得較大的晶體微粒進一步增大。[10] 這一過程近來已經被廣泛應用在納米粒子的製備中。

除了電離理論、溶液的依數性和結晶學以外,奧士華還是催化現象研究的開創者。「催化」這一概念是由瑞典化學家貝采利烏斯最先提出的,提出後就遭到尤利烏斯·李比希的反對,隨後的幾十年中,對於催化劑和催化現象的本質的爭論一直沒有終止。1888年奧士華提出他所認為的催化劑本質,即「可以加快反應的速度但不是反應發生的誘因」,這一定義被當時的化學界普遍接受。1890年他發表文章,提出了自然界廣泛存在的「自催化」現象。之後他和助手佐治·布瑞迪希(Georg Bredig)合作,對異相催化過程進行了研究。在1895年他發表了《催化過程的本質》,提出了催化劑的另一個特點:在可逆反應中,催化劑僅能加速反應平衡的到達,而不能改變平衡常數[5]。
他把催化的理論知識迅速應用於工業化學項目:在1902年提出了著名的奧士華過程,即氨氣通過催化劑(例如鉑)作用被氧化生成一氧化氮,一氧化氮在空氣中氧化為二氧化氮,二氧化氮和水反應生成硝酸和一氧化氮,生成的一氧化氮可以重新利用[11]。這一過程實際上在1838年就已經被人申請了專利,但是當時還無法獲得大量的氨氣作為原料,所以只有學術上的意義。奧士華遇到了類似的困難,直到1908年左右他獲知了德國化學家弗里茨·哈勃等人的合成氨工藝,才將這一製取硝酸的方法工業化,這一方法使得肥料和炸藥的產量大量的增加,正如奧士華自己所說的「工業的關鍵在於催化劑的使用」[12],但這一方法也被德國用於生產第一次世界大戰中所需的炸藥。後來這一過程後來經過奧士華的學生馬克斯·博登斯坦(Max Bodenstein)等人的改進,一直應用到現在。

1887年奧士華初任萊比錫大學教授時候的演講的題目是「能量與其轉變」,當時他的結論是物理化學對能量的研究可以補充其他化學對物質的研究,能量和物質都是實體,但1891年左右他開始形成了他的「能量學」(energetics)概念,認為能量是唯一真實的實在,物質並不是能量的負載者,而只是能量的表現形式。他隨即將這一理論推廣到了化學領域,主張物質和原子、分子的概念都是多餘的,各種現象能夠用能量及其轉化來滿意地加以解釋,這引起了其他科學家的極大反對[3]。1895年他在德國呂貝克自然科學家會議上發表了「克服科學的唯物論」的講演,這是他公開反對原子論的宣言,當即遭到主張原子論的路德維希·波茲曼的激烈反對。自此奧士華和恩斯特·馬赫成為對原子假設持懷疑態度的代表,和波茲曼、馬克斯·普朗克等人產生了長期的論戰。
不過奧士華一直仍跟波茲曼保持朋友的關係,並且在1900年成功說服萊比錫大學聘請當時因和馬赫的論戰而處於困境的波茲曼為教授[13]。1906年他在和阿諾·索末菲的談話中表示,他通過讓·佩蘭關於布朗運動的實驗才轉變過來[14]。並在1909年《普通化學概論》第四版的序言中公開承認了一方面由於約瑟夫·湯姆生在氣體離子方面的工作,另一方面也由於讓·佩蘭的關於布朗運動的實驗對與愛因斯坦的數學模型的符合,使得他自己接受了原子論假設的合理性。有趣的是,反對原子假設的奧士華卻是較早的採用摩爾這個名詞來衡量物質的量的科學家,他在1900年左右定義當物質的質量等於其分子量時該物質為1摩爾,而後又定義當氣體在標況下的體積為22.4L時,該氣體為1摩爾[15]。
萊比錫時期的奧士華修訂了《普通化學概論》,並在1892年翻譯出版了美國物理化學家約西亞·傑斯的經典之作《論非均相物體的平衡》,而當時傑斯的著作由於充滿了數學推導,在美國還沒有人關注[16]。奧士華的這一譯本和勒沙特列在1897年出版的法文譯本使得傑斯關於相平衡的想法被歐洲大陸所接受。他開始組織批註和出版《奧士華精密科學的經典作家》叢書,收集了從亥姆霍茲的《論力的守恆》開始的經典科學文獻,便於人們進行科學與科學史研究。他還組織了德國電化學學會和撰寫了巨著《電化學:歷史與理論》。
晚年

1904年起逐步把興趣轉向能量學和哲學研究的奧士華和希望他專心於教學和行政任務的萊比錫大學產生了不和。此時正值美國和德國設立了交換教授的計劃,奧士華即成為第一位交換教授,前往美國。他在哈佛大學、麻省理工學院、哥倫比亞大學講授哲學,使用物理化學的觀點來講解化學,受到歡迎[4]。1906年奧士華從美國回到德國後即從萊比錫大學退休,開始投身到自己感興趣的研究和社會活動中。
1910年之後,奧士華還進行了顔色學的研究,他受到阿爾伯特·亨利·曼塞爾的影響,制定了衡量顏色的筆筒的測量標準,提出了奧士華色彩系統 [17]。在這個系統他認為所有顏色都可以通過「黑」(B),「白」(W)和「純色」(F)三種成分按照一定的面積比例旋轉混色得到,而且 W+B+F=100(%)。所以描述一個特定顏色,只要給出三種變量的具體數值就可以了,這使得顏色的調配不必完全依靠視覺,而有了類似科學的定量化方法。接着他用類似於三相相圖的辦法將純色,黑,白放在正三角形頂點,形成了「等色相三角形」。這樣使得整個系統秩序嚴密,配色時極為方便。奧士華色彩系統影響了保羅·克利和先鋒派的一些成員,包括彼埃·蒙德里安 [17]

奧士華晚年參加了一些國際和平運動,並加入了創建國際語言的運動,開始學習世界語,後來支持伊多語的發展[18]。1909年奧士華因「在催化作用與化學平衡和反應方面的工作,以及由氨制硝酸的方法」獲得了諾貝爾化學獎,隨即把部分獎金捐贈用於發展伊多語[19],比如資助他於1908年創辦的伊多語雜誌《Progreso》[20]
奧士華接受了恩斯特·海克爾所發展的一元論,成為一元論運動的代表人物,並於1910-1912年擔任「一元論同盟」的主席。他通過一元論同盟推廣社會達爾文主義和優生學,奧士華一元論影響了卡爾·榮格對心理類型的分類.[21]。奧士華甚至還希望建立國際科學家學會,以增加各國學者的交流,但這個願望因一戰爆發而未能實現。一戰中他的製取硝酸的專利被用於製造炸藥,而他參與的很多學會都停止了活動。
1927年,奧士華他完成了具有重要史料價值的《生命線·自傳》一書,總結了自己幾十年的研究經歷和學術活動[3]。1932年奧士華因尿毒症在萊比錫去世,葬於當地,在出生地里加有他的紀念碑。
重要著作列表

- 《自然哲學概論》 1902,有中譯本。李醒民譯,北京:華夏出版社,2000年1月第1版。
- 《電化學:歷史與理論》1910
- 《普通化學概論》 第五版 1917年
- 《生命線·自傳》(1927)
- 《生命線·自傳111》(1927)
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


