热门问题
时间线
聊天
视角
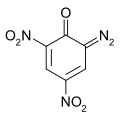
重氮基二硝基酚
化合物 来自维基百科,自由的百科全书
Remove ads
二硝基重氮酚(代號:DDNP[註 1])是一種做功能力較強的起爆藥,其威力與TNT相近,曾於20世紀40年代逐漸取代雷汞成為當時世界生產量最大的起爆藥之一,廣泛用於裝填工業雷管和火箭彈引信。二硝基重氮酚爆炸性能優越,各項感度適中,但其同時存在極限起爆藥量大、耐壓性和流散性差、生產過程廢水處理困難等問題,限制了其應用範圍[4]。
Remove ads
歷史
二硝基重氮酚最早於1858年由彼得·格里斯通過亞硝酸鈉的乙醇溶液與苦氨酸反應製得[6][7],最初被用作染料[4],其爆炸性直至1892年才被發現[8]。1916年,該藥劑開始作為起爆藥裝藥應用於工業雷管,後被美國、日本等國用於軍事裝備。20世紀40年代後,它逐漸取代雷汞成為世界生產量最大的起爆藥之一[4]。
物理性質
純淨的二硝基重氮酚為亮黃色針狀結晶,但會因製造工藝差異而存在土黃、棕黃、深棕、黃綠、紫紅等多種顏色。該藥熔點約為150°C,假密度[註 2]0.27至0.75g/cm3,晶體密度1.63g/cm3,使用丙酮進行重結晶操作可以將該數值提升至1.71g/cm3。二硝基重氮酚的工業製成品一般呈現為棕紫色的球形聚晶,其吸濕性低於純淨晶體且吸濕後爆炸性能變化較小,用於工業雷管時,該藥假密度一般選用0.5至0.7g/cm3[4]。
25°C下,二硝基重氮酚在水中溶解度為每百毫升0.08克,且其在該溫度的水中儲存24個月不會發生變化[8]。此外,該藥還微溶於四氯化碳和乙醚,可溶於乙醇、甲醇、丙酮、乙酸乙酯、乙酸、硝化甘油和濃鹽酸。二硝基重氮酚熱安定性能較差,100°C環境下放置48小時失重約2.1%,放置96小時失重約4.3%,加熱至100小時不爆炸[4]。
化學性質
二硝基重氮酚具有弱酸性,在常溫的無機酸中可以穩定存在,但在熱的濃硫酸中會發生分解,相應的,二硝基重氮酚在鹼性環境中會迅速發生多重反應致使重氮基被破壞,進而放出氮氣。乾燥條件下,二硝基重氮酚與銅、鋁、鐵、鋅、鉛、鉍、鎂等常見金屬材料均不會發生反應,但在潮濕環境下會出現一定變化[4]。
二硝基重氮酚在光照下會發生顯著變化,當被陽光直射時其變化尤其明顯。陽光直射10分鐘後,純的二硝基重氮酚的純度會降至67.3%,與此同時其顏色會變黑,起爆能力也有所下降,直射360小時後,其起爆能力將下降約20%,因此該物質使用過程中需減少暴露在光照中的時間[9]。
製備工藝
二硝基重氮酚被發現後的數十年間,染料廠商一般採用鹽酸和亞硝酸鈉為原料與苦氨酸發生重氮化反應進而獲取該產品,對製作方法的改進也大多集中於這兩種原料配比的調整[10]。二硝基重氮酚的現代製法原理與早期製法相同,但對數個生產環節進行了調整,可簡單分為中和反應、還原反應、重氮化反應、後續處理共4個工序,研究方向則主要為晶型控制與廢水處理[4]。
現代製法的中和反應階段以苦味酸為原料與碳酸鈉反應製得可溶的苦味酸鈉,反應結束後得到PH值8至9的澄清橙紅色液體。隨後進入還原反應工序:將溶液抽濾後控制溫度60°C以下加入低濃度硫化鈉溶液反應即可生成苦氨酸鈉。此後即為關鍵的重氮化反應步驟:將含有一定水分的苦氨酸鈉置於反應器中加水攪拌至渾濁狀態,先滴加低濃度的亞硝酸鈉溶液一定時間,再以同一速率開始滴加低濃度鹽酸,以一定速率攪拌一段時間後即可得到二硝基重氮酚[4]。
二硝基重氮酚生產過程受多重因素影響,其數道工序也可與上述生產路徑有所差異。為減少用水及方便控制溫度,部分企業研究部門選擇將中和反應工序與還原反應工序合併,採用硫化鈉直接還原苦味酸[11]。二硝基重氮酚重氮化反應階段環境的PH值對最終產品質量影響巨大,在結晶成長階段PH值在5.0至5.5的區間變化即會導致產品假密度出現0.49g/cm3至0.88g/cm3的巨大差異,需要根據產品需求精確調節反應過程PH值[12]。此外,硫化鈉濃度、各階段反應溫度、晶型控制劑加入量等參數也會對最終產品得率和總廢水量產生影響[13]。
二硝基重氮酚可以在溶解於硝基苯或熱丙酮後加入冷乙醚重結晶提純,也可以在熱丙酮中快速加入大量冰水提純以獲取純度較高的亮黃色產品。此外,二硝基重氮酚在苯胺中重結晶也可獲得純度良好的產品[9]。
Remove ads
生產過程中各化學物質的加入速率與混入晶型控制劑的種類均會對二硝基重氮酚最終產品的晶型造成影響。通過滴加或霧化方式加入鹽酸可以避免重氮化過程中酸液過度集中從而生成細小的二硝基重氮酚微顆粒。此外,在反應過程中加入連苯三酚、對苯二酚、二硝基間苯二酚、4-甲基苯酚等物質可以生成球狀結晶,加入三苯甲烷則可生成片狀晶體[8][14]。
生產1千克二硝基重氮酚會排放約200千克染色性很強的有毒廢水,由於生產過程中產生的多種芳香性物質密度大於水且部分可以溶於水,會對水體造成嚴重且持續的污染,因此需要在排放前對這些廢水進行處理,主要處理方法包括氧化法、微電解法和吸附法等[15]。
氧化法包含多種分支方法,已有多個團隊提出了數個有效的廢水處理方案。以摻硼金剛石薄膜為電極的電催化氧化法在合適條件下,210分鐘後其化學需氧量最多可下降57%[16]。採用銅鐵雙金屬顆粒-過氧化氫、芬頓試劑、銅鐵雙金屬顆粒-過氧化氫三級聯合氧化處理廢水,在適當條件下化學需氧量最高下降87.1%,除色率可達99.9%[17];將銅鐵雙金屬顆粒換為鐵單金屬顆粒後效果有所下滑,化學需氧量最高下降78%,除色率則為98%[18];將銅鐵雙金屬顆粒對應的氧化物由過氧化氫更換為臭氧,其效果也會下滑,化學需氧量最高下降85.3%,除色率為95%[19]。以單一芬頓試劑在最佳條件下震盪處理1.5小時,其化學需氧量下降94.78%,除色率94.38%[20]。此外,在24MPa、600°C、過氧量0.8MPa的嚴苛條件下以超臨界水氧化二硝基重氮酚廢水3分鐘即可取得化學需氧量下降99%並完全除色的優秀處理成果,但該法實驗條件在實際生產中難以實現[21]。
微電解法利用陽極、陰極及電解池構成微電池,使得有機污染物在微電場作用下被還原。最適條件下,以鐵和碳為電極,廢水PH值9至10的電解池可在48小時後降低化學需氧量80%以上並完全除色[22];以鐵屑和煤渣為微電極,廢水PH值為3的電解池則可在2小時後降低化學需氧量52.3%,除色率64.5%[23]。
吸附法為二硝基重氮酚廢水處理的早期方法,主要以活性炭、磺化煤等為載體通過多重吸附作用去除污染物。二十一世紀前,活性炭產量有限且價格昂貴,因而一些學者也提出過以褐煤、焦渣、粉煤灰等作為吸附劑的處理方法[24]。隨着科技的發展,此後又出現了以改性沸石、大孔吸附樹脂等為吸附材料的改良方法[25][26]。
除上述方法外,部分研究團隊還開發出了微波活化過硫酸鉀耦合混凝處理[27]、擔子菌門微生物降解[28]等方法,均獲得了一定的成果。此外,還有多個團隊將多種方法結合使用,提供了廢水處理新的解決方案[29][30]。
Remove ads
爆炸性能
二硝基重氮酚爆炸時可能發生多種反應:[9]
其氧平衡為-60.9%,屬負氧平衡炸藥[3][註 3]。二硝基重氮酚爆熱1.4MJ/kg,爆容865至876L/kg,爆溫3700°C。其爆速與密度正相關,密度0.9g/cm3時爆速4400m/s,密度1.3g/cm3時爆速5400m/s,密度1.5g/cm3時爆速6600m/s,密度1.6g/cm3時爆速6900m/s[2][4]。二硝基重氮酚的撞擊感度和摩擦感度受含水量影響較大,在部分實驗條件下,其兩種感度數據均優於雷汞和糊精改性疊氮化鉛[9],但在部分文獻定量分析中,其撞擊感度高於改性疊氮化鉛[2][31]。
Remove ads
註釋
參考文獻
參考書籍
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads