晶場理論(英語:Crystal Field Theory CFT)是一種配位化學理論。
它以過渡金屬配合物的電子層結構為出發點,可以很好地解釋配合物的磁性、顏色、立體構型、熱力學性質和配合物畸變等主要問題,但不能合理解釋配體的光譜化學序列和一些金屬有機配合物的形成。
1928年,研究晶體光學的德裔美國物理學家漢斯·貝特[1]提出了晶場理論,他從靜電場出發,揭示了過渡金屬元素配合物晶體的一些性質。1932年美國物理學家范·弗萊克[2]發展了這一理論。
晶場理論認為中心陽離子對陰離子或偶極分子負端的靜電吸引類似於離子晶體中的正、負離子之間的相互作用[3],着眼於中心原子的d軌態在各種對稱性配位體靜電場中的變化,簡明直觀,方便結合實驗數據進行定量或半定量的計算。
概述
晶場理論認為,配合物中心原子處在配體所形成的靜電場中,兩者之間完全靠靜電作用結合,類似於正負離子之間的作用。在晶場影響下,五個簡併的d軌態發生能階分裂,d電子重新分佈使配合物趨於穩定。
d原子軌態分為、、、和五種,其空間取向各不相同,但能階卻是相同的,參見原子軌態。在一定對稱性的配位體靜電場(負)作用下,由於與配位體的距離不同,d軌態中的電子將不同程度地排斥配位體的負電荷,d軌態開始失去簡併性而發生能階分裂。能階分裂與以下因素有關:
- 金屬離子的性質;
- 金屬的氧化態,高氧化態的分裂能較大;
- 配合物立體構型,即配體在金屬離子周圍的分佈;
- 配位體的性質。
最常見的配合物構型為八面體,其中中心原子位於八面體中心,而六個配位體則沿着三個坐標軸的正、負方向接近中心原子。
先將球形場的能階記為。和軌態的電子雲極大值方向正好與配位體負電荷迎頭相碰,排斥較大,因此能階升高較多,高於。而、和軌態的電子雲則正好處在配位體之間,排斥較小,因此能階升高較小,低於。
因而d軌態分裂為兩組能階:
- 和軌態,能量高於,記為或軌態;
- 、和軌態,能量低於,記為或軌態。
和是來自於群論的對稱性符號。兩組軌態之間的能階差記為Δ0或10,稱為分裂能。
量子力學指出,雖然晶場對稱性可能有變化,但受到微擾的d軌態的平均能量是不變的,等於能階。選取能階為計算零點,則有:
- - = 10
- 2 + 3 = 0
解得:
- = 6
- = -4
也就是說,正八面體場中d軌態能階分裂的結果是,與能階相比,軌態能量升高6(0.6Δ0),而軌態能量則降低了4(0.4Δ0)。
類似地可求出正四面體場中的能階分裂結果:
- 由、和軌態組成,高於1.78;
- 由和軌態組成,低於2.67。
平面正方形場(假設為xy平面):
- 軌態——12.28
- 軌態——2.28
- 軌態——-4.28
- 和軌態——-5.14
其他構型的分裂情況請參考#能階分裂圖。
分裂能Δ的大小既與配體有關,也與中心原子有關。
- 中心原子一定時,Δ隨配體不同而改變,主要遵循以下的順序:
- I− < Br− < S2− < SCN− < Cl− < NO3− < N3− < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py < NH3 < en < 2,2'-bipy < phen < NO2− < PPh3 < CN− < CO
- 由於Δ值由光譜確定,故該順序也稱為光譜化學序列,用以表示配體場強度順序。該順序可用配位場理論來解釋。
- 配體一定時,Δ隨中心原子改變。
- 同一元素中心原子電荷越大時,Δ值也越大。
- 不同週期的中心原子,Δ值隨週期數增大而增大。


- Δ值隨配位原子原子半徑減小而增大:I < Br < Cl < S < F < O < N < C。
當某個d軌態中已經有一個電子時,若第二個電子繼續進去與其配對,則電子成對能P可定義為第二個電子克服第一個電子排斥作用所需的能量。在d軌態能階分裂後,d電子的排佈要兼顧能量最低原理和洪特規則,既要儘可能分佔不同軌態且自旋平行,還要保證總體能量最低,因而最終取決於分裂能Δ和電子成對能P的相對大小。
根據光譜化學序列,在CN−和CO等強場配體作用下,配合物分裂能更大,Δ>P,d電子更易在能階低的軌態中排佈,稱為低自旋。比如,在強場配體NO2−的作用下,八面體構型離子[Fe(NO2)6]3−的5個d電子將全部處於軌態中。
與此相反,I−與Br−之類的弱場配體導致Δ<P,d電子更易排佈在能階高的軌態中,稱為高自旋。例如,在含有弱場配體Br−的離子[FeBr6]3−中,5個d電子中有3個處於軌態,2個處於軌態,形成5個單占軌態且為高自旋態。
| d電子數 | 弱場高自旋 | 未成對電子數 | 強場低自旋 | 未成對電子數 | 強場中降低的軌態能量 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↑ | ↑ | ||||||||||||
| ↑ | ↑ | ↑ | ↑ | ||||||||||
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||||||
| ↑ | ↑ | ↑ | ↑ | ↑↓ | ↑ | ↑ | |||||||
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑↓ | ↑↓ | ↑ | ||||||
| ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑↓ | ↑↓ | ↑↓ | ||||||
| ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑↓ | ↑↓ | ↑↓ | ↑ | |||||
| ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||
可見,只有、、和的電子排佈才有可能有兩種不同的排佈。
對正四面體型配合物而言,Δ四面體大約只等於Δ八面體,且成對能P變化不大,因此四面體型配合物都符合洪特規則,為高自旋。
「弱場高自旋,強場低自旋」的結論已得到配合物磁性實驗的證實,可用於預測未知配合物的磁性性質。含有未成對電子的配合物呈順磁性,而不含未成對電子的配合物則呈抗磁性。
晶場穩定化能
假想配體以「球形場」作用於中心原子d軌態不分裂時配合物的能量為0,晶場穩定化能(CFSE)便是配位場引起d軌態分裂導致配合物能量的下降值。晶場穩定化能可通過計算各電子所處能階能量的代數和得到,軌態中的電子會使穩定化能減小,而軌態中的電子則會使穩定化能增加。例如,對於八面體場中的排佈而言,一個電子從球形場進入軌態,能量下降即晶場穩定化能為:-4(計算方法參見上文#能階分裂)。

| 電子構型 | 穩定化能 | 電子構型 | 穩定化能 | ||
|---|---|---|---|---|---|
| -4 | 高自旋 | -4 | |||
| -8 | 低自旋 | -24 + 2P | |||
| -12 | 高自旋 | -8 | |||
| 高自旋 | -6 | 低自旋 | -18 + P | ||
| 低自旋 | -16 + P | -12 | |||
| 高自旋 | 0 | -6 | |||
| 低自旋 | -20 + 2P | 0 | |||
晶場穩定化能也可以解釋其他構型的過渡金屬配合物,並且很多構型原子的平面正方結構便可歸咎於該構型相對較高的穩定化能。需要注意的是,晶場穩定化能並不是配合物絕對穩定性的量度,並且為零的穩定化能只說明考慮d軌態分裂與不考慮d軌態分裂引起的配體與中心原子d軌態之間的排斥力沒有區別,並不表明配合物不具穩定性。
許多配合物的光學性質(吸收光譜和發射光譜的細節)可以用晶場理論來解釋。 但是,金屬配合物更深的顏色通常來自更強烈的電荷轉移激發[4]。
對配合物顏色的解釋
晶場理論還可解釋很多配位化合物的顏色。基態的d電子處在較低能量的軌態中,受光照射獲得能量時,就會吸收光子躍遷到能量較高的一組,發生d-d躍遷。其顯色的基本原因是某些光被吸收而呈現被吸收光的補色,因此,可通過計算吸收光子的能量來進一步預測配合物的顏色。這也是晶場理論被推崇備至的重要原因之一。
由於不同的配體導致的分裂能大不相同,因此配合物的顏色也有很大差異。金屬原子不變時,弱場致使分裂能減小,光的波長增加,頻率減小;強場則使分裂能增大,光頻率增大,補色頻率減小。雖然這只是分裂能不同及配合物顯色的原因之一,其他的還包括電荷遷移、電子排斥及姜-泰勒效應等等,但由強場弱場導致的顯色差異仍在一些化合物中有所體現。

物體的顏色是被吸收的光的補色。
| λ吸收 | 吸收光 | 呈現顏色 | λ呈現 |
|---|---|---|---|
| 400 nm | 紫色 | 黃綠色 | 560 nm |
| 450 nm | 藍色 | 橙色 | 600 nm |
| 490 nm | 藍綠色 | 紅色 | 620 nm |
| 570 nm | 黃綠色 | 紫色 | 410 nm |
| 580 nm | 黃色 | 深藍色 | 430 nm |
| 600 nm | 橙色 | 藍色 | 450 nm |
| 650 nm | 紅色 | 綠色 | 520 nm |
姜-泰勒效應
為了解釋某些過渡金屬配合物中所出現的拉長或扁平八面體穩定結構,1937年,姜(Jahn H.A)與泰勒(Teller E.)用群論證明:
該現象通常出現在排佈的Cu2+中,它含有能量相等的兩種排佈方式:
因而會發生構型畸變。此外,若畸變發生是因高能階d軌態上的簡併態,則變形較大,稱為大畸變;反之則稱為小畸變。
平面正方形配合物也可看作八面體被拉長的極限情況。的Ni2+、Pt2+易生成平面正方形低自旋配合物,可用採取電子結構,z方向排斥比xy平面方向大得多來解釋。
四面體型配合物也可能產生薑-泰勒效應,只是d軌態能階分裂較小,相應的畸變也很小。
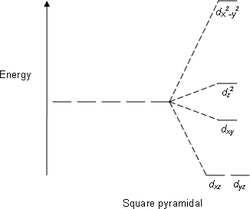
能階分裂圖
- 注意:下圖僅為示意圖,圖中距離和能階的實際分佈不完全一致。
各種構型
-
八面體 -
五角雙錐 -
平面正方 -
四方錐 -
四面體 -
三角雙錐 -
五角錐
參考資料
參見
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.