跨膜蛋白
来自维基百科,自由的百科全书
跨膜蛋白(transmembrane protein,TP)又稱穿膜蛋白,是一種貫穿跨越生物膜(細胞膜或胞器膜)兩端一次或多次的蛋白。
許多跨膜蛋白的功能是作為通道或「裝載碼頭」來實施拒絕或允許某種特定的物質跨過生物膜的運輸、進入細胞,同時,也使要廢棄的副產品運出細胞。當對某種分子做出相應時,這些「負責運載」的跨膜蛋白通過特定的摺疊和彎曲方式,實現該分子的跨過生物膜的運輸。
跨膜蛋白在水中凝聚並沉澱。大多數跨膜蛋白要用去污劑或非極性溶劑提取,少數貝塔-折筒狀蛋白也可用某些變性劑提取。
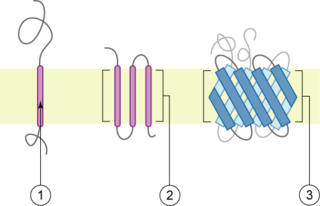
淺棕色部分代表膜
所有的跨膜蛋白是整合膜蛋白(也叫內嵌膜蛋白),但是不是所有的整合膜蛋白都是跨膜蛋白。[1]
類型
跨膜蛋白有兩種基本類型:[2]
- α-螺旋:這種蛋白存在於細菌細胞的內膜或真核細胞的質膜,也有時存在於真核細胞的外膜。[3]這是跨膜蛋白的主要類型。據估計在人體內所有蛋白質的27%是α-螺旋膜蛋白。[4]
- β-筒狀蛋白。到目前為止,這類蛋白僅在革蘭氏陰性細菌的外膜、革蘭氏陽性細菌的細胞壁、以及線粒體和染色質的外膜上發現。所有的β-筒狀跨膜蛋白都有最簡單的上-和-下拓撲學結構,這可以反映出他們共同的進化起源和相似的摺疊機制。另一種分類是根據其N- 和C-末端結構域的位置。I、II、III型為一次跨膜蛋白,而IV型是多次跨膜蛋白。I型跨膜蛋白用停止-傳輸錨定序列錨定到脂質膜上,並且,其N-末端結構域在合成時瞄準於ER腔(內質網腔,並且,如果成熟形式是位於質膜上,則N-末端結構域則瞄準於細胞外間隙。II型和III型用信號錨定序列錨定。II型用其C-末端結構域瞄準ER腔,而III型有其N-末端結構域瞄準ER腔。IV型有兩個亞型-IV-A和IV-b。IV-A用其N-末端結構域瞄準細胞質,而IV-B則用其N-末端瞄準腔。[5]劃分成四種類型的意義特別顯示於轉運和內質網束縛的翻譯時。此時,蛋白必須根據類型決定其通過內質網膜的方向。
熱力學穩定性和折疊
從熱變性研究判定α-螺旋跨膜蛋白通常是穩定的,因為在膜內它們不完全解折疊(在非極性介質中的完全展開需要斷裂太多的α-螺旋H-鍵)。另一方面,這些蛋白很容易「錯折疊」,因為在膜中的非天然聚集轉化成熔球態,形成非天然的雙硫鍵,或者外周區域和不規則環的解折疊,這些解使局部穩定性降低。。
恰當地定義「解折疊態」也很重要。在去污劑膠束中的膜蛋白的「解折疊態」不同於熱變性實驗中的「解折疊態」。在去污劑中的狀態代表了折疊的疏水α-螺旋和去污劑覆蓋的部分解折疊片段。例如,在十二烷基磺酸鈉(SDS)膠束中的「解折疊」的細菌視紫紅質有四個折疊的跨膜α-螺旋,而其餘的蛋白則位於膠束-水界面並且可取不同的非天然的兩性分子的結構類型。在這樣的去污劑失活的和天然態之間的自由能差相似於水溶性蛋白的穩定性(< 10 kcal/mol)。
α-螺旋跨膜蛋白在體外(in vitro)的再折疊在技術上是困難的。有相對較少的成功再折疊實驗的例子,比如像對細菌視紫紅質的實驗。在體內(in vivo)通常所有這樣的蛋白是在大的膜易位子(translocon)中翻譯摺疊的。易位子通道對新生的跨膜α-螺旋提供了一種高度異質的環境。相對極性的兩性α-螺旋可以接受在易位子中的跨膜定向(儘管它可能是在膜表面或「在體外」解摺疊),因為它的極性殘基可以面對中心充水的易位子通道。這樣的機制對於將極性的α-螺旋結合到跨膜蛋白的結構中是必需的。如果蛋白保持解摺疊和附着在易位子上的時間太長,它會被專門的「質量控制」細胞體系所降解。
根據化學變性研究,β-筒狀蛋白的穩定性與水溶性蛋白的穩定性相似。它們「在體內」的折疊被水溶性分子伴侶如,蛋白Skp[1]所易化。
三維(3D)結構

- 線粒體運載蛋白[6] (頁面存檔備份,存於網際網路檔案館)
- 主要的易化因子超家族(Major Facilitator Superfamily,甘油-3-磷酸轉運子、乳糖透性酶、和多藥轉運子(Multidrug transporter EmrD)[7] (頁面存檔備份,存於網際網路檔案館)
- 耐藥節結化細胞分化家族(Resistance-nodulation-cell division family,多藥外排轉運子AcrB,見多藥耐藥)[8] (頁面存檔備份,存於網際網路檔案館)
- 二羧酸/氨基酸:陽離子協同轉運子(質子穀氨酸協同轉運子)[9] (頁面存檔備份,存於網際網路檔案館)
- 單價陽離子/質子反向轉運子(鈉/質子反向轉運子1 NhaA) [10] (頁面存檔備份,存於網際網路檔案館)
- 神經遞質鈉協同轉運子[11] (頁面存檔備份,存於網際網路檔案館)
- 氨轉運子[12] (頁面存檔備份,存於網際網路檔案館)
- 藥物/代謝轉運子(小型多藥抗藥轉運子EmrE-結構回收錯誤)[13] (頁面存檔備份,存於網際網路檔案館)
- 電壓門離子通道如:包括鉀通道KcsA和KvAP,和內向整流鉀離子通道Kirbac [14] (頁面存檔備份,存於網際網路檔案館)
- 大傳導性機械式感應通道,(MscS)[15] (頁面存檔備份,存於網際網路檔案館)
- 機械式感應通道|小傳導性機械式感應通道(MscS)[16] (頁面存檔備份,存於網際網路檔案館)
- 鎂傳輸子|CorA金屬離子傳輸子[17] (頁面存檔備份,存於網際網路檔案館)
- 神經遞質受體的配位體門離子通道(乙酰膽堿受體)[18] (頁面存檔備份,存於網際網路檔案館)
- 水通道蛋白[19] (頁面存檔備份,存於網際網路檔案館)
- 氯通道[20] (頁面存檔備份,存於網際網路檔案館)
- 外膜輔助蛋白(多糖傳輸子)[21] (頁面存檔備份,存於網際網路檔案館)來自細菌外膜的α-螺旋跨膜蛋白
- T細胞受體跨膜二聚化區域[22] (頁面存檔備份,存於網際網路檔案館)
- 細胞色素c亞硝酸還原酶復合物[23] (頁面存檔備份,存於網際網路檔案館)
- 磺基氫化酶[24] (頁面存檔備份,存於網際網路檔案館)
- Stannin [25] (頁面存檔備份,存於網際網路檔案館)
- 血型糖蛋白A二聚體[26] (頁面存檔備份,存於網際網路檔案館)
- 絲狀病毒(絲狀噬菌體)主要包衣蛋白[27] (頁面存檔備份,存於網際網路檔案館)
- 菌毛蛋白[28] (頁面存檔備份,存於網際網路檔案館)
- 肺表面活性劑相關的蛋白[29] (頁面存檔備份,存於網際網路檔案館)
- 單胺氧化酶A和B [30] (頁面存檔備份,存於網際網路檔案館),
- 脂肪酸胺水解酶[11]
- 細胞色素CP450氧化酶[31] (頁面存檔備份,存於網際網路檔案館)
- 鹽皮質激素|皮質類固醇11β-脫氫酶[32] (頁面存檔備份,存於網際網路檔案館)
- 信號肽肽酶[33] (頁面存檔備份,存於網際網路檔案館)
- 專用於人類紅細胞膜整合蛋白(stomatin)類似物的膜蛋白酶[34] (頁面存檔備份,存於網際網路檔案館)
- T細胞受體跨膜二聚化區域[38] (頁面存檔備份,存於網際網路檔案館)
- 細胞色素c亞硝酸還原酶復合物[39] (頁面存檔備份,存於網際網路檔案館)
- 磺基氫化酶[40] (頁面存檔備份,存於網際網路檔案館)
- Stannin [41] (頁面存檔備份,存於網際網路檔案館)
- 血型糖蛋白A二聚體[42] (頁面存檔備份,存於網際網路檔案館)
- 絲狀病毒(絲狀噬菌體)主要包衣蛋白[43] (頁面存檔備份,存於網際網路檔案館)
- 菌毛蛋白[44] (頁面存檔備份,存於網際網路檔案館)
- 肺表面活性劑相關的蛋白[45] (頁面存檔備份,存於網際網路檔案館)
- 單胺氧化酶A和B [46] (頁面存檔備份,存於網際網路檔案館),
- 脂肪酸胺水解酶[11]
- 細胞色素CP450氧化酶[47] (頁面存檔備份,存於網際網路檔案館)
- 鹽皮質激素|皮質類固醇11β-脫氫酶[48] (頁面存檔備份,存於網際網路檔案館)
- 信號肽肽酶[49] (頁面存檔備份,存於網際網路檔案館)
- 專用於人類紅細胞膜整合蛋白(stomatin)類似物的膜蛋白酶[50] (頁面存檔備份,存於網際網路檔案館)
- 來自於八個貝塔-折疊鏈並且剪切次數(shear number)為10的貝塔筒狀蛋白(n=8, S=10)
[51] (頁面存檔備份,存於網際網路檔案館). 它們包括,:
- OmpA-樣跨膜區域(OmpA),
- 病毒毒力相關的外膜蛋白家族(OmpX),
- 外膜蛋白W家族(OmpW),
- 抗菌肽耐藥性和脂質A酰化作用蛋白家族(PagP)
- 脂質A脫酰化酶PagL,和
- 透明質家族孔蛋白(NspA)
- 自主轉運蛋白結構域(n=12,S=14')[52] (頁面存檔備份,存於網際網路檔案館)
- FadL外膜蛋白轉運家族,包括脂肪酸轉運蛋白FadL(n=14,S=14)[53] (頁面存檔備份,存於網際網路檔案館)
- 普通細菌孔蛋白家族也叫三聚體(n=16,S=20)[54] (頁面存檔備份,存於網際網路檔案館)
- 麥芽糖孔蛋白或糖孔蛋白(n=18,S=22)[55] (頁面存檔備份,存於網際網路檔案館)
- 核苷特異孔蛋白(n=12,S=16)[56] (頁面存檔備份,存於網際網路檔案館)
- 外膜磷脂酶A1(n=12,S=16)[57] (頁面存檔備份,存於網際網路檔案館)
- TonB-依賴性受體和它們的TonB-依賴性受體#塞式結構域。它們是配體門控制外膜通道(n=22,S=24),包括鈷胺轉運蛋白BtuB、Fe (III) -綠膿桿菌螯鐵蛋白受體FptA、三價鐵羥肟酸攝取受體FhuA、轉運子FecA、和熒光嗜鐵素pyoverdine受體FpvA。[58] (頁面存檔備份,存於網際網路檔案館)
- 外膜蛋白OpcA家族(n=10,S=12)包括外膜蛋白酶OmpT和黏附素/侵襲素OpcA蛋白[59] (頁面存檔備份,存於網際網路檔案館)
- 外膜蛋白G孔蛋白家族(n=14,S=16)[60] (頁面存檔備份,存於網際網路檔案館)
注釋:n和S分別代表貝塔折疊鏈的數目和剪切次數[12] of the beta-barrel
參考文獻
參見
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
