鏷
原子序數為91的化學元素 来自维基百科,自由的百科全书
此條目翻譯自英語維基百科,需要相關領域的編者協助校對翻譯。 |
此條目尚未參照元素專題之格式編寫。 |
鏷是在1913年由卡西米爾·法揚斯和奧斯瓦爾德·格林發現,並將其命名為「brevium」(拉丁語,意為短暫、短期),因為當時發現的鏷同位素234mPa的半衰期很短。1917至1918年間,莉澤·邁特納和奧托·哈恩共同發現了一種更穩定的鏷同位素231Pa ,半衰期約32000年,因此,他們將該元素的名稱變更為鏷(protactinium)(proto,希臘文,意為之前;以及actinium,錒元素),因為231Pa是錒同位素227Ac的母同位素。1949年,IUPAC選擇了「鏷」這一名稱,並認定哈恩和邁特納為鏷的發現者。
鏷壽命最長且最主要的天然同位素為235U的衰變產物231Pa,半衰期為32760年,遠短於地球的年齡,因此所有原始的鏷元素,也就是在地球形成時可能存在的鏷,至今都已全部衰變殆盡。現今鏷在自然界中主要作為鈾的衰變產物在鈾礦中微量生成,含量非常稀少,在地殼中的平均濃度通常為兆分之一,但在一些晶質鈾礦的礦床中可能達到百萬分之一。鏷因為稀少,且具有高放射毒性,除了科學研究之外沒有其他用途。由於天然鈾礦中的鏷含量非常稀少,作為提取來源並不實際,因此目前研究用的鏷主要是從用過核燃料中提取。
歷史
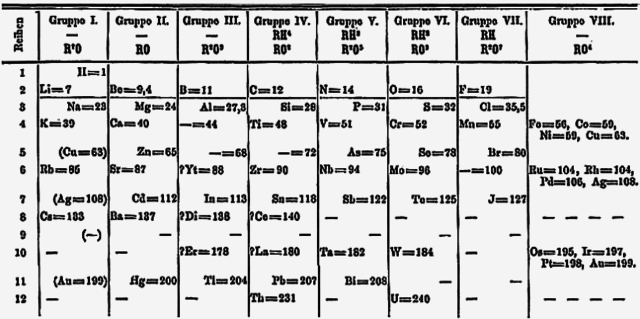
早在1871年,德米特里·門得列夫便預測釷和鈾之間有未知元素的存在,並在週期表中預留了位置。[5]由於當時錒系元素的概念還沒有被提出,所以在1871年版的門得列夫週期表的排序方式中,釷位於第Ⅳ族,鈾位於第Ⅵ族,並在第V族的鉭下方的位置留空。這樣的編排方式一直持續到1950年代[6],並造成很長一段時間內化學家們都積極在尋找與鉭性質相似的新元素,從而使發現鏷的機率趨近於零。實際上,下一個與鉭有相似化學性質的V族元素為人造元素𨧀。
1900年,威廉·克魯克斯將硝酸鈾醯溶解於乙醚中,發現剩餘的水中含有234Th和另一未知強烈放射性物質。他將它從硝酸鈾醯分離,這個物質便是鏷。但他不知道他發現了一個新的化學元素,並將其命名為鈾-X。[5][7][8]
鏷真正首次發現於1913年,當時法揚斯和奧斯瓦爾德·格林,在他們所研究的鈾-238衰變鏈(238U→234Th→234Pa→234U)中,發現了鏷的同位素234Pa。因為它的半衰期短只有6.7小時,所以他們將他們發現的新元素命名為Brevium(拉丁語,意思是短暫、短期)。
1917年至1918年間,兩組科學家奧托·哈恩和莉澤·邁特納,以及德國和英國的弗雷德里克·索迪和約翰·克蘭斯登,發現了鏷的另一個同位素231Pa,半衰期約32000年。因此,他們將名稱從Brevium變更為鏷(Proto-actinium)(proto,希臘文:πρῶτος,意義為之前、首先),因為鏷-231在鈾-235衰變鏈中的位置在錒-227之前,為錒-227的母同位素。
1927年,阿里斯蒂德·馮·格羅斯提取出2毫克的五氧化二鏷(Pa2O5),並於1934年首次在0.1毫克的五氧化二鏷中分離出純鏷。
英國原子能管理局(UKAEA)在1961年花了50萬美元處理了60噸的用過核燃料,提煉出約125克純度為99.9%的鏷[9][10] ,並成為多年來世界上唯一的鏷來源,提供給各實驗室進行科學研究。[5]鏷目前的價格非常昂貴,美國橡樹嶺國家實驗室於2011年公布1克的鏷約為280美元。[11]
生成

鏷是天然存在的元素中最罕見和最昂貴的元素之一。由於235U的α衰變(會產生鏷-231),以及238U的β衰變(產生鏷-234),因此自然界的鏷通常是以231Pa和234Pa的形式存在。自然界中的鈾以238U為主(佔天然鈾的99.284%),而幾乎所有的238U(99.8%)都會衰變成234mPa,但由於234Pa和234mPa的半衰期都極短,會很快地衰變成234U,因此自然界中豐度最高的鏷同位素為長壽的231Pa,約占天然鏷的100%。
鏷-233是釷-232發生中子俘獲所形成的。而它會再衰變成鈾-233,或者捕捉另一個中子,並轉換成非裂變的鈾-234。
鏷在方鈾礦(瀝青鈾礦)中的濃度約為0.3至3 ppm(百萬分點濃度),大部分為0.3ppm,但部分從剛果民主共和國出產的鈾礦中鏷的濃度可達3 ppm。在大多數的天然材料和水中,鏷以兆分之一以下的濃度均勻分布,放射性約為0.1皮居里/克。
製備
在核反應堆出現之前,鏷是從鈾礦石用科學實驗方法分離。如今,它主要是釷的高溫反應器中的中間產物:
在核反應爐中,可以利用慢中子照射釷-230而將其轉化為釷-231,或利用快中子照射釷-232生成釷-231和2個中子,隨後釷-231快速發生負β衰變生成鏷-231。
物理及化學性質
鏷是銀灰色光澤的金屬,可保存於空氣中一段時間。
鏷在週期表中位於釷的右側、鈾的左側,而其物理性質正介於這兩個錒系元素之間。鏷的密度比釷大,而比鈾小;其熔點低於釷,而高於鈾。這三個元素彼此的熱膨脹、電導率和熱導率相當,表現出典型的貧金屬特徵。估計鏷的剪切模量與鈦相近。[15]
在室溫下,鏷是體心四方結構,其可被視為扭曲的體心立方晶格結晶:而這種結構在被壓縮至高達53 GPa時仍不會改變。從大約1200°C的高溫冷卻後,其結構變為面心立方(fcc)。[12][16]從室溫至700°C之間其四方相的熱膨脹係數為9.9×10-6/°C。[12]
鏷具有順磁性,且在任何溫度下都不會發生磁躍遷。[17]它在溫度低於1.4K時將成為超導體。[5][13]四氯化鏷在室溫下是順磁性的,但在冷卻至182K後會轉為鐵磁性。[18]
無論是在固體和水溶液中,鏷存在兩個主要的氧化態:+4和+5,而+3和+2態的鏷也在一些固相中被觀察到。由於它的電子組態是[Rn]7s26d15f2,+5氧化態對應的低能量有利於5f0的電子填入。+4和+5態的鏷都很容易在水中形成氫氧化物,主要離子包括Pa(OH)3+、Pa(OH)2+
2、Pa(OH)+
3以及Pa(OH)4,皆為無色的。其他已知的離子包括PaCl2+
2、PaSO2+
4、PaF3+、PaF2+
2、PaF−
6、PaF2−
7以及PaF3−
8。
化合物
| 化學式 | 顏色 | 結構 | 空間群 | 空間群編號 | 皮爾遜符號 | a (pm) | b (pm) | c (pm) | Z | 密度, g/cm3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Pa | 銀灰 | 四方晶系 | I4/mmm | 139 | tI2 | 392.5 | 392.5 | 323.8 | 2 | 15.37 |
| PaO | 岩鹽[14] | Fm3m | 225 | cF8 | 496.1 | 4 | 13.44 | |||
| PaO2 | 黑 | 面心立方[14] | Fm3m | 225 | cF12 | 550.5 | 4 | 10.47 | ||
| Pa2O5 | 白 | Fm3m[14] | 225 | cF16 | 547.6 | 547.6 | 547.6 | 4 | 10.96 | |
| Pa2O5 | 白 | 斜方晶系[14] | 692 | 402 | 418 | |||||
| PaH3 | 黑 | 立方晶系[14] | Pm3n | 223 | cP32 | 664.8 | 664.8 | 664.8 | 8 | 10.58 |
| PaF4 | 紅棕 | 單斜晶系[14] | C2/c | 15 | mS60 | 2 | ||||
| PaCl4 | 黃綠 | 四方晶系[19] | I41/amd | 141 | tI20 | 837.7 | 837.7 | 748.1 | 4 | 4.72 |
| PaBr4 | 棕 | 四方晶系[20] | I41/amd | 141 | tI20 | 882.4 | 882.4 | 795.7 | ||
| PaCl5 | 黃 | 單斜晶系[21] | C2/c | 15 | mS24 | 797 | 1135 | 836 | 4 | 3.74 |
| PaBr5 | 紅 | 單斜晶系[22] | P21/c | 14 | mP24 | 838.5 | 1120.5 | 1214.6 | 4 | 4.98 |
| PaOBr3 | 單斜晶系 | C2 | 1691.1 | 387.1 | 933.4 | |||||
| Pa(PO3)4 | 斜方晶系[23] | 696.9 | 895.9 | 1500.9 | ||||||
| Pa2P2O7 | 立方晶系[23] | Pa3 | 865 | 865 | 865 | |||||
| Pa(C8H8)2 | 金黃 | 單斜晶系[24] | 709 | 875 | 1062 |
a,b和c是晶格常數,單位為皮米;Z是每單位晶格中的首欄化學式數目。
同位素
目前已發現29種鏷的同位素,全部都具有放射性。其中最穩定的是231Pa,半衰期為32760年,233Pa的半衰期為27天,230Pa的半衰期為17.4天。其它的大部分都小於1.6天,其中的大部分又小於1.8秒。鏷還有兩個核異構體:217mPa(半衰期 1.2毫秒)和234mPa(半衰期 1.17分)。[25]
鏷主要有兩種衰變模式:較輕同位素(211Pa至231Pa)的主要衰變模式為α衰變,產物多為錒的同位素;較重同位素(232Pa至240Pa)的主要衰變模式為β衰變,產物為鈾的同位素。[25]
應用
雖然元素週期表中位於鏷前後的釷和鈾由於半衰期長且存量豐富而都有著廣泛的應用,但鏷本身由於存量稀少,且具有高放射性和高毒性,目前在科學研究之外沒有其他用途。[26]
鏷-231是由核反應爐中鈾-235發生α衰變所產生,或者由以下反應232Th + n → 231Th + 2n,接著231Th發生β衰變生成。它曾經被認為能夠維持核連鎖反應,理論上可以用來製造核武器,物理學家沃爾特·塞弗里茨曾估計其臨界質量為750±180公斤。[27]然而,由於難以製成如此大量的鏷,以鏷製造核武器的可能性已被排除。[28]
隨著高靈敏度質譜儀的面世,鏷開始在地質學和古海洋學中用作示蹤劑,可透過沉積物中鏷-231和釷-230的比例對其進行年代測定,並用於模擬礦物的形成。[29]使用此法測定海洋沉積物的年代,可讓科學家們能夠重建冰河時期冰川最後一次融化期間北大西洋水體的流動。[30]一些與鏷相關的年代測定依靠於對鈾衰變鏈中幾個長壽命同位素的相對濃度的分析,例如鈾、鏷和釷。這三個元素分別具有6、5和4個價電子,因此易形成+6、+5和+4氧化態,並表現出不同的物性和化性。其中釷和鏷的化合物難溶於水,會沉澱成沉積物,而鈾則否,且釷的沉澱速率比鏷快。分析鏷-231(半衰期32760年)和釷-230(半衰期75380年)的濃度比例與僅測量一種同位素的濃度相比,可以提高年代測定的準確度。此外,這種雙同位素測定法受同位素空間分佈的不均勻性及其沉澱速率的變化性影響較小。[29][31]
安全
鏷在人體中不發揮任何生物學作用[32],但由於其具有高度的放射性,對生物體具有很高的毒性,因此須在密封的手套箱進行操作。其最穩定的同位素鏷-231的活性比度為每克0.048居里(1.8GBq),主要會發射能量為5MeV的α粒子,用任何材料的薄片或皮膚即可阻擋,通常只有在被攝入體內時才會對健康構成危害。[32]然而它會慢慢地衰變成錒-227,半衰期為32760年。錒-227的活性比度為每克74居里(2700GBq),會同時發射α及β粒子,半衰期僅22年。錒-227接著會衰變成一些半衰期更短、活性比度更大的放射性同位素,最終衰變成穩定的鉛-207。其衰變鏈整理於下表:
鏷是微量存在於自然界中的天然元素,可通過進食、飲水或呼吸空氣進入體內。當吸入時,很大一部分的鏷可以從肺部透過血液移動到其他器官,這取決於該鏷化合物的溶解度。[32]通常人體內沉積的鏷可能是腸胃道從食物和飲水中吸收而來,攝入體內的鏷中只有大約0.05%會進入血液,其餘的則會被排出體外。血液中的鏷有大約40%進入骨骼中,約15%進入肝臟,2%進入腎臟,其餘的被排泄出體外。鏷在骨骼中的生物半衰期約為50年,而在其他器官中,其排泄動力學具有快速和緩慢的組成部分。例如肝臟中70%的鏷的生物半衰期為10天,剩下的30%為60天;腎臟的相應值則為20%(10天)和80%(60天)。在鏷處於這些器官中的期間內,其放射性會持續增加癌症產生的風險。[26][33]鏷在人體內的最大放射性活度安全劑量是0.03微居里(1.1kBq),相當於0.5微克鏷-231的放射性,這種同位素的毒性是氫氰酸的2.5×108倍。[34]在德國,鏷-231在空氣中的最大允許濃度為3×10-4 Bq/m3。[33]
參考資料
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.






![{\displaystyle \mathrm {^{232}_{\ 90}Th\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 90}^{233}Th\ {\xrightarrow[{22.3\ min}]{\beta ^{-}}}\ _{\ 91}^{233}Pa\ {\xrightarrow[{26.967\ d}]{\beta ^{-}}}\ _{\ 92}^{233}U} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/721d2b9fd9152c99eb0a1e923c8d54972a5e464a)