過氧化氫
化合物 来自维基百科,自由的百科全书
過氧化氫是一種化合物,化學式為H
2O
2。過氧化氫溶液(俗稱雙氧水[1])在純淨狀態下是一種粘度略高於水的淡藍色液體[2]。過氧化氫可用作氧化劑、漂白劑和抗菌劑,通常在水中以稀釋液(濃度為3%—6%)的形式供消費者使用,而較高濃度的過氧化氫則用於工業用途。濃縮過氧化氫(或稱高濃度過氧化氫)在加熱時會發生爆炸性分解,在火箭中被用作單組元推進劑和氧化劑[3]。
| 過氧化氫 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 hydrogen peroxide | |||
| 別名 | 雙氧水 二氧烷 氧烷基 過羥酸 0-羥醇 | ||
| 識別 | |||
| CAS號 | 7722-84-1 | ||
| PubChem | 784 | ||
| SMILES |
| ||
| RTECS | MX0900000 | ||
| 性質 | |||
| 化學式 | H2O2 | ||
| 摩爾質量 | 34.0147 g·mol⁻¹ | ||
| 外觀 | 淡藍色液體 溶液無色 | ||
| 密度 | 1.463 g/cm3 (液) | ||
| 熔點 | −0.43 °C(31.23 °F;272.72 K) | ||
| 沸點 | 150.2 °C(302.4 °F;423.3 K) | ||
| 溶解性(水) | 混溶 | ||
| pKa | 11.65 | ||
| 黏度 | 1.245P,當室溫為20 °C(68 °F;293 K) | ||
| 偶極矩 | 2.26D | ||
| 危險性 | |||
| 警示術語 | R:R5-R8-R20-R22-R35 | ||
| 安全術語 | S:S1/2-S17-S26-S28-S36-S37-S39-S45 | ||
| MSDS | 30%過氧化氫—MSDS 60%過氧化氫—MSDS | ||
| 主要危害 | 氧化性、腐蝕性 | ||
| NFPA 704 | |||
| 閃點 | 不可燃 | ||
| 致死量或濃度: | |||
LD50(中位劑量)
|
1518 mg/kg | ||
| 相關物質 | |||
| 相關化學品 | 水、臭氧、肼 硫氧化氫、二硫化氫、多硫化氫 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
過氧化氫是一種活性氧物質,也是最簡單的過氧化物,具有氧-氧單鍵的化學結構。它在光照下會緩慢分解成水和元素氧,而在接觸有機物或活性化合物時則會迅速分解。過氧化氫通常與穩定劑一起存儲在用不透明的瓶子裝起來的弱酸性溶液中。過氧化氫在包括人體在內的生物系統中廣泛存在。分解或利用過氧化氫的酶被稱為過氧化氫酶。
性質
純過氧化氫是淡藍粘稠液體,熔點−0.43 °C(272.72 K),沸點150.2 °C(423.3 K)。凝固點時固體密度每立方厘米1.71克,密度隨溫度升高而降低。其締合度比水大,故介電係數和沸點比水高。純過氧化氫甚穩定,但加熱到153 °C(426 K)便猛烈分解為水和氧氣。
- H2O2 ↔ H++HO2- Ka1=2.4×10-12
- HO2- ↔ H++O22- Ka2≈10-25
過氧化氫與過量氫氧化鈉反應生成過氧化鈉和水;與氫氧化鋇反應生成過氧化鋇。
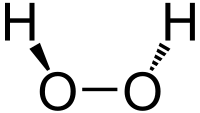
過氧化氫分子為椅型結構,左圖為氣態時的結構,右圖為固態晶體時的結構:
催化劑
生物體內過氧化氫酶(Catalase)可催化雙氧水分解,使其釋放出氧氣,轉化為對有機體無毒的水:
發現
1818年,L.J.Thenard發現水系無機物、有機物在自動氧化時,或者在生物體內呼吸氧氣時,在生成水之前會生成過氧化氫。
製備
1950年代以前採用電解法製備過氧化氫,電解硫酸氫鹽溶液(如硫酸氫銨、硫酸氫鉀)得到過二硫酸鹽[4],再加入硫酸[5]得到過氧化氫。
反應
過氧化氫是非常強的氧化劑,它和其他氧化劑的標準電極電勢值列在右面,值越高代表氧化性越強:
該反應在熱力學自發:ΔHo為−98.2 kJ·mol−1,ΔGo為−119.2 kJ·mol−1,ΔS為70.5 J·mol−1·K−1。重金屬離子Fe2+、Mn2+、Cu2+等可催化過氧化氫分解。它們在酸溶液中的電勢介於過氧化氫的電勢(0.694至1.76伏)之間,如Fe3+,認為過氧化氫把Fe3+還原為Fe2+,而本身氧化成氧氣,過氧化氫又氧化產生的Fe2+為Fe3+,過氧化氫還原成水。過氧化氫在酸性和中性介質中甚穩定,在鹼性介質易分解。過氧化氫用波長320至380nm的光照射會加速分解,應盛於棕色瓶並放在陰涼處。無水或濃縮過氧化氫必須在無塵、無金屬雜質等環境處理,以防爆炸。H2O2與Fe2+的混合溶液稱為芬頓試劑(Fenton)。Fe2+、Ti3+等的離子催化過氧化氫分解生成自由基中間體HO·(羥基自由基)和HOO·。一般使用的雙氧水都會有一定量的穩定劑以減慢過氧化氫分解,常用穩定劑包括錫酸鈉、焦磷酸鈉、8-羥基喹啉和有機亞磷酸酯。[10]
過氧化氫可在水溶液中氧化或還原很多無機離子,作還原劑時產物為氧,作氧化劑時產物為水;如酸性溶液中,過氧化氫可將Fe2+氧化為Fe3+:
過氧化氫可氧化亞硫酸根(SO2−
3)為硫酸根(SO2−
4)。高錳酸鉀在酸性溶液會還原為Mn2+;標準電極電勢顯示,反應在不同pH的方向可能不同,如鹼性溶液中,過氧化氫會將錳II氧化為錳IV,以二氧化錳形式生成。
過氧化氫還原次氯酸鈉的反應可用於實驗室製備氧氣:
有機化學常用過氧化氫作氧化劑,可將硫醚氧化為亞碸;將甲基苯基硫醚氧化為甲基苯基亞碸,以甲醇作溶劑或三氯化鈦催化,產率為99%:
鹼性過氧化氫溶液可用於環氧化富電子烯烴(如丙烯酸),以及在硼氫化-氧化反應第二步中氧化烷基硼至醇。
優點是氧化力強,還原產物為水,不引入雜質且不污染環境,是用途十分廣泛的氧化劑。
過氧化氫與很多無機或有機化合物反應時,過氧鏈保留並轉移到另一分子,生成新的過氧化物:
- 過氧化氫可生成很多含有O22−過氧離子的無機鹽類,較重要的有過氧化鈉、過氧化鎂和過氧化鈣
- 過氧化氫在低溫與酸性鉻酸或重鉻酸鹽溶液反應生成不穩定藍色過氧化鉻CrO(O2)2,可用乙醚或戊醇萃取,過氧化鉻在水溶液會與過氧化氫繼續反應,藍色迅速消失,得到氧氣和鉻離子。這反應可用來檢驗過氧化氫和鉻酸根或重鉻酸根。
- 4H2O2+Cr2O72-+2H+ → 2CrO5+5H2O
- 7H2O2+2CrO5+6H+ → 7O2↑+2Cr3++10H2O
- Na₂B₄O₇+4H₂O₂+2NaOH → 2Na₂B₂O₄(OH)₄+H₂O
與水相比,過氧化氫的鹼性要弱得多,只有與很強的酸反應才會生成加合物。超強酸氟銻酸(HF/SbF5)可質子化過氧化氫,生成含[H3O2]+離子的產物。
用途
稀(如3%)過氧化氫主要用於殺菌及外用的醫療用途,如消毒傷口。檢驗血液的最佳比率:6%雙氧水加0.005%亞甲藍。過氧化氫甚易化解,以界面活化劑等混合過氧化氫(稱為加速過氧化氫Accelerated Hydrogen Peroxide,簡稱AHP)﹐除加強殺菌消毒的效果,也可用作兼具殺菌效能的清潔劑。
較濃者(濃於10%),則用於紡織品、皮革、紙張、木材製造工業,作為漂白及去味劑。過氧化氫也是染髮劑的成份之一,還用作合成有機原料(鄰苯二酚)的材料,醫藥、金屬表面處理劑,聚合引發劑等。還可用作火箭推進劑。
很多顏料、塗料含有鉛白。使用鉛白的油畫、壁畫等藝術品長時間暴露在空氣中,與硫化氫作用生成硫化鉛而變暗發黑,用過氧化氫塗刷會生成白色的硫酸鉛從而復原之。
- PbS+4H2O2 → PbSO4+4H2O
歷史事件
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.