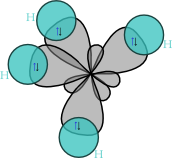
混成軌域(英語:Hybrid orbital)是指原子軌域經混成(hybridization)後所形成的能量簡併的新軌道,用以定量描述原子間的鍵結性質。與價層電子對互斥理論可共同用來解釋分子軌域的形狀。混成概念是萊納斯·鮑林於1931年提出。
此條目需要擴充。 (2011年9月21日) |
此條目需要精通或熟悉相關主題的編者參與及協助編輯。 |

發展史
化學家萊納斯·鮑林第一個提出了雜化軌道理論來解釋甲烷(CH4)等分子的結構[1]。 這個概念原本是為了解釋簡單的化學系統而開發的,但是這種方法後來被廣泛應用,至今天它仍然是一種解釋有機化合物結構的有效理論。
軌道是描述電子在分子中的行為的一個模型。對於較簡單的原子,如氫原子,薛定諤方程可以被精確求解。在較重的原子(如碳、氮、氧)中,原子使用了2s和2p軌道,類似氫原子的激發態軌道,雜化軌道被認為是這些原子軌道以不同的比例互相疊加而成的混合。雜化軌道理論給出了路易士結構的量子力學解釋,因而在有機化學裡得到了廣泛應用。
例子

參考文獻
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
 ,
,  ...
...