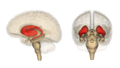
Смугасте тіло
З Вікіпедії, вільної енциклопедії
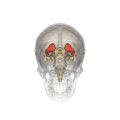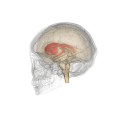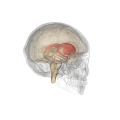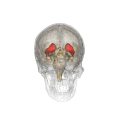
Смугасте тіло (лат. corpus striatum) — підкіркове утворення переднього мозку і надзвичайно важливий компонент екстрапірамідної системи й системи винагород (англ. Reward System), яке отримує глутамінергічні та дофамінергічні імпульси з різних структур і служить вхідними воротами імпульсів до решти системи базальних гангліїв. У всіх приматів волокнами білої речовини, які називають внутрішньою капсулою, дорзальна частина смугастого тіла поділяється на дві частини, які називаються хвостате ядро і сочевицеподібне ядро. Вентральна частина складається з прилеглого ядра і нюхового горбка. Смугасте тіло координує декілька когнітивних функцій, включаючи рухи й їхнє планування, прийняття рішень, мотивації, підкріплення й винагороду.
| Смугасте тіло | |
|---|---|
 | |
 Дорзальна частина смугастого тіла миші | |
| Деталі | |
| Частина від | Базальні ганглії, Екстрапірамідна система, Система винагород |
| Ідентифікатори | |
| Латина | Corpus striatum |
| Анатомія Грея | subject #189 |
| MeSH | D003342 |
| NeuroNames | 225 |
| NeuroLex ID | birnlex_1672 |
| TA98 | [0-9.%2b&id=A14.1.09.516 A14.1.09.516] і [0-9.%2b&id=A14.1.09.515 A14.1.09.515] |
| TA2 | 5559 |
| FMA | 77618 і 77616 |
| Анатомічна термінологія | |
Структура
Узагальнити
Перспектива
Типи клітин
Смугасте тіло — гетерогенна структура з точки зору його компонентів — нейронів.[1]
- Шипуваті проєкційні нейрони («середні шипуваті нейрони») є основними нейронами смугастого тіла[2], вони є ГАМК-ергічними, класифікуються як гальмівні й становлять 95 % від загальної популяції нейронів у стріатумі людини.[2] Середні шипуваті нейрони мають два основних фенотипи (тобто характерні типи): D1-тип і D2-тип.[2][3][4]
- Холінергічні інтернейрони вивільняють ацетилхолін, який має цілий ряд важливих ефектів у смугастому тілі. У людини, інших приматів і гризунів, ці інтернейрони реагують на важливі стимули навколишнього середовища стереотипними відповідями, які врівноважуються з відповідями дофамін-ергічних нейронів чорної субстанції.[5][6] через дофамінові рецептори D5.[7]
- Є багато типів ГАМК-ергічних інтернейронів.[1] найбільш відомими є парвальбумін-позитивні, які беруть участь у потужному прямому гальмуванні основних нейронів.[8] крім того, є ГАМК-ергічні інтернейрони, які тропні до тирозин гідроксилази[9], соматостатину, синтази оксиду азоту та нейропептіда-Y[10] [11].
У дорослих людей в смугастому тілі постійно виробляються нові нейрони, і це може зіграти важливу роль у нових методах лікування нейродегенеративних розладів[12].
Анатомічні структурні елементи


Смугасте тіло поділяється на дорзальну й вентральну частини відповідно до анатомічного розташування і функціональних зв'язків. Вентральний стріатум складається з прилеглого ядра і нюхового горбка, в дорсальний стріатум входять хвостате ядро і лушпина.
Дорсальний стріатум може бути диференційований відповідно до імунохімічних характеристик — зокрема, стосовно ацетилхолінестерази і кальбіндину (див. мал. «Матриці і стріосомні відсіки»).

Аферентні зв'язки
Найважливішими з аферентних шляхів по кількості аксонів — кортикостріарні (від кори головного мозку до смугастого тіла). Багато зон кори мозку інервують дорсальний стріатум. Кіркові пірамідальні нейрони, які віддають свої аксони в смугасте тіло, знаходяться в шарах II—VI, але найбільш щільні волокна приходять з шару V[14]. Вони, переважно, закінчуються на шипах шипуватих нейронів і є глутамін-ергічними нейронами. Інший відомий аферентних шлях — нігростріарний, що починається від нейронів pars compacta чорної субстанції. Також існують аференти від інших елементів базальних гангліїв, таких, як субталамічне ядро (глутамін-ергичні) чи зовнішня (покришкова) частина блідої кулі (ГАМК-ергічні).
Відцентрові (еферентні зв'язки)
Стріарні вихідні (еферентні, відцентрові) шляхи від вентральних і дорзальних компонентів, що складається переважно з середніх шипуватих нейронів, проєкційних нейронів, які мають два основних фенотипи: «непрямі» з рецепторами D2-типу, і «прямі», з рецепторами D1-типу.[2][3]
Основа базальних гангліїв — це смугасте тіло разом з ділянками, з якими воно безпосередньо проєкційно пов'язане через стріато-палідонігральні пучки — щільні, зі слабкомієлінізованими аксонами, що додає їм білуватого забарвлення. Ця проєкція складається з покришкової та медулярної частин блідої кулі а також pars compacta і pars reticulata чорної субстанції. Нейрони цієї ділянки гальмуються ГАМК-ергічними синапсами від дорсального стріатума. З них лише бліда куля не посилає аксони за межі системи. Інші шлють аксони до верхніх горбків чотиригорбкового тіла, до додаткової моторної області, до передніх ядер таламуса, а звідти —в фронтальну ділянку кори.
Функція
Існують деякі відмінності в поглядах на функціонування смугастого тіла у дослідників, враховуючи різнорідність його елементів та участь їх у різних функціональних підсистемах.
У вентральному стріатумі і прилеглому ядрі зокрема, насамперед, модерується когнітивна функція системи винагороди (англ. reward cognition), підкріплення, мотиваційної значущості, в той час як дорзальний стріатум, у першу чергу, регулює пізнавальну рухову функцію, виконавчу функцію, і стимул-відповідь навчання;[2][15][3][16] і лише незначним чином їхні функції перекриваються — у дорсальному стріатумі теж є компонент системи винагороди, що разом із з прилеглим ядром, опосередковує кодування нових рухових програм, пов'язаних з майбутньою нагородою.[15][16]
Метаботропні рецептори дофаміну присутні як на шипах нейронів, так і на кіркових аксонових терминалях[17][18] У людини смугасте тіло активується стимулами, пов'язаними з системою винагороди, а також із неприязню, новизною,[19] несподіванками або іншими інтенсивними емоційними подразниками[20][21]
Клінічне значення
Хвороба Паркінсона
Хвороба Паркінсона призводить до втрати дофамінергічної іннервації в дорсальному стріатумі (та інших базальних гангліїях) та цілого каскаду наслідків. Атрофія стріатума також буває при хворобі Гентінгтона, хореї, атетозі, і ДЦП.[22]
Залежність
Залежність, розлад мозкової системи винагород, виникає через надекспресія з ΔFosB, а транскрипційний фактор, в D1-типі середніх шипуватих нейронів в вентральному стріатумі. ΔFosB — ген, який індукується прилеглому ядрі після високих доз наркотиків або інших сильних подразників, що можуть викликати залежність.[23][24]
Біполярний розлад
Генетичні дослідження показали зв'язок між стріарною експресією гена PDE10A й деякими біполярними розладами.[25]
Історія
У XVII і XVIII століттях термін «корпус стріатум» використовується для позначення безлічі різних глибоких підкіркових елементів. у 1941 році, Сесіль і Оскар Фогт спростили номенклатуру, запропонувавши термін «стріатум» для всіх утворень, побудованих зі стріарних елементів: хвостатого ядра, лушпини, та інших.
Термін neostriatum був запропонований порівняльними анатомами, які досліджували підкіркові структури у хребетних, і зазначили, що це дійсно філогенетично більш нової частини смугастого тіла. Термін досі використовується в деяких джерелах[26]
Додаткові зображення
- Анімоване зображення смугастого тіла
- Смугасте тіло. Пряма й бокова проєкції
Посилання
Wikiwand - on
Seamless Wikipedia browsing. On steroids.