Loading AI tools
Vikipedi'den, özgür ansiklopediden
Klor triflorür, formülü ClF3 olan interhalojen bir bileşiktir. Zehirli, aşındırıcı ve aşırı reaktiftir. Gaz hâlindeyken renksizken sıvı hâlindeyken solgun yeşilimsi sarı renktedir. Yarı iletken sanayiinde,[7] nükleer yakıtların yeniden işlenmesinde,[8] roket itici yakıtlarında ve diğer endüstriyel alanlarda kullanılır.[9] Benzen, toluen, eter, alkol, asetik asit, hekzan gibi çözücüler ile reaksiyona girer.[3] Karbon tetraklorürde çözünür ancak yüksek konsantrasyonlarda patlayıcı olabilir.
 | |
 | |
| Adlandırmalar | |
|---|---|
Trifloro-λ3-kloran[1] | |
Diğer adlar Klorotriflorür | |
| Tanımlayıcılar | |
3D model (JSmol) |
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.301 |
| EC Numarası |
|
| 1439 | |
| MeSH | chlorine+trifluoride |
PubChem CID |
|
| RTECS numarası |
|
| UNII | |
| UN numarası | 1749 |
CompTox Bilgi Panosu (EPA) |
|
| |
| |
| Özellikler | |
| Kimyasal formül | ClF3 |
| Molekül kütlesi | 92,45 g mol−1 |
| Görünüm | Renksiz gaz ya da yeşilimsi sarı sıvı |
| Yoğunluk | 3,779 g/L[2] |
| Erime noktası | -76,34 °C |
| Kaynama noktası | 11,75 °C |
| Çözünürlük (su içinde) | Su ile tepkimeye girer[3] |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Çok toksik, çok aşındırıcı, güçlü oksitleyici, şiddetli hidroliz[4] |
| GHS etiketleme sistemi: | |
| Piktogramlar |     |
| İşaret sözcüğü | Tehlike |
| NFPA 704 (yangın karosu) |
|
| Parlama noktası | alev-almaz[4] |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LC50 (medyan konsantrasyon) |
95 ppm (sıçan, 4 sa) 178 ppm (fare, 1 sa) 230 ppm (maymun, 1 sa) 299 ppm (sıçan, 1 sa) [5] |
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | C 0.1 ppm (0.4 mg/m3)[4] |
| REL (tavsiye edilen) | C 0.1 ppm (0.4 mg/m3)[4] |
| IDLH (anında tehlike) | 20 ppm[4] |
| Güvenlik bilgi formu (SDS) | |
| Termokimya[6] | |
Isı sığası (C) |
63.9 J K−1 mol−1 |
Standart molar entropi (S⦵298) |
281.6 J K−1 mol−1 |
Standart formasyon entalpisi (ΔfH⦵298) |
−163.2 kJ mol−1 |
Gibbs serbest enerjisi (ΔfG⦵) |
−123.0 kJ mol−1 |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
| Bilgi kutusu kaynakları | |
İlk olarak 1930'da Ruff ve Krug tarafından klorun florlanmasıyla hazırlandığı bildirildi; bu tepkime aynı zamanda klor monoflorür (ClF) de verdi ve karışım damıtma yoluyla ayrıldı.[10]3 F
2 + Cl
2 → 2 ClF
3
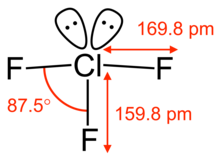
ClF3'ün moleküler geometrisi, bir kısa bağ (1,598 A) ve iki uzun bağ (1,698 A) ile yaklaşık olarak T şeklindedir.[11]
ClF3 çok güçlü bir oksitleyicidir, özellikle bir florlama maddesidir. Çoğu inorganik ve organik malzemeye karşı son derece reaktiftir ve yanıcı olmayan pek çok malzemeyi herhangi bir ateşleme kaynağı olmaksızın yakacaktır. Bu reaksiyonlar genellikle şiddetlidir ve bazı durumlarda özellikle yanıcı malzemelerle patlayıcıdır. Çelik, bakır ve nikelı tüketmez, çünkü daha fazla korozyonu önleyen bir çözünmez metal florür pasivasyon tabakası oluşacaktır, ancak molibden, tungsten ve titanyum ile oluşturdukları florürler uçucu olduğundan uygun değildir. ClF3 ile temas eden herhangi bir ekipman titizlikle temizlenmeli ve ardından pasifleştirilmelidir, çünkü kalan herhangi bir kontaminasyon florlanmamış malzemeyi yeniden oluşturabileceğinden daha hızlı yakabilir. ClF3, iridyum, platin veya altın gibi asil metalleri bile hızla aşındırarak onları klorürlere ve florürlere oksitler.
Oksijeninkini aşan bu oksitleme gücü, ClF3'ün genellikle yanmaz ve refrakter olduğu düşünülen diğer birçok malzemeyle şiddetli reaksiyona girmesine neden olur. Kumu, asbesti, camı ve hatta zaten oksijende yanmış olan maddelerin küllerini tutuşturduğu bilinmektedir. Çok bilinen bir endüstriyel kazada, 900 kg ClF3 dökülmesi 30 cm betonu ve altındaki 90 cm çakılı yaktı.[12]
ClF3 ile başa çıkabilen bilinen bir yangın kontrol/bastırma yöntemi vardır – yangını azot veya argon gibi asal gazlarla doldurmak. Bunun dışında, alan reaksiyon durana kadar soğuk tutulmalıdır.[13] Bileşik, su bazlı bastırıcılar ve CO2 ile reaksiyona girerek onları verimsiz hâle getirir.[14]
Sıvı veya gaz olarak daha büyük miktarlarda ClF3'e maruz kalmak, canlı dokuyu tutuşturarak ciddi kimyasal ve termal yanıklara neden olur. ClF3 su ile şiddetli reaksiyona girer ve reaksiyona maruz kalınması yanıklara neden olur. Hidroliz ürünleri, reaksiyonun oldukça ekzotermik yapısından dolayı genellikle buhar veya buhar olarak salınan hidroflorik asit ve hidroklorik asittir.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.