สารประกอบโคออร์ดิเนชัน
จากวิกิพีเดีย สารานุกรมเสรี
สารประกอบโคออร์ดิเนชัน (อังกฤษ: Coordination Compounds) หรือ สารเชิงซ้อนโคออร์ดิเนชัน (coordination complexes) หมายถึง สารประกอบที่ประกอบด้วย โคออร์ดิเนชันเอนทิตี (coordination entity) หรือ โคออร์ดิเนชันสเฟียร์ (coordination sphere) ซึ่ง โคออร์ดิเนชันเอนทิตี คือ ไอออนหรือโมเลกุลที่ประกอบด้วย อะตอมกลาง (central atom)(โดยปกติแล้วจะเป็นอะตอมของธาตุโลหะ) สร้างพันธะเชื่อมต่อกับอะตอมหรือกลุ่มของอะตอมรอบ ๆ แต่ละอะตอมหรือกลุ่มอะตอมดังกล่าวที่สร้างพันธะกับอะตอมกลางเรียกว่า ลิแกนด์ (ligand)[1]

ประวัติ
สรุป
มุมมอง
สารประกอบโคออร์ดิชันหลายชนิดเป็นที่รู้จักกันมาเป็นเวลานานแล้ว โดยเฉพาะสารที่มีสี เช่น คลอโรฟิลล์ (chlorophyll) ฮีโมโกลบิน (hemoglobin) วิตามินบี 12 เป็นต้น อย่างไรก็ตาม สมบัติทางเคมีและโครงสร้างของสารประกอบกลุ่มนี้ยังไม่เป็นที่เข้าใจมากนัก จนกระทั่ง อัลเฟรท แวร์เนอร์ นักเคมีชาวสวิส ได้สนใจศึกษาสารประกอบของโคบอลต์ โดยในปี ค.ศ. 1983 เขาได้เสนอว่า สารประกอบของโคบอลต์ (III) ที่มี 6 ลิแกนด์มีรูปร่างทางเรขาคณิตของโมเลกุล (molecular geometry) เป็นทรงแปดหน้า (octahedral)และได้เสนอแนวคิดเกี่ยวกับ เวเลนซ์ปฐมภูมิ (primary valence) และ เวเลนซ์ทุติยภูมิ (secondary valence) ของอะตอมโลหะขึ้นมา โดยต่อมาเรารู้จักกันในชื่อ สถานะออกซิเดชัน (oxidation state) หรือ เลขออกซิเดชัน (oxidation number) และ เลขโคออร์ดิเนชัน (coordination number) ตามลำดับ นอกจากนี้ เขายังได้ศึกษาสมบัติเชิงแสง (optical properties) และสมบัติการนำไฟฟ้าของสารละลายของสารประกอบโคออร์ดิเนชัน ทำให้ทราบว่ามีไอโซเมอร์ของสารประกอบโคออร์ดิเนชันหลายชนิด[2][3] และได้รับรางวัลโนเบลสาขาเคมี ในปี ค.ศ. 1917 และเป็นนักเคมีสาขาเคมีอนินทรีย์คนแรกที่ได้รับรางวัลนี้
ปัจจุบัน วิชาเคมีที่ศึกษาเกี่ยวกับสารประกอบโคออร์ดิเนชัน เรียกว่า เคมีโคออร์ดิเนชัน (coordination chemistry) ซึ่งได้แตกแขนงออกเป็นสาขาวิชาย่อยมากมาย เช่น เคมีของสารประกอบโลหอินทรีย์ (organometallic chemistry) เคมีซุปราโมเลกุลาร์ (supramolecular chemistry) และเป็นพื้นฐานของศาสตร์แขนงใหม่ที่เกี่ยวข้องกับการออกแบบโครงสร้างของของแข็งโดยเฉพาะสารประกอบที่เรียกว่า โคออร์ดิเนชันพอลิเมอร์ (coordination polymers) และ โครงข่ายโลหะ-สารอินทรีย์ (metal-organic frameworks) เป็นต้น

คำศัพท์ที่เกี่ยวข้อง
สรุป
มุมมอง
สารประกอบโคออร์ดิเนชันประกอบด้วย อะตอมกลาง (central atom) และ ลิแกนด์ (ligand) ที่สร้าง พันธะโคออร์ดิเนตโคเวเลนต์ (coordinate covalent bond) ผ่านอะตอมที่เป็นส่วนหนึ่งของลิแกนด์โดยเรียกอะตอมที่สร้างพันธะกับอะตอมกลางว่า อะตอมผู้ให้ (donor atom) จำนวนอะตอมผู้ให้ที่สร้าง พันธะซิกมา (sigma bond) กับอะตอมกลางเรียกว่า เลขโคออร์ดิเนชัน (coordination number)[4]
การเรียกชื่อกลุ่มของลิแกนด์จำแนกตามลักษณะการสร้างพันธะกับอะตอมกลางเป็น ดังนี้
- ลิแกนด์ที่มีจำนวนอะตอมผู้ให้ 1 อะตอม เรียกว่า ยูนิเดนเทต (unidentate) ลิแกนด์ หรือ มอนอเดนเทต (monodentate) ลิแกนด์
- ลิแกนด์ที่มีจำนวนอะตอมผู้ให้ 2 อะตอม เรียกว่า ไบเดนเทต (bidentate) ลิแกนด์ หรือ ไดเดนเทต (didentate) ลิแกนด์
- ลิแกนด์ที่มีจำนวนอะตอมผู้ให้ 3 อะตอม เรียกว่า ไตรเดนเทต (tridentate) ลิแกนด์
- ลิแกนด์ที่มีจำนวนอะตอมผู้ให้ 4 อะตอม เรียกว่า ควอดิเดนเทต (quadidentate) ลิแกนด์ หรือ เตตระเดนเทต (tetradentate) ลิแกนด์
- ลิแกนด์ที่มีจำนวนอะตอมผู้ให้ 5 อะตอม เรียกว่า เพนตะเดนเทต (pentadentate) ลิแกนด์
- ลิแกนด์ที่มีจำนวนอะตอมผู้ให้หลายอะตอม เรียกโดยรวมว่า มัลติเดนเทต (multidentate) ลิแกนด์ หรือ พอลิเดนเทต (polydentate) ลิแกนด์
- พอลิเดนเทตลิแกนด์ที่สร้างพันธะกับโลหะแล้วทำให้เกิด วงแหวน (ring)ลักษณะดังรูป 3 หรือลิแกนด์มีการสร้างพันธะครอบอะตอมกลางคล้ายก้ามปู จะเรียกลิแกนด์นั้นว่าเป็น คีเลติง (chelating) ลิแกนด์
- มอนอเดนเทตลิแกนด์ที่มีอะตอมผู้ให้มากกว่า 1 ชนิดโดยสามารถใช้อะตอมใดอะตอมหนึ่งสร้างพันธะกับอะตอมกลางได้ เรียกว่า แอมบิเดนเทต (ambidentate) ลิแกนด์ เช่น NSC- ใน M-NCS ซึ่งแตกต่างจาก NCS-M [5]
อะตอมกลางและลิแกนด์ เรียกรวมกันว่า โคออร์ดิเนชันสเฟียร์ (coordination sphere) หรือ โคออร์ดิเนชันเอนทิตี (coordination entity) หากโคออร์ดิเนชันเอนทิตีมีประจุ จะเรียกว่า ไอออนเชิงซ้อน (complex ion) และสารประกอบซึ่งเป็นกลางทางไฟฟ้าหากประกอบด้วยไอออนเชิงซ้อนหรือโคออร์ดิเนชันเอนทิตีที่เป็นกลางทางไฟฟ้าแล้ว จะเรียกว่า สารเชิงซ้อน (complex) หรือ สารประกอบโคออร์ดิเนชัน
สารประกอบโคออร์ดิเนชันที่มีอะตอมผู้ให้เป็นคาร์บอน หรือมีพันธะโลหะ–คาร์บอน (M–C bond) จะเรียกว่า สารประกอบโลหอินทรีย์ (organometallics compounds) [6]
โครงสร้าง
สรุป
มุมมอง
พันธะเคมี
พันธะที่เกิดขึ้นระหว่างอะตอมกลางและอะตอมผู้ให้เป็นพันธะโคออร์ดิเนตโคเวเลนต์ หรือพันธะเดทีฟ (Dative bond) ที่เกิดจากอะตอมผู้ให้มีการใช้อิเล็กตรอนคู่โดดเดี่ยว (lone pair) หรือคู่อิเล็กตรอน (electron pair) ในการสร้างพันธะ โดยให้ (donate) คู่อิเล็กตรอนแก่อะตอมกลาง หรือเรียกว่า อะตอมผู้ให้ โคออร์ดิเนต (coordinate)กับอะตอมกลาง กรณีที่คีเลติงลิแกนด์สร้างพันธะกับอะตอมกลาง เราอาจะเรียกได้ว่า อะตอมกลางถูก คีเลต (chelate) โดยลิแกนด์

อย่างไรก็ตาม การอธิบายพันธะเคมีของสารประกอบโคออร์ดิเนชันให้สอดคล้องกับสมบัติทางกายภาพ เช่น สมบัติเชิงแสง สีของสารประกอบ สมบัติแม่เหล็ก ได้มีการเสนอแนวคิดและทฤษฎีขึ้นหลายทฤษฎี เช่น
- ทฤษฎีสนามผลึก (crystal field theory)
- ทฤษฏีพันธะเวเลนซ์ (valence bond theory)
- ทฤษฎีออร์บิทัลเชิงโมเลกุล (molecular orbital theory)
- ทฤษฏีสนามลิแกนด์ (ligand field theory)
กรด−เบสลิวอิส
เนื่องจากการเกิดพันธะโคออร์ดิเนตโคเวเลนต์เกี่ยวข้องการให้−รับคู่อิเล็กตรอน โดยลิแกนด์เป็นตัวให้คู่อิเล็กตรอนแก่อะตอมกลางจึงจัดเป็นเบสตามนิยามของลิวอิสหรือ เบสลิวอิส (Lewis base) ส่วนอะตอมกลางซึ่งรับอิเล็กตรอนมาจากลิแกนด์จึงเป็นกรดตามนิยามของลิวอิส หรือ กรดลิวอิส (Lewis acid)โดยสารประกอบที่เกิดขึ้นเรียกว่า แอดดักต์ (adduct) ตัวอย่างต่อไปนี้เป็นสารประกอบโคออร์ดิเนชันหรือแอดดักต์ที่เกิดจากแอมโมเนียให้อิเล็กตรอนคู่โดดเดี่ยว (เบสลิวอิส) แก่อะตอมโบรอนในโมเลกุลโบรอนไตรฟลูออไรด์ (กรดลิวอิส) เกิดเป็นแอดดักต์ H3N—BF3
รูปทรงเรขาคณิต
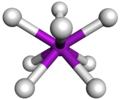
การแสดงโครงสร้างของโมเลกุลสารประกอบโคออร์ดิเนชันสามารถแสดงได้ด้วยรูปทรงเรขาคณิต โดยเป็นการแสดงสิ่งแวดล้อมรอบๆอะตอมกลาง โดยรูปทรงเรขาคณิตของโมเลกุลจะถูกกำหนดโดยสมบัติทางเคมีโคออร์ดิเนชันของอะตอมกลาง เช่น โคบอลต์มักจะมีเลขโคออร์ดิเนชันเท่ากับ 4 และ 6 โดยมีรูปทรงเรขาคณิตเป็นทรงสี่หน้าและทรงแปดหน้าตามลำดับ ในขณะที่นิกเกิลที่มีเลขโคออร์ดิเนชันเท่ากับ 4 จะมีรูปทรงเรขาคณิตเป็นระนาบจัตุรัส
- เส้นตรง (linear)เช่น [CuCl2]–, [Ag(NH3)2]+
- สามเหลี่ยมแบนราบ (trigonal planar)เช่น [HgI3]−
- ระนาบจัตุรัส (square planar)เช่น [AuCl4]–, [PtCl4]2–
- Fe(CO)5]
- พีระมิดฐานจัตุรัส (square pyramidal) เช่น [NbCl4(O)]–, [V(acac)2(O)]
- รูปทรงแปดหน้า (octahedral)เช่น [Cr(H2O)6]3+, [Fe(CN)6]3–
- ปริซึมสามเหลี่ยม (prismic trigonal) เช่น Mo(SCHCHS)3
- พีระมิดคู่ฐานห้าเหลี่ยม (pentagonal bipyramidal)เช่น [Nb(O)(ox)3]3–
- แอนติปริซึมจัตุรัส (square antiprism) เช่น [Mo(CN)8]4–, [ReF8]2–
การอ่านชื่อตามระบบ IUPAC
สรุป
มุมมอง
การอ่านชื่อสารประกอบโคออร์ดิเนชันตามระบบ IUPAC ได้ถูกกำหนดใว้ใน NOMENCLATURE OF INORGANIC CHEMISTRY (IUPAC Recommendations 2005)[7] โดยสรุปได้ ดังนี้
- ให้อ่านชื่อลิแกนด์ก่อนชื่อของอะตอมกลาง
- ไม่มีช่องว่างระหว่างแต่ละส่วนภายในเอกลักษณ์โคออร์ดิเนชันเดียวกัน
- ให้ชื่อของลิแกนด์เรียงตามลำดับอักษร (คำนำหน้า (prefix) ที่ใช้ระบุจำนวนลิแกนด์จะไม่นำมาพิจารณาลำดับอักษรด้วย)
- IUPAC ไม่เห็นด้วยในการใช้อักษรย่อในชื่อ[8]
- ชื่อลิแกนด์ที่มีประจุลบให้เปลี่ยนชื่อลงท้ายเป็นโดยให้ตัด -e แล้วเปลี่ยนเป็นเสียง -o [9] เช่น sulphate เปลี่ยนเป็น sulphato, cyanide เปลี่ยนเป็น cyanido, chloride เปลี่ยนเป็น chlorido หรือ iodide เปลี่ยนเป็น iodido เป็นต้น
- ลิแกนด์บางชนิดมีชื่อเฉพาะ เช่น แอมโมเนีย (ammonia) NH3 เมื่อเป็นลิแกนด์จะเรียกว่า แอมมีน (ammine) น้ำ H2O เมื่อเป็นลิแกนด์จะเรียกว่า อะควา (aqua)เป็นต้น
- ให้ใช้เลขฮินดูอารบิกในการบอกประจุของไอออนเชิงซ้อน [10]
อย่างไรก็ตาม ข้อเสนอใหม่ของ IUPAC ยังไม่เป็นที่นิยมมากนัก นักเคมีจึงนิยมอ่านชื่อตามข้อกำหนดเดิม เช่น ชื่อลิแกนด์ยังคงเปลี่ยนชื่อท้ายเป็นเสียง -o โดยตัด -ide เป็น -o เช่น cyanide เปลี่ยนเป็น cyano, chloride เปลี่ยนเป็น chloro หรือ iodide เปลี่ยนเป็น iodo เป็นต้น และมีการระบุสถานะออกซิเดชันของอะตอมกลางด้วยตัวเลขโรมัน

ตัวอย่าง:
- [CoCl(NH3)5]Cl2
- IUPAC อ่านชื่อว่า pentaamminechloridocobalt(2+) chloride
- ข้อกำหนดเดิม อ่านชื่อว่า pentaamminechlorocobalt(III) chloride
- [AuF4]-
- IUPAC อ่านชื่อว่า tetrafluoridoaurate(1-)
- ข้อกำหนดเดิม อ่านชื่อว่า tetrafluoroaurate(III)
- K4[Fe(CN)6]
- IUPAC อ่านชื่อว่า potassium hexacyanidoferrate(II)
- หรือ potassium hexacyanidoferrate(4-)
- หรือ tetrapotassium hexacyanidoferrate
- ข้อกำหนดเดิม อ่านชื่อว่า potassium hexacyanoferrate(II)
อนึ่ง สารประกอบโลหอินทรีย์จะมีวิธีการอ่านชื่อที่แตกต่างออกไป
ประโยชน์
สารประกอบโคออร์ดิเนชันมีประโยชน์มากมาย เช่น
การสกัดแร่ทองคำ
- การสกัดทองคำจากแร่ โดยใช้ปฏิกิริยาการเกิดสารประกอบโคออร์ดิเนชันกับไซยาไนด์ หรือปฏิกิริยาไซยานิเดชัน (cyanidation reaction) ดังนี้
- 4 Au + 8 NaCN + O2 + 2 H2O → 4 Na[Au(CN)2] + 4 NaOH [11]
ตัวเร่งปฏิกิริยา
- สารประกอบโคออร์ดิเนชันหลายชนิดเป็นตัวเร่งปฏิกิริยา (catalyst) เช่น สารประกอบโคออร์ดิเนชันของโรเดียม HRh(CO)(PPh3)2 และ Rh(acac)(CO)2 ใช้เป็นตัวเร่งปฏิกิริยาไฮโดรฟอมิเลชันของ 2-ออกทีน
ยารักษาโรค
- สารประกอบโคออร์ดิเนชันหลายชนิดมีฤทธิ์ทางชีวภาพซึ่งสามารถนำมาใช้ประโยชน์ในทางการแพทย์ได้ เช่น ออกซาลิพลาติน (oxaliplatin) ใช้ในเคมีบำบัด (chemotherapy) ในการรักษาโรคมะเร็ง [12] เป็นต้น
ดูเพิ่ม
อ้างอิง
Wikiwand - on
Seamless Wikipedia browsing. On steroids.