Loading AI tools
หน่วยพื้นฐานของสสาร จากวิกิพีเดีย สารานุกรมเสรี
อะตอม หรือเดิมเรียก ปรมาณู[1] (อังกฤษ: atom; กรีก: άτομον) เป็นหน่วยพื้นฐานของสสาร ประกอบด้วยส่วนของนิวเคลียสที่หนาแน่นมากอยู่ตรงศูนย์กลาง ล้อมรอบด้วยกลุ่มหมอกของอิเล็กตรอนที่มีประจุลบ นิวเคลียสของอะตอมประกอบด้วยโปรตอนที่มีประจุบวกกับนิวตรอนซึ่งเป็นกลางทางไฟฟ้า (ยกเว้นในกรณีของ ไฮโดรเจน-1 ซึ่งเป็นนิวไคลด์เสถียรชนิดเดียวที่ไม่มีนิวตรอน) อิเล็กตรอนของอะตอมถูกดึงดูดอยู่กับนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า ในทำนองเดียวกัน กลุ่มของอะตอมสามารถดึงดูดกันและกันก่อตัวเป็นโมเลกุลได้ อะตอมที่มีจำนวนโปรตอนและอิเล็กตรอนเท่ากันจะมีสภาพเป็นกลางทางไฟฟ้า มิฉะนั้นแล้วมันอาจมีประจุเป็นบวก (เพราะขาดอิเล็กตรอน) หรือลบ (เพราะมีอิเล็กตรอนเกิน) ซึ่งเรียกว่า ไอออน เราจัดประเภทของอะตอมด้วยจำนวนโปรตอนและนิวตรอนที่อยู่ในนิวเคลียส จำนวนโปรตอนเป็นตัวบ่งบอกชนิดของธาตุเคมี และจำนวนนิวตรอนบ่งบอกชนิดไอโซโทปของธาตุนั้น[2]
| อะตอม | |
|---|---|
 ภาพวาดอะตอมของฮีเลียม แสดงให้เห็นนิวเคลียส (จุดสีชมพู) และการกระจายตัวของเมฆอิเล็กตรอน (สีดำ) นิวเคลียสของฮีเลียม-4 (บนขวา) ในความเป็นจริงมีลักษณะเป็นทรงกลมที่สมมาตรและคล้ายกับเมฆอิเล็กตรอนมาก แต่ไม่จำเป็นเสมอไปสำหรับนิวเคลียสอื่น ๆ ที่ซับซ้อนกว่านี้ แถบสีดำด้านซ้ายล่างแสดงความยาวหนึ่งอังสตรอม (10−10 m หรือ 100 pm) | |
| ประเภท | |
| การแบ่งส่วนที่ถือว่าเล็กที่สุดของธาตุเคมี | |
| คุณสมบัติ | |
| พิสัยมวล | 1.67×10−27 ถึง 4.52×10−25 kg |
| ประจุไฟฟ้า | ศูนย์ (เป็นกลาง), หรือมีประจุไอออน |
| พิสัยเส้นผ่านศูนย์กลาง | ตั้งแต่ 62 pm (He) ถึง 520 pm (Cs) (หน้าข้อมูล) |
| องค์ประกอบ | อิเล็กตรอน และนิวเคลียสที่มีโปรตอนกับนิวตรอนอัดกันแน่น |
ตามความเข้าใจในปัจจุบัน อะตอมเป็นวัตถุขนาดเล็กที่มีมวลน้อยมาก เราสามารถสังเกตการณ์อะตอมเดี่ยว ๆ ได้โดยอาศัยเครื่องมือพิเศษ เช่น กล้องจุลทรรศน์แบบส่องกราดในอุโมงค์ มวลประมาณ 99.9% ของอะตอมกระจุกรวมกันอยู่ในนิวเคลียส[note 1] โดยมีโปรตอนและนิวตรอนเป็นมวลที่เหลือประมาณเท่า ๆ กัน อิเล็กตรอนที่โคจรรอบอะตอมจะมีระดับพลังงานที่เสถียรอยู่จำนวนหนึ่งในลักษณะของวงโคจรอะตอม และสามารถเปลี่ยนแปลงระดับไปมาระหว่างกันได้โดยการดูดซับหรือปลดปล่อยโฟตอนที่สอดคล้องกับระดับพลังงานที่ต่างกัน อิเล็กตรอนเหล่านี้เป็นตัวกำหนดคุณสมบัติทางเคมีของธาตุ และมีอิทธิพลอย่างมากต่อคุณสมบัติทางแม่เหล็กของอะตอม อิเล็กตรอนของอะตอมถูกดึงดูดกับโปรตอนในนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า โปรตอนและนิวตรอนในนิวเคลียสถูกดูดเข้าหากันด้วยแรงนิวเคลียร์ ปกติแรงนิวเคลียร์เข้มกว่าแรงแม่เหล็กไฟฟ้า ยกเว้นในบางกรณีที่แรงแม่เหล็กไฟฟ้าเข้มกว่าแรงนิวเคลียร์ ซึ่งจะทำให้เกิดการแบ่งนิวเคลียสและเกิดเป็นธาตุใหม่ เรียกว่า การสลายของนิวเคลียส
จำนวนโปรตอนในนิวเคลียสเป็นเลขอะตอม และเป็นตัวนิยามธาตุ ตัวอย่างเช่น อะตอมที่มีโปรตอน 29 ตัวจะเป็นธาตุทองแดง จำนวนนิวตรอนเป็นตัวระบุไอโซโทปของธาตุ อะตอมสามารถดึงดูดอะตอมอื่นตั้งแต่หนึ่งอะตอมขึ้นไปเกิดพันธะเคมีเป็นสารประกอบเคมีเช่น โมเลกุลหรือผลึก (crystal) การรวมตัวและแยกอะตอมนี้เป็นตัวการของการเปลี่ยนแปลงเชิงกายภาพที่สังเกตได้ในธรรมชาติ วิชาที่ศึกษาเรียก เคมี
"อะตอม" มาจากภาษากรีกว่า ἄτομος/átomos, α-τεμνω ซึ่งหมายความว่า "ไม่สามารถตัดแบ่งให้เล็กลงไปได้อีก" (แต่เดิมจึงถูกเรียกในภาษาไทยว่า ปรมาณู) หลักการของอะตอมในฐานะส่วนประกอบที่เล็กที่สุดของสสารที่ไม่สามารถแบ่งได้อีกต่อไป ถูกเสนอขึ้นครั้งแรกโดยนักปรัชญาชาวอินเดียและนักปรัชญาชาวกรีก ซึ่งจะตรงกันข้ามกับปรัชญาอีกสายหนึ่งที่เชื่อว่าสสารสามารถแบ่งแยกได้ไปเรื่อย ๆ โดยไม่มีสิ้นสุด (คล้ายกับปัญหา discrete หรือ continuum) ในคริสต์ศตวรรษที่ 17-18 นักเคมีเริ่มวางแนวคิดทางกายภาพจากหลักการนี้โดยแสดงให้เห็นว่าวัตถุหนึ่ง ๆ ควรจะประกอบด้วยอนุภาคพื้นฐานที่ไม่สามารถแบ่งแยกได้อีกต่อไป ระหว่างช่วงปลายคริสต์ศตวรรษที่ 19 และต้นคริสต์ศตวรรษที่ 20 นักฟิสิกส์ค้นพบส่วนประกอบย่อยของอะตอมและโครงสร้างภายในของอะตอม ซึ่งเป็นการแสดงว่า "อะตอม" ที่ค้นพบตั้งแต่แรกยังสามารถแบ่งแยกได้อีก และไม่ใช่ "อะตอม" ในความหมายที่ตั้งมาแต่แรก กลศาสตร์ควอนตัมเป็นทฤษฎีที่สามารถนำมาใช้สร้างแบบจำลองทางคณิตศาสตร์ของอะตอมได้เป็นผลสำเร็จ[3][4]

ไม่มีความก้าวหน้าในการทำความเข้าใจกับอะตอมเพิ่มมากขึ้นนักจนกระทั่งศาสตร์ทางด้านเคมีเริ่มพัฒนาขึ้น ในปี ค.ศ. 1661 นักปรัชญาธรรมชาติ โรเบิร์ต บอยล์ เผยแพร่งานเขียนเรื่อง The Sceptical Chymist ซึ่งเขาเห็นว่าสสารประกอบขึ้นจากส่วนประกอบหลากหลายระหว่าง "corpuscules" หรืออะตอมที่แตกต่างกัน ซึ่งต่างไปจากธาตุพื้นฐานทั้งสี่คือ อากาศ ดิน ไฟ และน้ำ[5] ปี ค.ศ. 1789 ขุนนางชาวฝรั่งเศสและนักวิจัยทางวิทยาศาสตร์ อองตวน ลาวัวซิเยร์ กำหนดคำว่า ธาตุ (element) เพื่อใช้ในความหมายถึงสสารพื้นฐานที่ไม่สามารถแบ่งแยกด้วยกระบวนการทางเคมีต่อไปได้อีก[6]
ปี ค.ศ. 1803 อาจารย์ชาวอังกฤษและนักปรัชญาธรรมชาติ จอห์น ดอลตัน (John Dalton) ใช้แนวคิดของอะตอมมาอธิบายว่าทำไมธาตุต่าง ๆ จึงมีปฏิกิริยาเป็นสัดส่วนของจำนวนเต็มเล็กที่สุดเสมอ คือ กฎสัดส่วนพหุคูณ (law of multiple proportion) และทำไมก๊าซบางชนิดจึงสลายตัวในน้ำได้ดีกว่าสารละลายอื่น เขาเสนอว่าธาตุแต่ละชนิดประกอบด้วยอะตอมชนิดเดียวกันที่ไม่เหมือนใคร และอะตอมเหล่านี้สามารถรวมตัวเข้าด้วยกันได้กลายเป็นสารประกอบทางเคมี[7][8] สิ่งที่ดอลตันกำลังคำนึงถึงนี้เป็นจุดกำเนิดแรกเริ่มของทฤษฎีอะตอมยุคใหม่[9]
ทฤษฎีเกี่ยวกับอนุภาคอีกทฤษฎีหนึ่ง (ซึ่งเป็นส่วนขยายของทฤษฎีอะตอมด้วย) เกิดขึ้นในปี ค.ศ. 1827 เมื่อนักพฤกษศาสตร์ โรเบิร์ต บราวน์ ใช้กล้องจุลทรรศน์ส่องดูเศษฝุ่นของเมล็ดข้าวที่ลอยอยู่ในน้ำ และพบว่ามันเคลื่อนที่ไปแบบกระจัดกระจายไม่แน่นอน นี่เป็นปรากฏการณ์ที่ต่อมารู้จักกันในชื่อ การเคลื่อนที่แบบบราวน์ ปี ค.ศ. 1877 J. Desaulx เสนอว่าปรากฏการณ์นี้มีสาเหตุมาจากการเคลื่อนของความร้อนในโมเลกุลน้ำ และในปี ค.ศ. 1905 อัลเบิร์ต ไอน์สไตน์ ได้คิดค้นการวิเคราะห์ทางคณิตศาสตร์เกี่ยวกับการเคลื่อนที่ขึ้นได้เป็นครั้งแรก[10][11][12] นักฟิสิกส์ชาวฝรั่งเศส ฌอง แปร์แรง ใช้งานของไอน์สไตน์เพื่อทำการทดลองระบุมวลและขนาดของอะตอม ซึ่งในเวลาต่อมาได้พิสูจน์ทฤษฎีอะตอมของดอลตัน[13]
ปี ค.ศ. 1869 ดมีตรี เมนเดเลเยฟ อาศัยการค้นพบของนักวิทยาศาสตร์ยุคก่อนหน้าเช่นลาวัวซิเยร์ คิดค้นและเผยแพร่ตารางธาตุขึ้นเป็นครั้งแรก[14] ตารางนี้ใช้เป็นตัวแทนถึงกฎการวนซ้ำ ซึ่งแสดงให้เห็นถึงคุณสมบัติทางเคมีเฉพาะตัวของธาตุ ซึ่งจะ วนซ้ำเป็นรอบ ๆ ตามหมายเลขอะตอม
เจ. เจ. ทอมสัน นักฟิสิกส์ ค้นพบอิเล็กตรอนจากการศึกษารังสีแคโธดเมื่อปี ค.ศ. 1897 และสรุปว่ามันเป็นส่วนประกอบอยู่ในอะตอมทุกตัว ซึ่งเป็นการล้มล้างความเชื่อที่ว่าอะตอมนั้นเป็นอนุภาคเล็กที่สุดของสสารไม่สามารถแบ่งแยกได้[15] ทอมสันแสดงหลักฐานว่า อิเล็กตรอนซึ่งมีประจุลบและมีมวลต่ำมากนี้กระจัดกระจายอยู่ทั่วไปในอะตอม เป็นไปได้ว่าอาจหมุนวนรอบ ๆ อะตอมเหมือนวงแหวน โดยมีประจุที่สมดุลจากการลอยตัวอยู่ในทะเลอนุภาคประจุบวกอันสม่ำเสมอ ในเวลาต่อมาแนวคิดนี้รู้จักกันในชื่อ แบบจำลองอะตอมของทอมสัน (plum-pudding model)
ปี ค.ศ. 1909 ฮันส์ ไกเกอร์ และ เออร์เนสต์ มาร์สเดน ภายใต้การแนะนำของนักฟิสิกส์ เออร์เนสต์ รัทเทอร์ฟอร์ด ทำการทดลองด้วยการยิงรังสีอัลฟาใส่แผ่นทองคำ ซึ่งเป็นที่รู้กันว่ามีอะตอมฮีเลียมประจุบวก แล้วค้นพบว่าอนุภาคมีการหักเหไปเล็กน้อยเมื่อเทียบกับมุมหักเหที่ควรจะเป็นตามที่บทความของทอมสันเคยทำนายเอาไว้ รัทเทอร์ฟอร์ดตีความการทดลองนี้ว่าเป็นการบ่งชี้ถึงประจุบวกในอะตอมหนักของทองคำ และมวลส่วนมากของมันรวมตัวกันอยู่ที่นิวเคลียสซึ่งอยู่บริเวณศูนย์กลางของอะตอม เรียกชื่อแนวคิดนี้ว่า แบบจำลองรัทเทอร์ฟอร์ด[16]
ปี ค.ศ. 1913 ขณะที่นักเคมีรังสี เฟรเดอริค ซอดดี ทำการทดลองกับผลที่ได้จากการสลายตัวของสารกัมมันตรังสี เขาค้นพบว่าดูเหมือนจะมีชนิดของอะตอมมากกว่าหนึ่งชนิดในแต่ละตำแหน่งของตารางธาตุ[17] มาร์กาเร็ต ท็อดด์ ตั้งชื่อคำว่า ไอโซโทป ขึ้นเพื่อใช้ในความหมายถึงอะตอมที่แตกต่างกันแต่เป็นอะตอมของธาตุเดียวกัน เจ.เจ. ทอมสัน สร้างเทคนิคในการแบ่งแยกประเภทของอะตอมจากงานเกี่ยวกับแก๊สที่แตกตัวเป็นประจุ ซึ่งต่อมาได้นำไปสู่การค้นพบไอโซโทปเสถียร[18]

ขณะเดียวกันในปี ค.ศ. 1913 นักฟิสิกส์ นีลส์ บอร์ เสนอรูปแบบของอิเล็กตรอนที่เฉพาะเจาะจงมากขึ้น เขากล่าวว่ามันมีวงโคจรหลายระดับแตกต่างกัน และสามารถกระโดดไปมาระหว่างระดับวงโคจรต่าง ๆ ได้ แต่ไม่สามารถหมุนเป็นเกลียวเข้าออกตามใจชอบระหว่างทางได้[19] อิเล็กตรอนตัวหนึ่ง ๆ จะต้องดูดซับหรือแผ่พลังงานปริมาณจำเพาะเจาะจงขนาดหนึ่งออกมาเพื่อเปลี่ยนระดับวงโคจรที่มีกำหนดตายตัวอยู่แล้ว เมื่อแสงจากวัตถุที่ร้อนจัดวิ่งผ่านปริซึม มันจะสร้างสเปกตรัมหลากสีขึ้น การปรากฏของระดับพลังงานต่าง ๆ ที่กำหนดตายตัวได้รับการอธิบายอย่างสมบูรณ์จากการเปลี่ยนระดับวงโคจรนี้[20]
กิลเบิร์ต นิวตัน ลูอิส สามารถอธิบายถึงพันธะเคมีระหว่างอะตอมได้ในปี ค.ศ. 1916 ว่าเป็นปฏิกิริยาระหว่างอิเล็กตรอนที่เป็นส่วนประกอบภายใน[21] ดังที่คุณสมบัติทางเคมีของธาตุเป็นที่ทราบกันดีอยู่แล้วตามที่ปรากฏในตารางธาตุ[22] ปี ค.ศ. 1919 นักเคมีชาวอเมริกัน เออร์วิง แลงมิวร์ เสนอวิธีการอธิบายว่า ถ้าอิเล็กตรอนในอะตอมเชื่อมต่อกันหรือจับกลุ่มกันในลักษณะบางอย่าง กลุ่มของอิเล็กตรอนน่าจะรวมกันเป็นชั้นพลังงานของอิเล็กตรอนรอบ ๆ นิวเคลียส[23]
ปี ค.ศ. 1918 รัทเทอร์ฟอร์ดค้นพบว่าประจุบวกภายในอะตอมแต่ละตัวจะมีจำนวนเท่ากับเลขจำนวนเต็มบวกของนิวเคลียสไฮโดรเจนเสมอ เขาลงความเห็นว่าภายในนิวเคลียสมีอนุภาคประจุบวกอยู่เรียกว่า โปรตอน อย่างไรก็ดี มวลของนิวเคลียสมักจะมากกว่าเลขเหล่านี้ ทำให้คาดการณ์กันว่ามวลส่วนที่เกินไปนั้นน่าจะเป็นของอนุภาคที่มีประจุเป็นกลาง (คือ นิวตรอน)
การทดลองของสเติร์น-เกอร์แลค ในปี ค.ศ. 1922 ทำให้เรามีหลักฐานเกี่ยวกับลักษณะความเป็นควอนตัมของอะตอม เมื่อลำอนุภาคอะตอมของเงินวิ่งผ่านสนามแม่เหล็กที่มีรูปร่างเฉพาะอย่างหนึ่ง ลำอนุภาคนั้นจะแยกออกไปในทิศทางของโมเมนตัมเชิงมุมของอะตอม หรือตามสปิน เนื่องจากทิศทางนี้เกิดขึ้นแบบสุ่ม จึงคาดการณ์ว่าลำอนุภาคจะแยกออกเป็นเส้น ทว่าลำอนุภาคกลับแยกออกเป็นสองส่วนเท่านั้นตามทิศทางสปินของอะตอมว่าเป็นแบบขึ้นหรือแบบลง[24]
ปี ค.ศ. 1924 หลุยส์ เดอ บรอย เสนอแนวคิดว่าอนุภาคทุกชนิดมีพฤติกรรมเหมือนคลื่น ปี ค.ศ. 1926 แอร์วิน ชเรอดิงเงอร์ใช้แนวคิดนี้พัฒนาแบบจำลองทางคณิตศาสตร์ของอะตอมที่อธิบายอิเล็กตรอนในลักษณะของรูปคลื่นสามมิติแทนที่จะเป็นอนุภาคแบบจุด ผลสืบเนื่องจากการใช้รูปคลื่นอธิบายอนุภาคคือ มันเป็นไปไม่ได้ในทางคณิตศาสตร์ที่จะทราบค่าที่แน่นอนทั้งตำแหน่งและโมเมนตัมของอนุภาคในเวลาเดียวกัน ในเวลาต่อมาแนวคิดนี้เป็นที่รู้จักในชื่อ หลักแห่งความไม่แน่นอน ซึ่งเรียบเรียงขึ้นโดย แวร์เนอร์ ไฮเซนแบร์ก ในปี ค.ศ. 1926 จากหลักการนี้ ถ้ากำหนดตำแหน่งที่แน่นอนของอนุภาคแล้วจะสามารถทราบเพียงขอบเขตที่เป็นไปได้ของโมเมนตัม ในทำนองกลับกันก็เช่นเดียวกัน แบบจำลองนี้สามารถใช้อธิบายผลสังเกตการณ์พฤติกรรมของอะตอมแบบที่แบบจำลองอื่น ๆ ก่อนหน้าไม่สามารถอธิบายได้ เช่นโครงสร้างของอะตอมและรูปแบบสเปกตรัมของอะตอมที่มีขนาดใหญ่กว่าไฮโดรเจน ดังนั้นแบบจำลองของอะตอมที่คล้ายคลึงกับแบบจำลองดาวเคราะห์จึงถูกละทิ้งไป หันไปใช้แบบจำลองที่อธิบายถึงโซนวงโคจรในอะตอมที่อยู่รอบ ๆ นิวเคลียสอันเป็นบริเวณที่น่าจะสังเกตพบอิเล็กตรอนมากที่สุด[25][26]
การพัฒนาของเครื่องวิเคราะห์มวล (mass spectrometer) ทำให้สามารถตรวจวัดมวลที่แน่นอนของอะตอมได้ อุปกรณ์นี้อาศัยแม่เหล็กในการเบี่ยงเบนวิถีของลำอนุภาคไอออน และตรวจวัดปริมาณการหักเหจากอัตราส่วนระหว่างมวลอะตอมกับประจุของมัน นักเคมี ฟรานซิส วิลเลียม แอสตันใช้เครื่องมือนี้เพื่อแสดงให้เห็นว่าไอโซโทปมีมวลที่ต่างออกไป มวลอะตอมของไอโซโทปเหล่านี้จะแปรค่าไปเป็นจำนวนเต็มบวก เรียกว่า กฎของเลขจำนวนเต็ม (whole number rule) [27] การอธิบายไอโซโทปที่แตกต่างเหล่านี้ต้องรอไปอีกจนกระทั่งมีการค้นพบนิวตรอน หรืออนุภาคที่มีประจุเป็นกลางซึ่งมีมวลเท่ากับโปรตอน นักฟิสิกส์ชื่อ เจมส์ แคดวิคค้นพบนิวตรอนในปี ค.ศ. 1932 จึงทำให้สามารถอธิบายไอโซโทปได้ในฐานะธาตุที่มีจำนวนโปรตอนเท่ากันแต่มีจำนวนนิวตรอนภายในนิวเคลียสที่แตกต่างออกไป[28]
ปี ค.ศ. 1938 นักเคมีชาวเยอรมัน อ็อทโท ฮาน ผู้เป็นศิษย์ของรัทเทอร์ฟอร์ด ยิงนิวตรอนใส่อะตอมยูเรเนียมด้วยสมมุติฐานจะได้ธาตุหลังยูเรเนียมออกมา แต่การทดลองทางเคมีของเขากลับให้ผลลัพธ์ออกมาเป็นแบเรียม[29] หนึ่งปีต่อมา ลีเซอ ไมท์เนอร์ กับออตโต ฟริสช์ผู้เป็นหลาน สามารถพิสูจน์ว่าผลลัพธ์ของฮานเป็นการทดลอง นิวเคลียร์ฟิชชัน เป็นครั้งแรก[30][31] ปี ค.ศ. 1944 ฮานได้รับรางวัลโนเบลสาขาเคมี แต่ไมต์เนอร์กับฟริสช์กลับไม่มีชื่อได้รับร่วมทั้งที่ฮานได้พยายามเสนอแล้ว[32]
ช่วงคริสต์ทศวรรษ 1950 มีการพัฒนาเครื่องเร่งอนุภาคและเครื่องตรวจจับอนุภาค ซึ่งทำให้นักวิทยาศาสตร์สามารถศึกษาผลกระทบจากการเคลื่อนที่ของอะตอมที่ระดับพลังงานสูง ๆ ได้[33] มีการค้นพบฮาดรอนเป็นส่วนประกอบย่อยของนิวตรอนและโปรตอน ซึ่งเป็นอนุภาคประกอบขึ้นจากชิ้นส่วนที่เล็กกว่าเรียกว่า ควาร์ก แบบจำลองมาตรฐานทางนิวเคลียร์ฟิสิกส์ได้รับการพัฒนาขึ้นจนสามารถอธิบายคุณลักษณะของนิวเคลียสได้อย่างสมบูรณ์ในรูปแบบของอนุภาคที่เล็กกว่าอะตอมและแรงต่าง ๆ ที่มีผลต่อปฏิกิริยาของอนุภาคเหล่านั้น[34]
แม้คำว่า อะตอม จะมีกำเนิดจากรากศัพท์ที่มีความหมายถึงอนุภาคที่เล็กที่สุดซึ่งไม่สามารถแบ่งได้อีกต่อไป แต่การใช้งานในทางวิทยาศาสตร์สมัยใหม่นั้น อะตอมยังประกอบด้วยอนุภาคที่เล็กกว่าอะตอมอีกมากมาย อนุภาคที่เป็นส่วนประกอบของอะตอมได้แก่ อิเล็กตรอน โปรตอน และนิวตรอน อย่างไรก็ดี อะตอมของไฮโดรเจน-1 นั้นไม่มีนิวตรอน และประจุไฮโดรเจนบวกก็ไม่มีอิเล็กตรอน
เท่าที่รู้กันในปัจจุบัน อิเล็กตรอนเป็นอนุภาคที่มีมวลน้อยที่สุดในบรรดาอนุภาคทั้งหมด (อนุภาคที่เล็กที่สุดและมีมวลน้อยที่สุดที่ทราบในปัจจุบันคือ อนุภาคควาร์ก) ประมาณ 9.11×10−31 kg โดยมีประจุไฟฟ้าลบและมีขนาดที่เล็กเกินกว่าจะวัดได้ด้วยเทคนิคเท่าที่มีอยู่[35] โปรตอนมีประจุบวก และมีมวลราว 1,836 เท่าของอิเล็กตรอน คือประมาณ 1.6726×10−27 kg แม้ว่าอาจลดลงได้จากการเปลี่ยนแปลงพลังงานยึดเหนี่ยวของโปรตอนที่มีต่ออะตอม ส่วนนิวตรอนนั้นไม่มีประจุไฟฟ้า มีมวลราว 1,839 เท่าของมวลอิเล็กตรอน[36] หรือ 1.6929×10−27 kg นิวตรอนกับโปรตอนมีขนาดพอ ๆ กันที่ประมาณ 2.5×10−15 ม. แม้ว่า 'พื้นผิว' ของอนุภาคเหล่านี้จะไม่สามารถระบุได้อย่างชัดเจนก็ตาม[37]
ในแบบจำลองมาตรฐานทางฟิสิกส์ ทั้งโปรตอนและนิวตรอนต่างประกอบด้วยอนุภาคมูลฐานเรียกว่า ควาร์ก ควาร์กเป็นหนึ่งในสองชนิดของกลุ่มอนุภาคเฟอร์มิออนซึ่งเป็นองค์ประกอบพื้นฐานของสสาร องค์ประกอบอีกตัวหนึ่งคือเลปตอน ซึ่งมีอิเล็กตรอนเป็นส่วนประกอบ ควาร์กมีอยู่ 6 ประเภท แต่ละประเภทมีประจุไฟฟ้าเป็นเศษส่วนที่แตกต่างกันคือ +2/3 หรือ −1/3 โปรตอนประกอบด้วยอัพควาร์ก 2 ตัวและดาวน์ควาร์ก 1 ตัว ขณะที่นิวตรอนประกอบด้วยอัพควาร์ก 1 ตัวและดาวน์ควาร์ก 2 ตัว ความแตกต่างนี้เป็นตัวบ่งบอกถึงความแตกต่างของมวลและประจุระหว่างอนุภาคสองชนิด ควาร์กยึดเหนี่ยวกันไว้ได้ด้วยแรงนิวเคลียร์อย่างเข้ม ซึ่งเป็นลักษณะของกลูออน กลูออนเป็นอนุภาคชนิดหนึ่งในตระกูลเกจโบซอน ซึ่งเป็นอนุภาคมูลฐานทางด้านแรงปฏิกิริยาทางฟิสิกส์[38][39]
โปรตอนกับนิวตรอนที่ยึดเหนี่ยวกันภายในอะตอมหนึ่ง ๆ จะรวมกันเป็นนิวเคลียสอะตอมขนาดเล็ก เรียกชื่อว่า นิวคลีออน รัศมีของนิวเคลียสมีค่าประมาณ fm โดยที่ A คือจำนวนนิวคลีออนรวม[40] นี่มีขนาดเล็กกว่ารัศมีของอะตอมมาก ประมาณ 105 fm นิวคลีออนยึดเหนี่ยวกันเอาไว้ด้วยแรงดึงดูดระยะใกล้ ๆ เรียกว่า แรงนิวเคลียร์ ที่ระยะห่างต่ำกว่า 2.5 fm แรงนี้จะมีพลังแรงมากกว่าแรงไฟฟ้าสถิตซึ่งทำให้ประจุโปรตอนที่เป็นบวกพยายามผลักตัวออกจากกัน[41]
อะตอมของธาตุชนิดเดียวกันจะมีจำนวนโปรตอนเท่ากัน เรียกตัวเลขนี้ว่า หมายเลขอะตอม ในธาตุชนิดหนึ่ง ๆ อาจมีจำนวนนิวตรอนที่แตกต่างกัน ซึ่งเป็นตัวกำหนดค่าไอโซโทปของธาตุนั้น ๆ จำนวนโดยรวมของโปรตอนกับนิวตรอนเป็นตัวระบุนิวไคลด์ จำนวนนิวตรอนเทียบกับโปรตอนเป็นตัวกำหนดความเสถียรของนิวเคลียส และไอโซโทปที่ทำให้เกิดการสลายตัวของสารกัมมันตรังสี[42]
นิวตรอนกับโปรตอนต่างเป็นเฟอร์มิออนเพียงแต่เป็นคนละชนิด ตามหลักการกีดกันของเพาลี คือผลจากแรงควอนตัมทำให้เฟอร์มิออน ที่เทียบเท่ากัน ไม่สามารถมีสถานะควอนตัมเดียวกันในเวลาเดียวกันได้ ดังนั้นโปรตอนทุกตัวในนิวเคลียสจึงต้องดำรงอยู่ในสถานะที่แตกต่างกันด้วยระดับพลังงานต่าง ๆ ของตัวเอง กฎเดียวกันนี้ยังใช้กับนิวตรอนทั้งหมดด้วย แต่ไม่ได้ห้ามโปรตอนกับนิวตรอนให้มีสถานะควอนตัมอันเดียวกัน[43]
มีความเป็นไปได้ที่นิวเคลียสของอะตอมที่มีหมายเลขอะตอมต่ำซึ่งมีจำนวนโปรตอนกับนิวตรอนต่างกัน จะลดสถานะพลังงานต่ำลงจากการสลายตัวของสารกัมมันตรังสี อันทำให้จำนวนโปรตอนกับนิวตรอนเกือบจะเท่ากัน ผลที่เกิดขึ้นทำให้อะตอมที่มีจำนวนโปรตอนกับนิวตรอนเกือบเท่ากันนั้นมีภาวะเสถียรขึ้นและไม่สลายตัว อย่างไรก็ดี ยิ่งหมายเลขอะตอมสูงขึ้น แรงผลักระหว่างโปรตอนก็จะยิ่งทำให้สัดส่วนนิวตรอนที่ต้องมีเพื่อรักษานิวเคลียสให้เสถียรต้องเพิ่มจำนวนมากขึ้น ทำให้แนวโน้มเปลี่ยนแปลงไป ด้วยเหตุนี้จึงไม่มีนิวเคลียสที่เสถียรซึ่งมีจำนวนโปรตอนและนิวตรอนเท่า ๆ กันที่หมายเลขอะตอมมากกว่า Z = 20 (แคลเซียม) ยิ่ง Z มีจำนวนมากขึ้นไปสู่นิวเคลียสธาตุหนัก สัดส่วนนิวตรอนต่อโปรตอนที่ต้องมีเพื่อความเสถียรจะยิ่งเพิ่มขึ้นไปที่ประมาณ 1.5[43]
จำนวนโปรตอนและนิวตรอนในนิวเคลียสอะตอมสามารถเปลี่ยนแปลงได้ แม้จะต้องใช้พลังงานสูงมากเพราะมีแรงยึดเหนี่ยวที่เข้มมาก ปฏิกิริยานิวเคลียร์ฟิวชันเกิดขึ้นเมื่ออนุภาคอะตอมหลายตัวรวมตัวกันทำให้เกิดเป็นนิวเคลียสใหม่ที่หนักกว่าเดิม เช่นจากการชนกันของนิวเคลียสสองตัว ยกตัวอย่างเช่นที่แกนกลางของดวงอาทิตย์ โปรตอนต้องการพลังงาน 3–10 keV เพื่อเอาชนะแรงยึดเหนี่ยวระหว่างกัน หรือ กำแพงคูลอมบ์ (coulomb barrier) แล้วหลอมรวมเข้าด้วยกันกลายเป็นนิวเคลียสเพียงอันเดียว[44] ส่วนปฏิกิริยานิวเคลียร์ฟิชชันจะเกิดขึ้นในทางตรงกันข้าม คือการที่นิวเคลียสหนึ่งแตกตัวออกเป็นนิวเคลียสขนาดเล็กกว่า 2 ตัว โดยมากเกิดขึ้นจากการสลายตัวของสารกัมมันตรังสี นิวเคลียสยังอาจเปลี่ยนแปลงได้จากการยิงด้วยอนุภาคขนาดเล็กพลังงานสูง หรือโฟตอน ถ้าสามารถเปลี่ยนแปลงจำนวนโปรตอนในนิวเคลียสได้ อะตอมก็จะเปลี่ยนคุณลักษณะไปเป็นธาตุชนิดอื่น[45][46]
ถ้ามวลของนิวเคลียสหลังจากเกิดปฏิกิริยาฟิวชันมีน้อยกว่าจำนวนมวลรวมของอนุภาคขณะที่ยังแยกกัน มวลที่แตกต่างกันระหว่างค่าทั้งสองอาจจะแพร่ออกไปในลักษณะของพลังงานบางอย่าง (เช่น รังสีแกมมา หรือพลังงานจลน์ของอนุภาคบีตา) ดังที่อัลเบิร์ต ไอน์สไตน์ อธิบายไว้ในสมการสมมูลระหว่างมวล-พลังงาน E = mc2 เมื่อ m คือมวลที่สูญหายไป และ c คือความเร็วแสง จำนวนที่หายไปนี้เป็นส่วนหนึ่งของพลังงานยึดเหนี่ยวของนิวเคลียสใหม่ และเป็นการสูญเสียพลังงานแบบไม่มีวิธีย้อนกลับ ซึ่งทำให้อนุภาคที่หลอมรวมกันยังคงอยู่ในสถานะที่จำเป็นต้องใช้พลังงานในระดับนั้นเพื่อแยกตัวออกจากกัน[47]
การเกิดฟิวชันของนิวเคลียสสองตัวให้กลายเป็นนิวเคลียสเดียวที่ใหญ่ขึ้น โดยที่มีหมายเลขอะตอมต่ำกว่าเหล็กและนิกเกิล หรือจำนวนนิวคลีออนรวมประมาณ 60 เรียกว่ากระบวนการคายความร้อน ซึ่งจะปลดปล่อยพลังงานออกมามากกว่าพลังงานที่ต้องใช้ในการรวมตัวกัน[48] กระบวนการปลดปล่อยพลังงานเช่นนี้เองที่ทำให้เกิดปฏิกิริยานิวเคลียร์ฟิวชันในดาวฤกษ์ซึ่งสามารถเกิดขึ้นอย่างต่อเนื่อง สำหรับนิวเคลียสธาตุหนัก พลังงานยึดเหนี่ยวต่อนิวคลีออนในนิวเคลียสเริ่มต้นลดจำนวนลง นั่นคือกระบวนการฟิวชันที่สร้างนิวเคลียสที่มีหมายเลขอะตอมสูงกว่า 26 และมวลอะตอมมากกว่า 60 เรียกว่ากระบวนการดูดความร้อน นิวเคลียสมวลมากเหล่านี้ไม่สามารถสร้างปฏิกิริยาฟิวชันต่อเนื่องที่รักษาสภาวะสมดุลอุทกสถิตของดาวฤกษ์เอาไว้ได้[43]
อิเล็กตรอนในอะตอมถูกดึงดูดเอาไว้กับโปรตอนในนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า แรงชนิดนี้ยึดเหนี่ยวอิเล็กตรอนเอาไว้ภายในหลุมพลังงานไฟฟ้าสถิตที่อยู่รอบ ๆ นิวเคลียส นั่นแสดงว่าจำเป็นต้องได้รับพลังงานจากแหล่งภายนอกเพื่อช่วยให้อิเล็กตรอนหนีออกไปได้ ยิ่งอิเล็กตรอนอยู่ใกล้กับนิวเคลียสมากเท่าใด แรงดึงดูดนี้ก็ยิ่งมากขึ้น ดังนั้นอิเล็กตรอนที่อยู่ใกล้ศูนย์กลางของหลุมพลังงานจำเป็นต้องใช้พลังงานมากกว่าเพื่อจะหนีออกมาได้
เช่นเดียวกับอนุภาคอื่น อิเล็กตรอนมีคุณสมบัติแบบทวิภาค คือเป็นทั้งอนุภาคและเป็นทั้งคลื่น เมฆอิเล็กตรอนเป็นบริเวณภายในหลุมพลังงานที่อิเล็กตรอนแต่ละตัวจะสร้างคลื่นนิ่ง 3 มิติประเภทหนึ่งขึ้น อันเป็นรูปคลื่นที่ไม่เคลื่อนที่ตามนิวเคลียส พฤติกรรมนี้ถูกกำหนดจากออร์บิทัลของอะตอม ซึ่งเป็นฟังก์ชันคณิตศาสตร์ที่แสดงคุณสมบัติความเป็นไปได้ที่อิเล็กตรอนจะปรากฏตัวขึ้นที่จุดเฉพาะหนึ่ง ๆ ขณะที่ถูกวัดตำแหน่ง[49] รอบ ๆ นิวเคลียสจะมีออร์บิทัลที่ไม่ต่อเนื่องกันล้อมรอบอยู่ในลักษณะของควอนตา ทั้งนี้เพราะรูปแบบคลื่นอื่นที่เป็นไปได้จะสลายตัวไปอย่างรวดเร็วเข้าสู่สถานะที่เสถียรมากกว่า[50] ออร์บิทัลอาจมีลักษณะวงแหวนหนึ่งวง หลายวง หรือเป็นโครงสร้างโหนดก็ได้ ซึ่งมีความแตกต่างจากออร์บิทัลอื่น ๆ ทั้งด้านขนาด รูปร่าง และศูนย์กลาง[51]
ออร์บิทัลอะตอมแต่ละแบบจะสอดคล้องกับระดับพลังงานเฉพาะของอิเล็กตรอนค่าหนึ่ง ๆ อิเล็กตรอนสามารถเปลี่ยนสถานะของมันไปยังระดับพลังงานที่สูงกว่าได้โดยการดูดซับโฟตอนที่มีพลังงานเพียงพอจะยกระดับตัวมันขึ้นไปสู่สถานะควอนตัมใหม่ ในทางกลับกัน กระบวนการปลดปล่อยรังสีด้วยตัวเองทำให้อิเล็กตรอนที่ระดับพลังงานสูงสามารถลดระดับพลังงานลงไปยังสถานะที่ต่ำกว่าได้ขณะที่แผ่พลังงานส่วนเกินออกไปเป็นโฟตอน คุณลักษณะของค่าพลังงานที่กำหนดจากสถานะควอนตัมที่แตกต่างกันนี้ เป็นสาเหตุของการเกิดเส้นสเปกตรัม[50]
ปริมาณพลังงานที่จำเป็นต้องใช้ (ทั้งแบบเพิ่มเข้าไปหรือปลดปล่อยออกมา) ในการเปลี่ยนสถานะของอิเล็กตรอนนี้น้อยกว่าพลังงานยึดเหนี่ยวของนิวคลีออนมาก เช่น จำเป็นต้องใช้พลังงานเพียง 13.6 eV เพื่อให้อิเล็กตรอนจากอะตอมของไฮโดรเจนเปลี่ยนระดับลงไปยังสถานะพื้น[52] เทียบกับพลังงาน 2.23 ล้าน eV ในการแยกนิวเคลียสของดิวเทอเรียม[53] อะตอมมีประจุเป็นกลางถ้ามันมีจำนวนโปรตอนกับอิเล็กตรอนเท่ากัน อะตอมที่มีอิเล็กตรอนมากหรือน้อยกว่าปกติเรียกว่า ไอออน อิเล็กตรอนที่อยู่ไกลจากนิวเคลียสมากอาจถ่ายโอนไปยังอะตอมข้างเคียง หรืออยู่ร่วมระหว่างสองอะตอมก็ได้ ด้วยกลไกนี้ อะตอมจึงสามารถเกิดพันธะเคมีกลายเป็นโมเลกุลและสารประกอบเคมีอื่น ๆ เช่น การเกิดผลึกแบบไอโอนิกคริสตัลหรือโคเวเลนต์[54]
โครงสร้างของเมฆอิเล็กตรอนอาจเปลี่ยนแปลงไปตามจำนวนอิเล็กตรอนที่มีในกลุ่มเมฆนั้น มีวิธีการนับจำนวนอิเล็กตรอนที่แตกต่างกันอยู่จำนวนหนึ่ง เช่น กฎออกเตต หรือ กฎ 18 อิเล็กตรอน ซึ่งโดยมากจะใช้เป็นเพียงกฎช่วยจำและไม่ได้ใช้แบบเดียวกันกับอะตอมทุกชนิด นักศึกษาใหม่ในวิชาเคมีมักถูกสอนให้จำโครงสร้างอะตอมแบบง่าย ๆ เป็น 2, 8, 8, 8, 8, 8, 8, [...] ทั้งนี้เพื่อให้ลำดับการสอนทำได้ง่ายขึ้น แต่จำนวนอิเล็กตรอนในแต่ละเชลล์สำหรับอะตอมขนาดใหญ่ที่จริงแล้วมีจำนวนที่ต่างไปจากนี้ เช่น 2, 8, 18, 32, 50, 72 แต่ต้องเป็นนักศึกษาชั้นสูงจึงค่อยทำความเข้าใจกับความซับซ้อนนี้
ตามคำนิยามแล้ว อะตอมสองตัวที่มีจำนวน โปรตอน ในนิวเคลียสเท่ากัน จะเป็นอะตอมของธาตุชนิดเดียวกัน อะตอมที่มีจำนวนโปรตอนเท่ากันแต่มีจำนวน นิวตรอน แตกต่างกันจัดว่าเป็นไอโซโทปของธาตุเดียวกัน ตัวอย่างเช่น อะตอมของไฮโดรเจนทั้งหมดจะมีโปรตอน 1 ตัวเหมือนกัน แต่ไอโซโทปของไฮโดรเจนมีหลายชนิด ตั้งแต่แบบไม่มีนิวตรอน คือ ไฮโดรเจน-1, แบบนิวตรอน 1 ตัว (ดิวเทอเรียม), แบบนิวตรอน 2 ตัว (ทริเทียม) และที่มีนิวตรอนมากกว่า 2 ตัว ไฮโดรเจน-1 เป็นรูปแบบที่พบกันแพร่หลายมากที่สุด บางคราวก็เรียกว่า โปรเทียม[55] ธาตุที่เรารู้จักแล้วมีกลุ่มหมายเลขอะตอมตั้งแต่ไฮโดรเจน ซึ่งมีโปรตอน 1 ตัว ไปจนถึง ออกาเนสซอน ซึ่งเป็นธาตุที่มีโปรตอน 118 ตัว[56] ไอโซโทปของธาตุทั้งหมดที่เรารู้จักที่มีหมายเลขอะตอมมากกว่า 82 จัดเป็นสารกัมมันตรังสี[57][58]
มีนิวไคลด์อยู่ 339 ชนิดที่เกิดขึ้นตามธรรมชาติบนโลก[59] ในจำนวนนี้ 256 ชนิด (ประมาณ 76%) ไม่พบการสลายตัว ซึ่งจะเรียกว่าเป็นไอโซโทปเสถียร ในบรรดาธาตุ 80 ชนิดจะมีไอโซโทปเสถียรอย่างน้อย 1 ตัว สำหรับธาตุหมายเลข 43, 61, และทุกธาตุที่หมายเลข 83 หรือสูงกว่า ไม่มีไอโซโทปที่เสถียร อาจกำหนดเป็นกฎได้ว่า สำหรับธาตุทุกชนิด มีไอโซโทปเสถียรอยู่เพียงจำนวนน้อยนิด เฉลี่ยมีไอโซโทปเสถียรประมาณ 3.1 ตัวต่อธาตุที่มีไอโซโทปเสถียร มีธาตุอยู่ 27 ชนิดที่มีไอโซโทปเสถียรเพียงตัวเดียว ขณะที่จำนวนไอโซโทปเสถียรมากที่สุดเท่าที่เคยพบคือ 10 โดยพบในดีบุก[60]
ความเสถียรของไอโซโทปเกิดจากสัดส่วนระหว่างโปรตอนต่อนิวตรอน รวมไปถึง "จำนวนมหัศจรรย์" ของนิวตรอนหรือโปรตอนที่แสดงถึงระดับพลังงานควอนตัมทั้งแบบ closed และแบบ filled ระดับชั้นพลังงานควอนตัมเหล่านี้คือระดับพลังงานภายในแบบจำลองชั้นพลังงานของนิวเคลียส ดังเช่น filled shell ของโปรตอน 50 ตัวในดีบุก แสดงถึงความเสถียรของนิวไคลด์แบบไม่ปกติ จากจำนวนนิวไคลด์เสถียรทั้งหมดที่รู้จักกัน 256 ชนิด มีเพียง 4 ชนิดเท่านั้นที่มีจำนวนโปรตอนและนิวตรอนเป็นเลขคี่ ได้แก่ ไฮโดรเจน-2 (ดิวเทอเรียม), ลิเธียม-6, โบรอน-10 และ ไนโตรเจน-14 นอกจากนี้ สำหรับนิวไคลด์กัมมันต์แบบคี่-คี่ ที่มีครึ่งชีวิตมากกว่าพันล้านปี ก็มีเพียง 4 ชนิดเท่านั้นคือ โปแตสเซียม-40, วานาเดียม-50, แลนทานัม-138 และ แทนทาลัม-180m นิวเคลียสที่มีจำนวนแบบคี่-คี่ ส่วนใหญ่จะไม่เสถียรอย่างมากโดยเกิดการสลายปลดปล่อยอนุภาคบีตา เพราะผลจากการสลายนั้นจะได้จำนวนมาเป็นแบบคู่-คู่ ซึ่งเป็นพันธะที่แข็งแรงกว่า ตาม nuclear pairing effects[60]
เนื่องจากมวลส่วนมากของอะตอมอยู่ในโปรตอนและนิวตรอน ดังนั้นจำนวนรวมของอนุภาคเหล่านี้ (เรียกรวมกันว่า "นิวคลีออน") ในอะตอมหนึ่ง ๆ จึงเรียกว่าเป็น เลขมวล โดยมากมักจะแสดงมวลนิ่งโดยใช้หน่วยมวลอะตอม (u) ซึ่งบางครั้งก็เรียกว่า ดาลตัน (Da) หน่วยนี้นิยามจาก 1 ส่วน 12 ของมวลของอะตอมอิสระที่เป็นกลางของคาร์บอน-12 ซึ่งมีค่าประมาณ 1.66×10−27 kg[61] ไฮโดรเจน-1 ซึ่งเป็นไอโซโทปที่เบาที่สุดของไฮโดรเจนและเป็นอะตอมที่มีมวลน้อยที่สุด มีน้ำหนักอะตอมเท่ากับ 1.007825 u[62] อะตอมหนึ่ง ๆ จะมีมวลโดยประมาณเท่ากับเลขมวลคูณด้วยหน่วยมวลอะตอม[63] อะตอมเสถียรที่หนักที่สุด คือ ตะกั่ว-208[57] ซึ่งมีมวล 207.9766521 u[64]
ถึงแม้จะเป็นอะตอมที่มีมวลมากที่สุด มันก็ยังเบาเกินกว่าที่เราจะไปทำอะไรด้วยโดยตรงได้ นักเคมีจึงนิยมใช้หน่วย โมล แทน โมลมีนิยามว่า หนึ่งโมลของธาตุใด ๆ จะมีจำนวนอะตอมเท่ากันเสมอ (ประมาณ 6.022×1023) ที่เลือกใช้จำนวนนี้ก็เพื่อว่า ถ้าธาตุใด ๆ มีเลขอะตอมเป็น 1 u แล้ว โมลอะตอมของธาตุนั้นจะมีมวลใกล้เคียงกับ 0.001 กก. หรือ 1 กรัม อาศัยคำนิยามของหน่วยมวลอะตอมนี้ คาร์บอน-12 จึงมีมวลอะตอมเท่ากับ 12 u พอดี และหนึ่งโมลของอะตอมคาร์บอนมีน้ำหนักเท่ากับ 0.012 กก.[61]
เราไม่สามารถบอกขอบเขตที่แน่นอนของอะตอมได้ การบอกขนาดของอะตอมจึงมักอธิบายในลักษณะรัศมีอะตอม คือการวัดระยะห่างของเมฆอิเล็กตรอนที่แผ่ออกไปจากนิวเคลียส อย่างไรก็ดี การบอกระยะห่างเช่นนี้อยู่บนสมมุติฐานว่าอะตอมมีรูปร่างเป็นทรงกลม ซึ่งจะเป็นจริงก็ต่อเมื่ออะตอมนั้นอยู่ในสุญญากาศหรืออวกาศเสรีเท่านั้น รัศมีอะตอมหาได้จากระยะห่างระหว่างนิวเคลียสอะตอม 2 ตัวที่ดึงดูดกันอยู่ในพันธะเคมี มีค่าแปรเปลี่ยนไปตามแต่ตำแหน่งของอะตอมบนแผนผังอะตอม หรือตามชนิดของพันธะเคมี จำนวนอะตอมเพื่อนบ้าน (เลขโคออร์ดิเนชัน) และคุณสมบัติทางควอนตัมที่เรียกว่า สปิน[65] ตามที่ปรากฏในตารางธาตุ ขนาดอะตอมมีแนวโน้มเพิ่มสูงขึ้นถ้ายิ่งอยู่ในคอลัมน์ที่ต่ำลงไปข้างล่าง แต่มีขนาดเล็กลงหากเปรียบเทียบจากด้านซ้ายไปขวา[66] เทียบกันแล้ว อะตอมที่มีขนาดเล็กที่สุดคืออะตอมของฮีเลียม ซึ่งมีรัศมี 32 พิโคเมตร ส่วนอะตอมใหญ่ที่สุดคือ ซีเซียม มีขนาด 225 พิโคเมตร[67]
ถ้าอะตอมอยู่ในสนามพลังงานอื่น ๆ เช่น สนามไฟฟ้า รูปร่างของอะตอมจะบิดเบี้ยวไปไม่เป็นทรงกลม การเปลี่ยนแปลงขึ้นอยู่กับขนาดความแรงของสนามพลังงานและชนิดวงโคจรของอิเล็กตรอนในเชลล์นอกสุด ซึ่งแสดงไว้ในทฤษฎีกรุป การเปลี่ยนแปลงรูปร่างอื่น ๆ เช่นรูปทรงคริสตัล เกิดขึ้นจากสนามพลังงานไฟฟ้า-คริสตัล ในการก่อตัวแบบสมมาตรต่ำ[68] มีรูปทรงโดดเด่นอีกแบบหนึ่งคือทรงรี เกิดขึ้นกับไอออนซัลเฟอร์ในสารประกอบประเภท pyrite[69]
มิติของอะตอมนั้นเล็กกว่าความยาวคลื่นของแสง (400-700 นาโนเมตร) นับหลายพันเท่า จึงไม่สามารถมองดูอะตอมด้วยกล้องจุลทรรศน์แบบใช้แสงได้ อย่างไรก็ดี เราสามารถสังเกตการณ์อะตอมเดี่ยว ๆ ได้โดยใช้กล้องจุลทรรศน์แบบส่องกราดในอุโมงค์ ซึ่งบางตัวอย่างอาจแสดงให้เห็นความเล็กจิ๋วของอะตอมได้ เส้นผมของมนุษย์มีขนาดความกว้างประมาณ 1 ล้านเท่าของอะตอมคาร์บอน[70] หยดน้ำหนึ่งหยดมีอะตอมออกซิเจนอยู่ประมาณ 2 เซ็กซ์ทิลเลียน (2×1021) และอะตอมไฮโดรเจนอีก 2 เท่าของจำนวนนี้[71] เพชร 1 กะรัต มีมวล 2×10−4 กิโลกรัม ประกอบด้วยอะตอมคาร์บอนจำนวน 10 เซ็กซ์ทิลเลียน (1022) อะตอม[note 2] ถ้าเราขยายขนาดผลแอปเปิ้ลให้ใหญ่เท่าขนาดของโลก หนึ่งอะตอมในแอปเปิ้ลจะมีขนาดประมาณผลแอปเปิ้ลปกติ[72]

ธาตุทุกชนิดจะมีไอโซโทปอย่างน้อยหนึ่งตัวที่มีนิวเคลียสที่ไม่เสถียร และมีการสลายตัวของกัมมันตรังสี ทำให้นิวเคลียสนั้นปลดปล่อยอนุภาคออกมาหรือเกิดการแผ่รังสีแม่เหล็กไฟฟ้า การแผ่กัมมันตรังสีสามารถเกิดขึ้นได้เมื่อรัศมีของนิวเคลียสมีขนาดใหญ่กว่าเทียบกับรัศมีของแรงนิวเคลียร์อย่างเข้ม ซึ่งส่งแรงได้ในระยะทางเพียง 1 fm[73]
รูปแบบการสลายตัวของสารกัมมันตรังสีที่พบกันมากที่สุด ได้แก่[74][75]
การสลายตัวของสารกัมมันตรังสีแบบอื่น ๆ ที่พบค่อนข้างน้อย ได้แก่การปล่อยลำอนุภาคนิวตรอนหรือโปรตอน หรือกลุ่มของนิวคลีออนจากนิวเคลียส การปล่อยอนุภาคบีตามากกว่า 1 ตัว หรือการเกิดอิเล็กตรอนความเร็วสูง (จากการแปลงผันภายใน) ซึ่งมิใช่รังสีบีตา และโฟตอนพลังงานสูงที่มิใช่รังสีแกมมา
ไอโซโทปกัมมันต์แต่ละตัวจะมีระยะเวลาในการปลดปล่อยอนุภาค หรือครึ่งชีวิต ที่เฉพาะตัว ซึ่งกำหนดจากระยะเวลาที่ต้องใช้ในการทำให้สารตัวอย่างนั้นสลายตัวไปเหลือเพียงครึ่งเดียว อันเป็นกระบวนการสลายตัวแบบเอ็กโปเนนเชียล สัดส่วนของไอโซโทปที่เหลืออยู่เป็น 50% ของทุก ๆ ระยะครึ่งชีวิตจะลดลงเรื่อย ๆ นั่นคือ หลังจากที่ผ่านระยะครึ่งชีวิตไป 2 ครั้ง จะเหลือปริมาณไอโซโทปนั้นอยู่ 25% ของจำนวนในครั้งแรก และลดลงในลักษณะนี้ไปเรื่อย ๆ [73]
อนุภาคมูลฐานจะมีคุณสมบัติภายในเชิงกลศาสตร์ควอนตัมประการหนึ่งรู้จักกันในชื่อ สปิน หากเปรียบเทียบก็อาจคล้ายคลึงกับโมเมนตัมเชิงมุมของวัตถุที่หมุนรอบจุดศูนย์กลางมวลของตัวเอง แม้ว่าถ้าจะพูดให้เคร่งครัดแล้ว อนุภาคเหล่านี้มีลักษณะเป็นเหมือนจุดซึ่งไม่สามารถบอกได้ว่ามันกำลังหมุน การวัดค่าสปินใช้หน่วยของค่าคงที่ของพลังค์ (ħ) โดยที่อิเล็กตรอน โปรตอน และนิวตรอน ล้วนมีค่าสปิน ½ ħ, or "spin-½" ในอะตอมหนึ่ง ๆ อิเล็กตรอนที่เคลื่อนที่ไปรอบนิวเคลียสจะมีโมเมนตัมเชิงมุมในวงโคจรเพิ่มไปกับสปินของมัน ขณะที่ตัวนิวเคลียสเองนั้นมีโมเมนตัมเชิงมุมขึ้นกับนิวเคลียร์สปินของมัน[76]
สนามแม่เหล็กที่เกิดขึ้นโดยอะตอม (หรือโมเมนต์แม่เหล็กของมัน) สามารถนิยามได้จากรูปแบบที่แตกต่างกันของโมเมนตัมเชิงมุม ว่าเป็นวัตถุมีประจุที่กำลังหมุนรอบตัวเองและสร้างสนามแม่เหล็กออกมา อย่างไรก็ดี คุณลักษณะอันโดดเด่นที่สุดก็เกิดขึ้นมาจากสปิน โดยธรรมชาติของอิเล็กตรอนแล้ว มันจะเป็นไปตามหลักการกีดกันของเพาลี กล่าวคือ ไม่มีทางที่จะพบอิเล็กตรอน 2 ตัวอยู่ในสถานะควอนตัมเดียวกันได้ อิเล็กตรอนที่เป็นคู่จะอยู่ตรงกันข้ามกัน ถ้าสมาชิกหนึ่งอยู่ในสถานะสปินขึ้น อีกตัวจะอยู่ในสถานะตรงกันข้าม คือสปินลง ดังนั้นค่าสปินทั้งสองจะหักล้างกันเอง ทำให้ลดแรงแม่เหล็กสองขั้วลงเป็นศูนย์สำหรับอะตอมบางตัวที่มีจำนวนอิเล็กตรอนเป็นเลขคู่[77]
ในธาตุที่มีคุณสมบัติของแม่เหล็กเฟอร์โร อย่างเช่น เหล็ก จำนวนอิเล็กตรอนที่เป็นเลขคี่ทำให้มีอิเล็กตรอนเหลือซึ่งไม่มีคู่ และทำให้เกิดผลรวมโมเมนต์แม่เหล็กสุทธิขึ้น วงโคจรของอะตอมข้างเคียงจะซ้อนทับกัน และไปสู่สถานะพลังงานที่ต่ำกว่าเมื่อสปินของอิเล็กตรอนที่ไม่มีคู่ได้แนวตรงกันกับตัวอื่น กระบวนการนี้รู้จักกันในชื่อ อันตรกิริยาแลกเปลี่ยน (exchange interaction) เมื่อเกิดแนวโมเมนต์แม่เหล็กของอะตอมแม่เหล็กเฟอร์โรขึ้น สสารนั้นก็สามารถสร้างสนามแรงขนาดใหญ่ขึ้นจนตรวจวัดได้ สสารแบบพาราแม็กเนติกมีอะตอมที่มีโมเมนต์แม่เหล็กซึ่งสร้างแนวขึ้นในทิศทางแบบสุ่มโดยที่ไม่สามารถตรวจพบสนามแม่เหล็กเลย แต่โมเมนต์แม่เหล็กของอะตอมแต่ละตัวนั้นเรียงแนวกันตามการก่อตัวของสนาม[77][78]
นิวเคลียสของอะตอมก็สามารถมีค่าสปินสุทธิได้เช่นกัน ตามปกติแล้วนิวเคลียสเหล่านี้จะเรียงตัวกันในทิศทางแบบสุ่ม อันเนื่องมาจากสภาวะสมดุลความร้อน อย่างไรก็ดี มีธาตุบางตัว (เช่น ซีนอน-129 ซึ่งมีความเป็นไปได้ในการเกิดขั้วสปินที่สถาวะนิวเคลียร์สปินอย่างมีนัยสำคัญ จนมันเรียงตัวกันในทิศทางเดียวกันได้ เงื่อนไขเช่นนี้เรียกว่า hyperpolarization ซึ่งสามารถนำไปประยุกต์ใช้งานได้กับการสร้างภาพด้วยเรโซแนนซ์แม่เหล็ก (MRI)[79][80]
อิเล็กตรอนที่ถูกดึงดูดอยู่ภายในอะตอมหนึ่ง ๆ จะมีพลังงานศักย์ซึ่งแปรผกผันกับระยะห่างของมันจากนิวเคลียส ค่านี้วัดได้จากขนาดของพลังงานที่จำเป็นต้องใช้เพื่อให้อิเล็กตรอนนั้นหลุดออกจากอะตอม โดยปกติใช้หน่วยวัดเป็น อิเล็กตรอนโวลต์ (eV) ในแบบจำลองกลศาสตร์ควอนตัม อิเล็กตรอนที่มีพันธะจะสามารถครอบครองสถานะจำนวนหนึ่งรอบนิวเคลียส แต่ละสถานะนั้นสอดคล้องกับระดับพลังงานที่เฉพาะเจาะจง ระดับพลังงานที่ต่ำที่สุดของอิเล็กตรอนเรียกว่า สภาวะพื้น (ground state) ส่วนอิเล็กตรอนที่อยู่ในระดับพลังงานที่สูงกว่าจะเรียกว่าอยู่ในสภาวะกระตุ้น (excited state)[81]
อิเล็กตรอนที่มีการเปลี่ยนแปลงระหว่างสภาวะที่แตกต่างกันสองสภาวะ จะต้องดูดซับหรือปลดปล่อยโฟตอนออกมาที่ระดับพลังงานหนึ่งซึ่งเท่ากับค่าแตกต่างของพลังงานศักย์ของสภาวะทั้งสอง พลังงานของโฟตอนที่ปลดปล่อยออกมาเป็นสัดส่วนกับความถี่ของมัน ดังนั้นระดับพลังงานที่เฉพาะเจาะจงจะมีช่วงสเปกตรัมแม่เหล็กไฟฟ้าที่เป็นเอกลักษณ์[82] ธาตุแต่ละชนิดจะมีสเปกตรัมเฉพาะ ขึ้นอยู่กับประจุนิวเคลียร์ ระดับพลังงานย่อยของอิเล็กตรอน อันตรกิริยาแม่เหล็กไฟฟ้าระหว่างอิเล็กตรอน และปัจจัยอื่น ๆ [83]
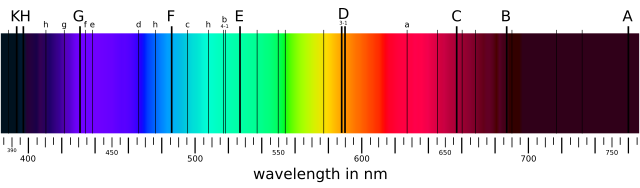
เมื่อสเปกตรัมพลังงานที่ต่อเนื่องผ่านแก๊สหรือพลาสมา โฟตอนบางส่วนจะถูกอะตอมดูดกลืนไป ทำให้อิเล็กตรอนเปลี่ยนแปลงระดับพลังงาน อิเล็กตรอนที่ถูกกระตุ้นเหล่านั้นซึ่งยังคงถูกดึงดูดอยู่กับอะตอม จะปลดปล่อยพลังงานออกมาอย่างต่อเนื่องเป็นโฟตอน โดยปลดปล่อยออกมาทุกทิศทางอย่างสุ่ม จากนั้นก็ตกลงไปยังระดับพลังงานที่ต่ำกว่า ดังนั้นอะตอมจึงทำตัวเหมือนตัวกรอง ซึ่งทำให้เกิดแนวเส้นดูดกลืนมืด ๆ ต่อเนื่องขึ้นที่พลังงานที่ส่งออกมา (ผู้สังเกตที่มองดูอะตอมจากมุมอื่นซึ่งไม่ได้รวมเอาสเปกตรัมต่อเนื่องเป็นฉากหลัง จะมองเห็นเส้นปลดปล่อยของโฟตอนที่ปลดปล่อยออกมาจากอะตอมแทน) เครื่องมือวัดสเปกโตรสโกปีสำหรับความแรงและความกว้างของเส้นสเปกตรัมจะช่วยให้เราสามารถระบุองค์ประกอบและคุณสมบัติทางกายภาพของสสารนั้นได้[84]
การตรวจสอบเส้นสเปกตรัมอย่างละเอียดพบว่ามีการแบ่งแยกเชิงโครงสร้างอย่างละเอียดจำนวนหนึ่ง ซึ่งเกิดขึ้นเนื่องจาก การคู่ควบของสปินกับออร์บิท (spin-orbit coupling) อันเป็นอันตรกิริยาระหว่างสปินกับการเคลื่อนที่ของอิเล็กตรอนชั้นนอกสุด[85] เมื่ออะตอมอยู่ในสนามแม่เหล็กภายนอก เส้นสเปกตรัมจะแยกออกเป็นสามส่วนหรือมากกว่านั้น ปรากฏการณ์นี้เรียกว่า ปรากฏการณ์ซีแมน (Zeeman effect) ซึ่งเกิดขึ้นจากอันตรกิริยาของสนามแม่เหล็กกับโมเมนต์แม่เหล็กของอะตอมและอิเล็กตรอนภายใน อะตอมบางตัวอาจมีการจัดเรียงอิเล็กตรอนที่ระดับพลังงานเดียวกัน ซึ่งจะปรากฏออกมาเป็นเส้นสเปกตรัมหนึ่งเส้น อันตรกิริยาระหว่างสนามแม่เหล็กกับอะตอมจะทำให้การจัดเรียงอิเล็กตรอนนี้เคลื่อนไปที่ระดับพลังงานระดับอื่น ส่งผลให้มีเส้นสเปกตรัมหลายเส้น[86] การที่มีสนามไฟฟ้าภายนอกนี้สามารถทำให้เกิดการแยกตัวและการเคลื่อนตัวของเส้นสเปกตรัมที่เปรียบเทียบกันได้โดยการดัดแปลงระดับพลังงานของอิเล็กตรอน ปรากฏการณ์นี้เรียกว่า ปรากฏการณ์สตาร์ค (Stark effect)[87]
ถ้าอิเล็กตรอนใต้แรงดึงดูดอยู่ในสภาวะกระตุ้น โฟตอนที่มีพลังงานเหมาะสมสามารถเปล่งแสงด้วยระดับพลังงานที่ตรงกัน การจะเกิดเหตุการณ์เช่นนี้ อิเล็กตรอนต้องลดระดับพลังงานลงไปยังสภาวะที่ต่ำกว่าที่ทำให้มีความแตกต่างของระดับพลังงานเท่ากับพลังงานของโฟตอนที่อยู่ในภาวะกระตุ้น โฟตอนที่เปล่งแสงออกมากับโฟตอนในสภาวะกระตุ้นจะเคลื่อนตัวออกโดยขนานกันและด้วยเฟสที่ตรงกัน นั่นก็คือรูปแบบของคลื่นของโฟตอนทั้งสองนั้นสอดประสานกันพอดี คุณสมบัติทางกายภาพเช่นนี้ใช้ในการสร้างเลเซอร์ ซึ่งสามารถเปล่งลำแสงเชื่อมต่อกันของพลังงานแสงภายในแถบความถี่แคบ ๆ แถบหนึ่ง[88]
วงโคจรอิเล็กตรอนชั้นนอกสุดของอะตอมในสภาวะที่ไม่ได้รวมกัน รู้จักกันในชื่อว่า วงโคจรเวเลนซ์ อิเล็กตรอนที่อยู่ในวงโคจรนี้จะเรียกชื่อว่า เวเลนซ์อิเล็กตรอน จำนวนของเวเลนซ์อิเล็กตรอนหาได้จากพฤติกรรมของแรงยึดเหนี่ยวกับอะตอมอื่น ๆ เพราะอะตอมมีแนวโน้มจะเกิดปฏิกิริยาทางเคมีกับอะตอมอื่น ๆ ในลักษณะที่คอยเติมเต็ม (หรือทำให้ว่าง) วงโคจรเวเลนซ์ชั้นนอกสุด[89] ตัวอย่างเช่น การเคลื่อนย้ายอิเล็กตรอนเดี่ยวระหว่างอะตอมเป็นการประมาณการที่มีประโยชน์สำหรับพันธะที่เกิดขึ้นระหว่างอะตอมที่มีอิเล็กตรอนในวงโคจรเกินมา 1 ตัว กับอีกอะตอมหนึ่งที่ขาดอิเล็กตรอนในวงโคจรไป 1 ตัว ซึ่งเป็นสิ่งที่เกิดขึ้นในสารประกอบโซเดียมคลอไรด์ และเกลือไอออนทางเคมีอื่น ๆ อย่างไรก็ดี ธาตุหลายชนิดปรากฏว่ามีเวเลนซ์หลายตัว หรือมีแนวโน้มที่จะมีจำนวนอิเล็กตรอนในสารประกอบที่แตกต่างกันเป็นจำนวนไม่เท่ากัน ดังนั้นพันธะเคมีระหว่างธาตุเหล่านี้จึงทำให้เกิดการแลกเปลี่ยนอิเล็กตรอนหลายรูปแบบซึ่งมีการเคลื่อนย้ายอิเล็กตรอนมากกว่า 1 ตัว ตัวอย่างเหล่านี้รวมไปถึงธาตุคาร์บอนและสารประกอบอินทรีย์อื่น ๆ [90]
ธาตุเคมีมักจะปรากฏตัวในตารางธาตุ ซึ่งวางตำแหน่งตามคุณสมบัติทางเคมีที่ปรากฏ ธาตุที่มีจำนวนเวเลนซ์อิเล็กตรอนเป็นเลขเดียวกันจะจับกลุ่มรวมกันแสดงในแนวดิ่งในตาราง หรืออยู่ในคอลัมน์เดียวกัน (ส่วนแถวแนวนอนสื่อถึงการเติมวงโคจรควอนตัมของอิเล็กตรอน) ธาตุที่อยู่ทางขวาของตารางจะมีอิเล็กตรอนในวงโคจรชั้นนอกอย่างสมบูรณ์ ทำให้มันมีลักษณะเฉื่อยในทางเคมี รู้จักกันในชื่อ แก๊สมีสกุล[91][92]

จำนวนอะตอมที่พบในสถานะต่าง ๆ ของสสาร ขึ้นอยู่กับเงื่อนไขทางกายภาพของสสารนั้น ๆ เช่น อุณหภูมิและความดัน เมื่อแปรเงื่อนไขเหล่านี้ สสารนั้นก็สามารถเปลี่ยนสภาพไประหว่างของแข็ง ของเหลว ก๊าซ และพลาสมา[93] ในสถานะหนึ่ง ๆ สสารสามารถดำรงอยู่ในสภาพที่แตกต่างกันก็ได้ ตัวอย่างของกรณีนี้เช่น คาร์บอน ซึ่งสามารถดำรงอยู่ได้ทั้งในรูปของแกรไฟต์ หรือเพชร[94]
เมื่ออุณหภูมิมีค่าเข้าใกล้ศูนย์องศาสัมบูรณ์ อะตอมจะเกิดการควบแน่นของโบส-ไอน์สไตน์ ซึ่งเป็นจุดที่กลศาสตร์ควอนตัมที่ตามปกติสามารถสังเกตการณ์ได้เฉพาะในระดับอะตอมเท่านั้น เริ่มส่งผลและสามารถสังเกตการณ์ในระดับมหภาคได้[95][96] กลุ่มของอะตอมที่เย็นยิ่งยวดนี้จะมีพฤติกรรมเป็นซูเปอร์อะตอมหนึ่งเดียว ทำให้สามารถตรวจสอบคุณสมบัติพื้นฐานของพฤติกรรมทางกลศาสตร์ควอนตัมได้[97]

กล้องจุลทรรศน์แบบส่องกราดในอุโมงค์ คือเครื่องมือที่ใช้ในการตรวจดูพื้นผิวในระดับอะตอม อาศัยปรากฏการณ์ quantum tunneling ซึ่งยอมให้อนุภาคข้ามผ่านชั้นพลังงานที่ตามปกติแล้วจะข้ามไปไม่ได้ อุโมงค์อิเล็กตรอนในสุญญากาศระหว่างแผ่นโลหะอิเล็กโทรดสองชิ้นซึ่งมีชั้นของอะตอมสะสมอยู่ จะทำให้เกิดความหนาแน่นของกระแสในอุโมงค์จนทำให้สามารถตรวจวัดได้ การสแกนอะตอมตัวหนึ่ง (เรียกว่า tip) ขณะที่มันวิ่งผ่านอะตอมอีกตัวหนึ่ง (อะตอมตัวอย่าง) ทำให้สามารถวาดภาพการเคลื่อนที่ของ tip เทียบกับกระแสการเคลื่อนที่ของอะตอมที่แยกกัน ผลการคำนวณทำให้เราสามารถสร้างภาพจากกล้องจุลทรรศน์ scanning tunneling microscope ขึ้นมาเป็นภาพของอะตอมแต่ละอะตอมได้ ภาพเหล่านี้ช่วยยืนยันว่า ที่การกระตุ้นขนาดต่ำ ระยะห่างเฉลี่ยของวงโคจรอิเล็กตรอนจะอยู่ใกล้กับระดับพลังงานแฟร์มี ซึ่งเป็นระดับความหนาแน่นของสถานะโดยปกติ[98][99]
อะตอมอาจมีประจุขึ้นมาได้ถ้าเอาอิเล็กตรอนตัวหนึ่งออกไปเสีย ประจุไฟฟ้าจะทำให้ทิศทางการเคลื่อนที่ของอะตอมเอียงโค้งไปเมื่อเดินทางผ่านบริเวณสนามแม่เหล็ก รัศมีการโค้งไปของไอออนที่เคลื่อนที่อันเนื่องจากสนามแม่เหล็กนั้นสามารถบอกได้จากมวลของอะตอม หลักการนี้นำไปใช้ในเครื่องสเปกโตรมิเตอร์ของมวลเพื่อตรวจวัดอัตราส่วนมวลต่อประจุ (mass-to-charge ratio) ของไอออน ถ้าตัวอย่างที่ตรวจวัดมีไอโซโทปหลายตัว สเปกโตรมิเตอร์ของมวลจะสามารถระบุสัดส่วนของแต่ละไอโซโทปในตัวอย่างนั้นได้โดยการวัดความเข้มของลำไอออนแต่ละตัวที่แตกต่างกัน เทคนิคในการทำให้อะตอมระเหิดนี้รวมไปถึง inductively coupled plasma atomic emission spectroscopy (ICP-AES) และ inductively coupled plasma mass spectrometry (ICP-MS) ซึ่งทั้ง 2 วิธีนี้ใช้พลาสมาในการทำให้อะตอมตัวอย่างระเหิดเพื่อทำการวิเคราะห์[100]
สำหรับกระบวนวิธีที่เจาะจงมากกว่านี้ได้แก่ การตรวจวัดการสูญเสียพลังงานของอิเล็กตรอน (electron energy loss spectroscopy) ซึ่งจะตรวจวัดพลังงานที่สูญเสียจากลำอิเล็กตรอนภายในกล้องจุลทรรศน์อิเล็กตรอนชนิดส่องผ่านเมื่อมันทำอันตรกิริยากับอะตอมตัวอย่าง ภาพโทโมกราฟของอะตอมโพรบได้ผลลัพธ์สามมิติในระดับต่ำกว่านาโนเมตร และสามารถใช้เครื่อง time-of-flight mass spectrometry เพื่อระบุคุณสมบัติทางเคมีของอะตอมได้[101]
เราสามารถใช้สเปกตรัมของสถานะกระตุ้นของอะตอมในการวิเคราะห์องค์ประกอบอะตอมในดาวฤกษ์ที่อยู่ห่างไกลได้ แสงที่สังเกตการณ์จากดาวฤกษ์เหล่านั้นประกอบด้วยความยาวคลื่นแสงขนาดหนึ่ง ๆ ซึ่งสามารถแยกแยะออกได้โดยมีความสัมพันธ์กับการเปลี่ยนแปลงควอนตัมของอะตอมแก๊สอิสระ อาศัยหลอดปล่อยประจุที่บรรจุธาตุชนิดเดียวกันทำให้เราสามารถเลียนแบบสีแบบเดียวกันได้[102] ฮีเลียมถูกค้นพบด้วยวิธีการเช่นนี้โดยตรวจได้จากสเปกตรัมของดวงอาทิตย์เป็นเวลา 23 ปีก่อนที่จะพบมันบนโลกเสียอีก[103]
อะตอมเป็นส่วนประกอบราว 4% ของความหนาแน่นพลังงานรวมทั้งหมดในเอกภพที่สังเกตได้ โดยมีค่าความหนาแน่นเฉลี่ยประมาณ 0.25 อะตอมต่อลูกบาศก์เมตร[104] สำหรับภายในดาราจักรเช่นทางช้างเผือกจะมีอะตอมอยู่เป็นจำนวนหนาแน่นมากกว่ามาก โดยมีความหนาแน่นของสสารในสสารระหว่างดาวระหว่าง 105 ถึง 109 อะตอม/ลบ.ม.[105] เชื่อกันว่า ดวงอาทิตย์ของเราอยู่ภายในฟองท้องถิ่นซึ่งเป็นบริเวณกลุ่มแก๊สที่มีประจุสูง ดังนั้นความหนาแน่นของบริเวณโดยรอบระบบสุริยะจึงมีเพียง 103 อะตอม/ลบ.ม.[106] ดาวฤกษ์ก่อตัวจากกลุ่มเมฆหนาแน่นในสสารระหว่างดาว และกระบวนการวิวัฒนาการของดาวฤกษ์ส่งผลให้เกิดธาตุจำนวนมากมายขึ้นในอวกาศระหว่างดาวซึ่งมีมวลหนักกว่าไฮโดรเจนกับฮีเลียม อะตอมภายในทางช้างเผือกกว่า 95% รวมตัวกันอยู่ภายในดาวฤกษ์ และมวลรวมของอะตอมคิดเป็นประมาณ 10% ของมวลดาราจักร[107] (มวลส่วนที่เหลือนั้นยังไม่เป็นที่รู้จัก เรียกกันว่า สสารมืด)[108]
โปรตอนและอิเล็กตรอนที่เสถียรเกิดขึ้นหลังจากเกิดบิกแบงเพียงหนึ่งวินาที ระหว่างช่วงสามนาทีต่อมา บิกแบงนิวคลีโอซินทีสิสได้สร้างสสารส่วนใหญ่ของฮีเลียม ลิเทียม และดิวเทอเรียมขึ้นในเอกภพ และบางทีอาจรวมถึงเบอริลเลียมและโบรอนด้วย[109][110][111] อะตอมชุดแรก ๆ (ที่อิเล็กตรอนเป็นส่วนประกอบอย่างสมบูรณ์) ในทางทฤษฎีแล้วเชื่อว่าเกิดขึ้น 380,000 ปีหลังจากบิกแบง —คือยุคที่เรียกว่า recombination เมื่อเอกภพที่กำลังขยายตัวออกนั้นเย็นลงเพียงพอที่ทำให้อิเล็กตรอนสามารถเกาะติดกับนิวเคลียสได้[112] นับแต่นั้น นิวเคลียสอะตอมก็เริ่มรวมตัวเข้าในดาวฤกษ์ผ่านกระบวนการนิวเคลียร์ฟิวชันและสร้างธาตุต่าง ๆ ขึ้นไปจนถึงเหล็ก[113]
ไอโซโทปบางตัวเช่น ลิเทียม-6 เกิดขึ้นในอวกาศโดยผ่านสปอลเลชั่นของรังสีคอสมิก[114] เมื่อโปรตอนพลังงานสูงปะทะกับนิวเคลียสของอะตอม ทำให้นิวคลีออนจำนวนมากดีดตัวออกมา ธาตุที่หนักกว่าเหล็กเกิดขึ้นในมหานวดาราผ่านกระบวนการอาร์และในแขนงดาวยักษ์เชิงเส้นกำกับ ผ่านกระบวนการเอส ทั้งสองกระบวนการนี้เกี่ยวข้องกับการที่นิวเคลียสอะตอมจับนิวตรอนเอาไว้[115] ธาตุบางชนิดเช่น ตะกั่ว ส่วนใหญ่ก่อตัวขึ้นผ่านกระบวนการสลายให้กัมมันตรังสีของธาตุที่หนักกว่า[116]
อะตอมส่วนมากที่ก่อตัวกันขึ้นเป็นโลกและสิ่งมีชีวิตที่อยู่บนโลกนั้นเกิดขึ้นจากการสลายตัวของเนบิวลาที่อยู่ในเมฆโมเลกุลเพื่อก่อตัวขึ้นเป็นระบบสุริยะ ส่วนที่เหลือเป็นผลจากการสลายตัวให้กัมมันตรังสี ส่วนประกอบที่เกี่ยวข้องกันนี้สามารถนำมาใช้เพื่อระบุถึงอายุของโลกได้[117][118] ฮีเลียมส่วนมากที่อยู่บริเวณเปลือกของโลก (ประมาณ 99% เป็นก๊าซ เช่นฮีเลียม-3 ที่มีอยู่เป็นจำนวนมหาศาล) เป็นผลที่เกิดจากการสลายปลดปล่อยอนุภาคอัลฟา[119]
มีอะตอมบางส่วนที่ตรวจพบว่าไม่ได้มีอยู่ตั้งแต่ตอนแรกกำเนิดโลก ทั้งไม่ได้เป็นผลที่เกิดจากการสลายตัวให้กัมมันตรังสี เช่น คาร์บอน-14 เกิดขึ้นอย่างต่อเนื่องจากรังสีคอสมิกในชั้นบรรยากาศ[120] อะตอมบางชนิดบนโลกถูกประดิษฐ์ขึ้น ทั้งโดยที่ตั้งใจสร้าง หรือเป็นผลพลอยได้จากการแตกตัวหรือการระเบิดของนิวเคลียร์[121][122] ในบรรดาธาตุหลังยูเรเนียม—คือพวกที่มีเลขอะตอมมากกว่า 92— มีเพียงพลูโตเนียมกับเนปจูเนียมเท่านั้นที่เกิดขึ้นบนโลกโดยธรรมชาติ[123][124] ธาตุหลังยูเรเนียมนั้นมีอายุกัมมันตรังสีสั้นกว่าอายุปัจจุบันของโลก[125] และจากปริมาณที่ตรวจได้แสดงว่าธาตุเหล่านั้นเริ่มสลายตัวมานานแล้ว มีข้อยกเว้นเพียงพลูโตเนียม-244 ซึ่งอาจจะเกิดขึ้นจากฝุ่นคอสมิก[117] ส่วนตัวประกอบอื่นของพลูโตเนียมและเนปจูเนียมนั้นเกิดขึ้นจากการจับตัวของนิวตรอนในแร่ยูเรเนียม[126]
โลกมีอะตอมอยู่ประมาณ 1.33×1050 อะตอม[127] ในชั้นบรรยากาศของดาว มีอะตอมอิสระของก๊าซเฉื่อยอยู่บ้างเล็กน้อย เช่น อาร์กอน และ นีออน ส่วนที่เหลือ 99% ของบรรยากาศจะอยู่ในรูปของโมเลกุล ซึ่งรวมไปถึงคาร์บอนไดออกไซด์ ออกซิเจนโมเลกุลคู่ และไนโตรเจน ที่พื้นผิวของโลก อะตอมรวมตัวกันเข้าเป็นสารประกอบหลายชนิด รวมถึง น้ำ เกลือ ซิลิเกต และออกไซด์ อะตอมสามารถรวมตัวกันกลายเป็นสสารใหม่ซึ่งไม่ได้ประกอบด้วยโมเลกุลที่แยกจากกันก็ได้ เช่นคริสตัล และโลหะที่เป็นของเหลวหรือของแข็ง[128][129]
ขณะที่ทราบกันดีว่า ไอโซโทปซึ่งมีเลขอะตอมสูงกว่าตะกั่ว (82) นั้นเป็นสารกัมมันตรังสี แต่ก็มีแนวคิด "เกาะแห่งความเสถียร" สำหรับธาตุจำนวนหนึ่งที่มีเลขอะตอมสูงกว่า 103 ธาตุหนักมากเหล่านี้อาจมีนิวเคลียสที่ค่อนข้างเสถียรมากกว่าเมื่อเทียบกับสารสลายกัมมันตรังสี[130] ธาตุที่มีแนวโน้มว่าจะเป็นอะตอมธาตุหนักมากที่เสถียร คือ อูนไบเฮกเซียม ซึ่งมีโปรตอน 126 ตัวและนิวตรอน 184 ตัว [131]
อนุภาคแต่ละตัวของสสารจะมีปฏิสสารที่คู่กันเสมอโดยมีประจุไฟฟ้าที่ตรงกันข้าม ดังนั้น โพสิตรอนก็คือแอนติอิเล็กตรอนที่มีประจุเป็นบวก และแอนติโปรตอนก็เทียบเท่ากับโปรตอนที่มีประจุเป็นลบ เมื่อสสารกับปฏิสสารของมันมาพบกัน ก็จะทำลายล้างกันและกัน ด้วยเหตุนี้ประกอบกับความไม่สมดุลระหว่างจำนวนของสสารและปฏิสสาร เราจึงพบปฏิสสารในเอกภพได้ยากมาก (สาเหตุที่มีสสารกับปฏิสสารไม่สมดุลกันนั้นยังไม่เป็นที่เข้าใจกันนัก แม้ว่าทฤษฎีแบริโอเจเนซิสจะช่วยเสนอคำอธิบายได้บ้าง) เราจึงไม่สามารถพบอะตอมของปฏิสสารได้ในธรรมชาติ[132][133] อย่างไรก็ดี ในปี ค.ศ. 1996 ห้องทดลอง CERN ในเจนีวา ได้สังเคราะห์แอนติไฮโดรเจนซึ่งเป็นปฏิสสารตรงข้ามกับไฮโดรเจนขึ้นได้สำเร็จ[134][135]
อะตอมประหลาดอื่น ๆ ถูกสร้างขึ้นโดยการแทนที่โปรตอน นิวตรอน หรืออิเล็กตรอนตัวใดตัวหนึ่งด้วยอนุภาคอื่นที่มีประจุเดียวกัน ตัวอย่างเช่น การแทนที่อิเล็กตรอนด้วยมิวออนซึ่งมีมวลมากกว่า ทำให้เกิดอะตอมมิวออนิกขึ้น อะตอมจำพวกนี้สามารถใช้ทดสอบการทำนายพื้นฐานทางฟิสิกส์ได้[136][137][138]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.