Loading AI tools
จากวิกิพีเดีย สารานุกรมเสรี
เอนไซม์ (อังกฤษ: enzyme) เป็นโปรตีน 99 เปอร์เซนต์ เป็น ส่วนใหญ่ ที่ทำหน้าที่เร่งปฏิกิริยาเคมี เป็นคำในภาษากรีก ένζυμο หรือ énsymo ซึ่งมาจาก én ("ที่" หรือ "ใน") และ simo ("en:leaven" หรือ "en:yeast")
ลิงก์ข้ามภาษาในบทความนี้ มีไว้ให้ผู้อ่านและผู้ร่วมแก้ไขบทความศึกษาเพิ่มเติมโดยสะดวก เนื่องจากวิกิพีเดียภาษาไทยยังไม่มีบทความดังกล่าว กระนั้น ควรรีบสร้างเป็นบทความโดยเร็วที่สุด |
บทความนี้หรือส่วนนี้ของบทความต้องการปรับรูปแบบ ซึ่งอาจหมายถึง ต้องการจัดรูปแบบข้อความ จัดหน้า แบ่งหัวข้อ จัดลิงก์ภายใน และ/หรือการจัดระเบียบอื่น ๆ คุณสามารถช่วยแก้ไขปัญหานี้ได้โดยการกดที่ปุ่ม แก้ไข ด้านบน จากนั้นปรับปรุงหรือจัดรูปแบบอื่น ๆ ในบทความให้เหมาะสม |
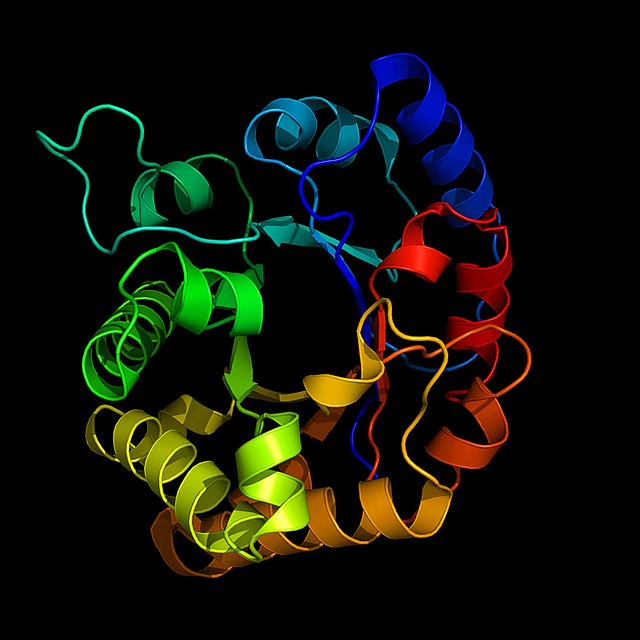

เอนไซม์มีความสำคัญและจำเป็นสำหรับสิ่งมีชีวิต เพราะว่าปฏิกิริยาเคมีส่วนใหญ่ในเซลล์จะเกิดช้ามาก หรือถ้าไม่มีเอนไซม์อาจทำให้ผลิตภัณฑ์จากปฏิกิริยากลายเป็นสารเคมีชนิดอื่น ซึ่งถ้าขาดเอนไซม์ระบบการทำงานของเซลล์จะผิดปกติ (malfunction) เช่น
ดังนั้นการขาดเอนไซม์ที่สำคัญอาจทำให้เกิดโรคร้ายแรงได้ การผ่าเหล่าอาจจะเกิดขึ้นในโครงสร้างบางส่วนของเอนไซม์ หรืออาจเป็นบางส่วนของโปรตีน เช่น
ตัวอย่างเช่น ฟีนิลคีโตนูเรีย (phenylketonuria) เกิดจากการงานบกพร่องของ เอนไซม์ฟีนิลอะลานีน ไฮดรอกซิเลส (phenylalanine hydroxylase) ที่เป็นตัวเร่งปฏิกิริยาการสลายตัวของฟีนิลอะลานีนเป็นผลให้เกิดการสะสมฟีนิลอะลานีนมากและจะแสดงออกมาใน ความผิดปรกติทางจิต (mental retardation)
ให้เกิดปฏิกิริยาเคมี นอกจากนี้ยังเร่งให้เกิดเร็วขึ้นซึ่งสามารถทำให้เร็วได้ถึงหนึ่งในหลายล้านส่วน

ในเอนไซม์ก็เช่นเดียวกับโปรตีนอื่น การทำงานของมันจะถูกกำหนดโดยโครงสร้าง ดังนี้:
ในโปรตีนแต่ละ มอนอเมอร์ จะมีลักษณะเป็นโซ่ยาวของ อะมิโน แอซิด ซึ่งจะพับและทบกันไปมาเป็นโครงสร้าง 3 มิติในแต่ละ มอนอเมอร์ จะเชื่อมต่อและเกาะกันด้วยแรง นอน-โควาเลนต์ (non-covalent interactions) และเกิดเป็น มัลติเมอริก โปรตีน (multimeric protein)

เอนไซม์ส่วนใหญ่จะมีโมเลกุลขนาดใหญ่กว่า ซับสเตรต (substrates) ที่มันจะทำหน้าที่เร่ง และส่วนที่เล็กมากของเอนไซม์เท่านั้น คือขนาดประมาณ 10 อะมิโน แอซิด ที่เข้าจับกับซับสเตรต ตำแหน่งที่เชื่อมต่อกับซับสเตรตแล้วเกิดปฏิกิริยานี้เรียกว่าบริเวณกัมมันต์ (active site) ของเอนไซม์ บางเอนไซม์มีแอคทีฟ ไซต์มากกว่าหนึ่ง และบางเอนไซม์มีแอคตีฟ ไซต์สำหรับ โคแฟกเตอร์ (cofactor) ด้วย บางเอนไซม์มีตำแหน่งเชื่อมต่อที่ใช้ควบคุมการเพิ่มหรือลดฤทธิ์ ของเอนไซม์ด้วย
เอนไซม์จะมีความเฉพาะกับปฏิกิริยาที่มันจะเร่งและซับสเตรต ที่มันจะเกาะ รูปร่างและมุมองศาของของการเข้าหากันของ เอนไซม์ และซับสเตรตมีบทบาทสำคัญต่อความเฉพาะเจาะจง

เอนไซม์ เป็นสิ่งเฉพาะเจาะจงมาก ข้อสมมติฐานนี้ถูกเสนอโดย อีมิล ฟิสเชอร์ (Emil Fischer) ในปี 1894 โดยระบุว่า เอนไซม์ มีรูปร่างเฉพาะที่จะเกาะกับ ซับเตรตนั้น ๆ เท่านั้น ซึ่งมีลักษณะเหมือนลูกกุญแจกับแม่กุญแจ และข้อสมมติฐานล๊อคก์ & คีย์' ยังบอกอีกว่าการเกาะของ เอนไซม์ และ ซับสเตรต จะเกิดเป็นสารประกอบอายุสั้น ซึ่งเรียกว่า ชอร์ต-ไลฟ์ เอนไซม์ ซับเตรต คอมเพล็ก (short-lived enzyme-substrate complex)

ในปี 1958 แดเนียล คอชแลนด์ (Daniel Koshland) ได้เสนอปรับปรุง ข้อสมมติฐานล๊อคก์ & คีย์เอนไซม์มีโครงสร้างที่ยืดหยุ่น แอกตีฟ ไซต์ ของเอนไซม์ จะถูกปรับแต่งให้ซับสเตรตเหมาะที่จะทำปฏิกิริยากับเอนไซม์ โซ่ข้างของกรดอะมิโน ซึ่งทำเป็นแอคทีฟ ไซต์ที่อัดแบบเป็นรูปร่างที่เหมาะกับเอนไซม์ที่จะทำหน้าที่ในการเร่งปฏิกิริยา ในบางกรณีโมเลกุลของ ซับสเตรตจะเปลี่ยนแปลงรูปร่างเล็กน้อยเพื่อที่จะเข้าไปในแอคทีฟ ไซต์ให้ได้ เปรียบดังเช่นว่ามือเปลี่ยนแปลงรูปร่างของถุงมือขณะที่ถุงมือถูกสวมใส่
เอนไซม์หลายตัวไม่ใช่มีเฉพาะโปรตีนแต่ยังมีส่วนที่ดัดแปลงอีก การดัดแปลงเหล่านี้เรียกว่า โพสต์ทรานสเลชันนัล (posttranslational) นั้นคือหลังจากการสังเคราะห์โซ่เพปไทด์จะมีการสังเคราะห์ส่วนเพิ่มเติมเข้าไปในโซ่เพปไทด์ เช่นส่วนของ
ชนิดอื่นของการดัดแปลงแบบ โพสต์ทรานสเลชันนัล คือ การแยกออก และ การเข้าต่อกับโซ่เพปไทด์ เช่นไคโมทริปซิน (chymotrypsin) โปรตีเอส (protease) ที่ใช้ในการย่อยอาหารโปรตีนจะถูกสร้างในรูป อินแอกตีฟ ชื่อ ไคโมทริปซิโนเจน (chymotrypsinogen) ที่ ตับอ่อน ก่อน และถูกส่งไปที่ กระเพาะอาหาร (stomach) เพื่อแอกติเวตให้ทำงานได้ต่อไป ที่เป็นเช่นนี้ก็เพื่อป้องกันไม่ให้เอนไซม์ถูกระบบย่อยอาหารของตับอ่อนหรือเนื้อเยื้ออื่นทำลาย รูปแบบการทำตัวตั้งต้น ที่ไม่ออกฤทธิ์เรียกว่า ไซโมเจน (zymogen)
เอนไซม์บางตัวไม่มีความจำเป็นต้องมีส่วนเพิ่มเติมสำหรับการออกฤทธิ์ให้เต็มที่ แต่อย่างไรก็ดีมีหลายที่ไม่มีฤทธิ์ทางเคมีและต้องการมีส่วนเพิ่มเติมเพื่อให้สามารถออกฤทธิ์ได้ เอนไซม์ โคแฟคเตอร์ คือส่วนประกอบที่ไม่ใช่โปรตีนของเอนไซม์แต่มีความสำคัญต่อการการออกฤทธิ์เร่งปฏิกิริยาของมัน โคแฟคเตอร์ มี 3 ประเภท ดังนี้
เอนไซม์ต้องการไอออนอินทรีย์ เป็น โคแฟคเตอร์ อินทรีย์ไอออนเหล่านี้เรียก แอกติเวเตอร์ โดยหลักใหญ่แล้วพวกมันจะมีโลหะที่เป็น โมโนวาเวเลนต์ หรือ ไดวาเลนต์ แคตไอออน ที่จะเกาะเอนไซม์อย่างหลวม ๆ หรืออย่างแน่นหนาตัวอย่างเช่น การแข็งตัวของเลือด แคลเซียม ไอออน ที่เรียกว่า แฟคเตอร์ IV ถูกต้องการสำหรับการแอกติเวต ทรอมโบไคเนส (thrombokinase) แล้วจะเปลี่ยนไปเป็น โปรทอมบิน (prothrombin) และไปเป็น ทรอมบิน (thrombin)
โคแฟคเตอร์ที่เป็นสารประกอบอินทรีย์ที่ไม่ใช่โปรตีนที่เกาะกับโมเลกุลของเอนไซม์อย่างแน่นหนาเรียกว่า โปรสทีติกกรุปมันเชื่อมต่อส่วนที่ทำหน้าที่เร่งปฏิกิริยาทั้งหมด FAD โคเอนไซม์ที่มีโลหะหนัก มีหน้าที่คล้ายกับ NAD และ NADP ที่จับ ไฮโดรเจน อยู่ ฮีม (Heme) เป็นโปรสทีติกกรุปที่ทำหน้าที่จับอิเล็กตรอนในระบบ ไซโตโคม (cytochrome)
โคแฟคเตอร์ของเอนไซม์บางตัวเป็น โมเลกุลของสารประกอบอินทรีย์ ที่ไม่ใช่โปรตีน เรียกว่า โคเอนไซม์ ซึ่งไม่ได้เกาะกับโมเลกุลของเอนไซม์เหมือน โปรสทีติกกรุป การเป็นอนุพันธ์ของ ไวตามิน พวกมันจะทำหน้าที่เป็น แคร์ริเออร์เพื่อการเคลื่อนย้าย อะตอม ฟังก์ชันนัลกรุป จากเอนไซม์ไปยัง ซับเตรต ตัวอย่างธรรมดาคือ NAD (เป็นสารที่ได้มาจาก นิโคตินิก แอซิดซึ่งเป็นสมาชิกของ ไวตามิน บี คอมเพลกซ์) และ NADP ซึ่งทำหน้าที่เป็นตัวขนย้าย ไฮโดรเจน และ โคเอนไซม์เอ ที่ขนย้าย อะซิทิลกรุป
ส่วนโปรตีนของเอนไซม์ที่ไม่ออกฤทธิ์นี้เรียกว่า อะโปเอนไซม์ อะโปเอนไซม์จะทำงานอย่างมีประสิทธิภาพเฉพาะในที่มีโคแฟคเตอร์ที่ไม่ใช่โปรตีนเท่านั้น อะโปเอนไซม์พร้อมด้วยโคแฟคเตอร์ของมันประกอบด้วยโฮโลเอนไซม์ (holoenzyme) นั้นคือ แอคตีฟเอนไซม์ โคเอ

ปฏิกิริยาทั้งหมดที่ถูกเร่งโดยเอนไซม์จะต้องเป็นไปได้เอง ("spontaneous") ซึ่งจะมี พลังงานอิสระกิบบ์ส (Gibbs free energy) สุทธิเป็นลบ กับเอนไซม์มันก็มันก็เกิดปฏิกิริยาไปในทิศทางเดียวกับอันที่ไม่มีเอนไซม์ และก็เร็วกว่าด้วย อย่างไรก็ดีปฏิกิริยาที่เกิดขึ้นเองโดยไม่ต้องมีตัวเร่ง อาจจะทำให้ได้ผลิตภัณฑ์ที่แตกต่างกันมากกว่าปฏิกิริยาที่มีตัวเร่ง อย่างไรก็ดีเอนไซม์สามารถเร่งปฏิกิริยาได้ 2 หรือมากกว่าในเวลาเดียวกัน เพื่อว่าปฏิกิริยาที่ชอบอุณหพลศาสตร์จะได้สามารถใช้ขับเคลื่อน ("drive") ปฏิกิริยาที่ไม่ชอบอุณหพลศาสตร์ได้ ตัวอย่างเช่น การย่อยสะลายสารประกอบพลังงานสูง อะดีโนซีน ไตรฟอสเฟต บ่อยครั้งใช้ขับเคลื่อนปฏิกิริยาที่ไม่ชอบใช้พลังงาน
หลายปฏิกิริยาที่เร่งโดยเอนไซม์ย้อนกลับ
เอนไซม์จะเร่งปฏิกิริยาไปข้างหน้าและกลับหลังอย่างเท่า ๆ กัน มันจะไม่ทำให้เกิด ความสมดุล (equilibrium) ด้วยตัวของมันเอง เพียงแต่อัตราเร็วเท่านั้นที่มันมีผล ยกตัวอย่างเช่น คาร์บอนิก แอนไฮเดรส (carbonic anhydrase) จะเร่งปฏิกิริยาตามสมการข้างล่างนี้ ตามเงื่อนไขของเวลา
ปฏิกิริยาของเอนไซม์จะดำเนินไปได้อย่างไรนั้นขึ้นอยู่กับปัจจัยที่สำคัญ ดังนี้
นอกจากปัจจัยทั้งสี่ที่กล่าวมาแล้วยังมีสารบางชนิดที่มีผลต่อการทำงานของเอนไซม์ เช่นสารที่ทำให้การทำงานของเอนไซม์ลดลง เรียกว่า ตัวยับยั้ง (inhibitor) ส่วนสาร ที่เร่งการทำงานของเอนไซม์ได้ดีขึ้น เรียกว่า ตัวเร่งเร้า (activator) ตัวยับยั้งบางตัวจะรวมกับเอนไซม์ที่แหล่งกัมมันต์ ทำให้เอนไซม์ไม่สามารถรวมกับ ซับสเตรตได้ ตัวยับยั้งแบบนี้เรียกว่าคอมเพทิทีฟอินฮิบิเตอร์ (competitive inhibitor) ซึ่งจะมีรูปร่างโมเลกุลคล้ายกับซับสเตรต
| การใช้ประโยชน์ | เอนไซม์ที่ใช้ | การใช้ | หมายเหตุ และ ตัวอย่าง |
|---|---|---|---|
| ผงซักฟอกทางชีวภาพ | เริ่มแรก โปรตีเอส (protease) เป็นผลผลิตนอกเซลล์ของ แบคทีเรีย | ใช้สำหรับแช่ผ้าก่อนซักและใช้ซักผ้าเพื่อกำจัดคราบโปรตีนออกจากผ้า |
หมายเหตุ: เอนไซม์อะไมเลส และ โปรตีเอสที่ใช้เป็นผงซักฟอกทำให้เกิดโรคภูมิแพ้ในผู้ใช้ ถึงแม้จะแก้ไขโดยการทำเอนแคปซูเลชันแล้วก็ตาม |
| เอนไซม์อะไมเลส (Amylase enzymes) | ผงซักฟอกสำหรับเครื่องใช้กำจัดคราบแป้งติดแน่น | ||
| อุตสาหกรรมขนมปัง (Baking industry) | เชื้อรา (Fungus) แอลฟ่า-อะไมเลส เอนไซม์: ตามปกติจะหมดฤทธิ์ที่ อุณหภูมิประมาณ 50 องศาเซลเซียส ในระหว่างกระบวนการทำขนมปัง | เร่งปฏิกิริยาการสะลายตัวของแป้งไปเป็นน้ำตาล การทำงานของยีส ในน้ำตาล จะได้ คาร์บอน ไดออกไซด์ ใช้ในการผลิตขนมปังขาว |  |
| เอนไซม์โปรตีเอส (Protease enzymes) | ผู้ผลิตขนมปังกรอบใช้มันลดระดับโปรตีนในแป้ง | ||
| อาหารเด็ก (Baby food) | ทริปซิน (Trypsin) | ช่วยย่อยอาหารก่อนเด็กรับประทาน | |
| อุตสาหกรรมสุรา (Brewing industry) | เอนไซม์จากข้าวบาร์เลย์ที่ปล่อยออกมาในระหว่างขั้นตอนการหมักในกระบวนการผลิตเบียร์ | มันจะทำหน้าที่สะลายแป้งและโปรตีนเป็น น้ำตาล กรดอะมิโน และเพปไทด์ที่ยีสใช้ในกระบวนการหมัก |  |
| ปัจจุบัน มีการนำเอนไซม์ที่ผลิตด้วยกระบวนการทางอุตสาหกรรม มาใช้ในการหมักทำสุราอย่างกว้างขวาง แทนเอนไซม์จากธรรมชาติที่พบในข้าวบาร์เลย์: | |||
| อะไมเลส, กลูคาเนส, โปรตีเอส | ย่อยสลายพอลิแซคคาไรด์และโปรตีนใน มอลท์ | ||
| บีต้ากลูโคซิเดส (Betaglucosidase) | ปรับปรุงคุณลักษณะการกรอง | ||
| อะไมโลกลูโคซิเดส (Amyloglucosidase) | เบียร์ แคลอรีต่ำ | ||
| โปรตีเอส (Proteases) | กำจัดความขุ่นระหว่างการเก็บเบียร์ | ||
| การทำน้ำผลไม้ (Fruit juices) | เซลลูเลส (Cellulases), เปกติเนส (pectinases) | ทำให้น้ำผลไม้ใส | |
| อุตสาหกรรมนม (Dairy industry) | เรนนิน (Rennin), ได้จากกระเพราะอาหารของลูก สัตว์เคี้ยวเอื้อง (วัว,ควาย,กวาง,อูฐ) | การผลิตเนย ย่อยสลายโปรตีน | หมายเหตุ: ตามอายุของสัตว์ที่เพิ่มขึ้นการผลิตเรนนินจะน้อยลง และจะถูกแทนที่ด้วยโปรตีเอสอื่น ซึ่งก็คือ เปปซิน (pepsin) ไม่เหมาะสำหรับการผลิต |
| การผลิตเอนไซม์ทางจุลินทรีย์ | ปัจจุบันเพิ่มปริมาณการใช้มากขึ้นในอุตสาหกรรมนม |  | |
| ไลเปส (Lipase) | ใช้ในระหว่างการผลิต เนยโรควิฟอร์ต (Roquefort cheese) เพื่อเร่งการสุกของ เนยเดนิสบลู (Danish Blue cheese) | ||
| แลคเตส (Lactases) | ย่อยสลายแลคโตส เป็น กลูโคส และ แกแลคโตส | ||
| อุตสาหกรรมแป้ง (Starch industry) | อะไมเลส (Amylases), อะไมโลกลูโคซิดีเอส (amyloglucosideases) และ กลูโคอะไมเลส (glucoamylases) | เปลี่ยนแป้งไปเป็น กลูโคส และ หลายรูปแบบของ น้ำเชื่อม (Inverted sugar syrup) | |
| กลูโคสไอโซเมอเรส (Glucose isomerase) | เปลี่ยนน้ำตาล กลูโคส ในฟรุคโตส (fructose) (น้ำเชื่อมที่มีฟรุคโตสสูงได้จากวัสดุคล้ายแป้งมีความหวานสูงแต่ แคลอรี ต่ำ | ||
| เอนไซม์ที่ทำให้หยุดการเคลื่อนไหว (Immobilised enzymes) | การผลิตน้ำเชื่อมที่มีฟรุคโตสสูง | หมายเหตุ: ถึงแม้กระบวนการนี้จะใช้กันอย่างแพร่หลายในสหรัฐและญี่ปุ่น, แต่กฎหมายใน EEC ก็จำกัดการใช้เพื่อปกป้องชาวนา ซูการ์บีต (sugar beet) | |
| อุตสาหกรรมยาง (Rubber industry) | คาตาเลส (Catalase) | การเติม ออกซิเจน จาก เพอร์ออกไซด์ เพื่อเปลี่ยน ยางลาเท็กซ์ ไปเป็นโฟมรับเบอร์ | |
| อุตสาหกรรมกระดาษ (Paper industry) | อะไมเลส | เพื่อย่อยสะลายแป้งให้มี ความหนืด (viscosity)ลดลง สำหรับการผลิตกระดาษ |  |
| อุตสาหกรรมถ่ายรูป (Photographic industry) | โปรตีเอส (ficin) | ใช้ละลาย เยลาติน (gelatin) ออกจากฟิล์ม เพื่อการนำเงิน กลับมาใช้ใหม่ | |
เอนไซม์ส่วนใหญ่พบมากในพืชตะกูลถั่ว เช่น ถั่วงอก, ถั่วลิสง, ถั่วแขก, ถั่วเขียว, ถั่วแดง, ถั่วเหลือง ช่วยยับยั้งอาการ mutation, overproduction, undrproduction, deletion, ที่เกิดจากปฏิกิริยาเคมีในการรับประทานอาหารในแต่ละวัน เอนไซม์จะเสื่อมคุณภาพเมื่อโดนความร้อนสูงมากพอ
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.