அசைல் குளோரைடு
கார்பாக்சிலிக் அமிலங்களுடைய வினைத்திறன் மிக்க வழிப்பெறுதி From Wikipedia, the free encyclopedia
அசைல் குளோரைடு (Acyl chloride) என்பது RCOCl என்ற பொது மூலக்கூற்று வாய்ப்பாட்டால் குறிக்கப்படும் ஒரு வகையான கரிமச் சேர்மமாகும். இதை அமிலக் குளோரைடு என்ற பெயராலும் அழைப்பார்கள். பொது வாய்ப்பாட்டிலுள்ள -COCl. என்பது வேதி வினைக்குழுவையும் R என்பது பக்கச் சங்கிலியையும் குறிக்கிறது. கார்பாக்சிலிக் அமிலங்களுடைய வினைத்திறன் மிக்க வழிப்பெறுதிகளாக இவை கருதப்படுகின்றன. அசைல் குளோரைடுகள் என்ற வகைச் சேர்மங்களில் அசிட்டைல் குளோரைடு (CH3COCl) என்ற சேர்மத்தை சிறப்பு உதாரணமாகக் கருதலாம். அசைல் ஆலைடுகள் என்ற வகைபாட்டில் அடங்கியுள்ள துணைப்பிரிவு அசைல் குளோரைடுகள் என்ற பிரிவாகும்.

பெயரிடல்
இவ்வகைச் சேர்மங்களைப் பெயரிடுகையில் அசைல் குளோரைடின் பங்கு இங்கு முன்னிலை பெறுகிறது. மூலமான கார்பாக்சிலிக் அமிலத்தின் பெயரில் இருக்கும் ’யிக்’ அமிலம் என்பதற்குப் பதிலாக ’ஐல்’ குளோரைடு என்ற பதிலியைச் சேர்த்து பெயரிடுகிறார்கள். இதனடிப்படையில்,
அசிட்டைல் குளோரைடு CH3COCl
பென்சாயில் குளோரைடு C6H5COCl
என்பவை பெயரிடப்படுகின்றன. மற்ற வேதி வினைக்குழுக்கள் முன்னிலை பெறும்போது அசைல் குளோரைடுகள் முன்னொட்டுகளாக -குளோரோ கார்பனைல்- என இடம்பெறுகின்றன :[1].
- (குளோரோகார்பனைல்)அசிட்டிக் அமிலம் ClOCCH2COOH
பண்புகள்
ஐதரசன் பிணைப்புகளாக உருவாகும் திறன் இல்லாமல் இருப்பதால் ஒத்த கார்பாக்சிலிக் அமிலங்களைப் போல அமிலக் குளோரைடுகள் குறைவான உருகுநிலையும் கொதிநிலையும் கொண்டவையாக உள்ளன. உதாரணமாக அசிட்டிக் அமிலம் 118 பாகை செல்சியசு வெப்பநிலையில் கொதிக்கிறது. இதேபோல அசிட்டைல் குளோரைடு 51 பாகை செல்சியசு வெப்பநிலையில் கொதிக்கிறது. பல்வேறு கார்பனைல் சேர்மங்களைப் போல அகச்சிவப்பு நிறமாலையியல் ஆய்வில் 1750 செ.மீ−1 இக்கு அருகிலான கற்றையை இது வெளிப்படுத்துகிறது.
நிலைப்புத்தன்மை கொண்ட எளிய அசைல் குளோரைடு எத்தனாயில் குளோரைடு அல்லது அசிட்டைல் குளோரைடு ஆகும். மெத்தனாயில் குளோரைடு நிலைப்புத்தன்மையற்றது ஆகும் [2].
தயாரிப்பு
தொழிற்சாலை முறைகள்
அசிட்டிக் நீரிலியுடன் ஐதரசன் குளோரைடு சேர்த்து வினைபுரியச் செய்வதன் மூலமாக அசிட்டைல் குளோரைடு தயாரிப்பது தொழிற்சாலை முறை தயாரிப்பு முறையாகும் [3]. பென்சாயில் குளோரைடு தயாரிக்க வேண்டுமெனில் பென்சோடிரைகுளோரைடை பகுதியாக நீராற்பகுப்பு செய்வது பயனுள்ள வழிமுறையாகக் கருதப்படுகிறது:[4]
- C6H5CCl3 + H2O → C6H5C(O)Cl + 2 HCl.
ஆய்வகத் தயாரிப்பு முறைகள்
ஆல்க்கைல் குளோரைடுகளை ஆய்வகத்தில் தயாரிப்பது போலவேதான் பொதுவாக அசைல் குளோரைடுகளும் தயாரிக்கப்படுகின்றன. இத்தயாரிப்பு முறையில் தொடர்புடைய ஐதராக்சி பதிலீடுகள் இடப்பெயர்ச்சி செய்யப்பட்டு குளோரைடுகள் இடம்பெறுகின்றன. இதன்படி கார்பாக்சிலிக் அமிலங்கள் தயோனைல் குளோரைடுகளுடன் (SOCl2) [5], பாசுபரசு முக்குளோரைடு (PCl3) [6] அல்லது பாசுபரசு ஐங்குளோரைடு (PCl5) :[7][8] சேர்த்து சூடுபடுத்தப்படுகின்றன
- RCOOH + SOCl2 → RCOCl + SO2 + HCl
- 3 RCOOH + PCl3 → 3 RCOCl + H3PO3
- RCOOH + PCl5 → RCOCl + POCl3 + HCl
மேற்கண்ட தயோனைல் குளோரைடுடன் சேர்ந்து ஈடுபடும் வினையானது டைமெத்தில்பார்மமைடு சேர்மத்தால் வினையூக்கம் செய்யப்படுகிறது[9]. இவ்வினையில் உருவாகும் கந்தக டையாக்சைடும், ஐதரசன் குளோரைடும் வாயுக்களாகும். இவை வினை கலனை விட்டு வெளியேறி வினையை முன்னோக்கி செலுத்துகின்றன. மிகுதியாக உள்ள தயோனைல் குளோரைடு 74.6 பாகை செல்சியசு வெப்பநிலையில் கொதிக்கும் என்பதால் எளிதாக ஆவியாக்கப்படுகிறது[8].தயோனைல் குளோரைடு மற்றும் பாசுபரசு ஐங்குளோரைடு பங்கு பெறும் வினைகளின் வினைவழிமுறை ஒரேமாதிரியானவைகளாகும். தயோனைல் குளோரைடு பங்குகொள்ளும் வினையின் வினைவழிமுறை இங்கு விளக்கப்பட்டுள்ளது:[9]
மற்றொரு முறையில் ஆக்சாலில் குளோரைடு பங்கேற்கிறது
- RCOOH + ClCOCOCl → RCOCl + CO + CO2 + HCl
டைமெத்தில்பார்மமைடு இவ்வினையை வினையூக்கம் செய்கிறது. முதல் படிநிலையில் ஆக்சாலில் குளோரைடுடன் வினையூக்கி வினைபுரிந்து இனிமியம் இடைநிலைச் சேர்மத்தைக் கொடுக்கிறது.
இனிமியம் இடைநிலை கார்பாக்சிலிக் அமிலத்துடன் வினைபுரிந்து ஓர் ஆக்சைடு தொகுப்பாக உருவாகி டைமெத்தில்பார்மமைடு வினையூக்கியை மீளுருவாக்கம் செய்கிறது..[9]
இறுதியாக HCl உருவாகாத ஆப்பெல் வினை போன்ற தயாரிப்பு முறைகளும் அறியப்பட்டன. :[10]
- RCOOH + Ph3P + CCl4 → RCOCl + Ph3PO + HCCl3
வினைகள்
அணுக்கருகவர் வினைகள்
அசைல் குளோரைடுகள் மிகவும் வினைத்திறன் மிக்கவை. இவற்றினுடைய RCOOH அமில ஒத்தவரிசை சேர்மங்களுடன் ஒப்பிடுகையில் குளோரைடு அயனி ஒரு சிறந்த விடுபடும் குழு ஆகும். ஆனால் அதே நேரத்தில் ஐதராக்சைடு சாதாரண நிலைகளில் அவ்வாறு இருப்பதில்லை. அதாவது பலவீனமான அணுக்கருகவரிகளும் கூட கார்பனைலை தாக்குகின்றன. தண்ணீருடன் வினைபுரிந்து கார்பாக்சிலிக் அமிலத்தை விளைவிக்கும் வினையே விரும்பப்படாத ஒரு பொதுவான வினையாகும்.
- RCOCl + H2O → RCO2H + HCl
அமிலக்குளோரைடுகளுடன் கார்பாக்சிலிக் அமிலத்தின் உப்பு, ஓர் ஆல்ககால் அல்லது ஓர் அமீன் வினைபுரிவதால் முறையே அமில நீரிலிகள், எசுத்தர்கள், மற்றும் அமைடுகள் உள்ளிட்ட கார்பாக்சிலிக் அமில வழிப்பெறுதிகள் தயாரிக்க அசைல் குளோரைடுகள் பயன்படுத்தப்படுகின்றன. நீரிய சோடியம் ஐதராக்சைடு அல்லது பிரிடின் அல்லது மிகையான அமீன் போன்ற காரங்கள் உடன் விளைபொருளாக ஐதரசன் குளோரைடு உருவாதலை தடுக்கவும் வினையை வினையூக்கம் செய்யவும் பயன்படுகின்றன. கார்பாக்சிலிக் அமிலங்களுடன் ஆல்ககால்கள் அல்லது அமீன்கள் வினைபுரிந்து பெரும்பாலும் எசுத்தர்களும் அமைடுகளும் உருவாக சாத்தியமுண்டு. வினைகள் தலைகீழானவை என்பதால் விளைபொருளின் அளவு குறைவாக இருக்கும். மாறாக எசுத்தர் மற்றும் அமைடுகளை அசைல் குளோரைடுகள் வழியாக தயாரிக்க உதவும் இரண்டு முறைகளும் விரைவானவையாகவும் மீளா வினைகளாகவும் நிகழ்கின்றன. இதனால் கார்பாக்சிலிக் அமிலத்துடனான ஒருபடிநிலை வினைக்கு பதிலாக இரண்டுபடிநிலை வினை விரும்பப்படுகிறது[8].
கிரிக்னார்டு வினையாக்கிகள் போன்ற கார்பன் அணுக்கரு கவரிகளுடன் வினைபுரிந்து அசைல் குளோரைடுகள் பொதுவாக முதலில் கீட்டோன்களைக் கொடுக்கின்றன. பின்னர் இரண்டாவது வினையில் அதற்குச் சமமான மூவிணைய ஆல்ககாலைக் கொடுக்கின்றன. கரிமகாட்மியம் வினையாக்கிகள் போன்ற சில சேர்மங்களுடன் அசைல் ஆலைடுகள் ஈடுபடும் வினை மட்டும் இதற்கு விதிவிலக்காகும். இவை கீட்டோன் படிநிலையிலேயே நின்றுவிடுகின்றன. இலித்தியம் இருகரிமத் தாமிர சேர்மங்கள் போன்ற கில்மேன் வினையாக்கிகளுடனான அணுக்கருக் கவர் வினையிலும் அவற்றினுடைய வினைத்திறன் குறைவு காரணமாக கீட்டோன்கள் உண்டாகின்றன [8].அரோமாட்டிக் அமிலங்களின் அமிலக் குளோரைடுகள் ஆல்க்கைல் அமிலங்களைக் காட்டிலும் பொதுவாக வினைத்திறன் குறைந்தவையாகும். இதனால் வினைகளுக்கு வன்மையான சில நிபந்தனைகள் அவசியமாகின்றன. இலித்தியம் அலுமினியம் ஐதரைடு மற்றும் டையைசோபியூட்டைல்லலுமினியம் ஐதரைடு போன்ற வலிமையான ஐதரைடு வழங்கிகளால் அசைல் குளோரைடுகள் ஒடுக்கப்பட்டு முதல்நிலை ஆல்ககால்களைக் கொடுக்கின்றன. இலித்தியம் டிரை-டெர்ட்-பியூட்டாக்சி அலுமினியம் ஐதரைடு போன்ற ஐதரைடு வழங்கிகள் அசைல் குளோரைடுகளை ஆல்டிகைடுகளாக மாற்றுகின்றன. ரோசினமன்டு ஒடுக்க வினையில் நஞ்சூட்டப்பட்ட பலேடியம் வினையூக்கியின் மீது ஐதரசன் வாயுவைச் செலுத்துவது போல இவ்வினை நிகழ்கிறது.
எலக்ட்ரான் கவர் வினைகள்
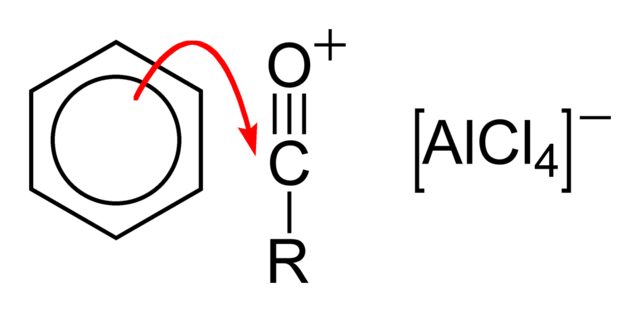
பெரிக் குளோரைடு அல்லது அலுமினியம் குளோரைடு போன்ற் லூயிசு அமில வினையூக்கிகளுடன் வினைபுரியும் போது அசைல் குளோரைடுகள் பிரைடல் கிராப்ட்சு அசைலேற்ற வினையில் பங்கேற்று அரைல் கீட்டோன்களைக் கொடுக்கின்றன :[6][8].
முதல் படிநிலையில் லூயிசு அமிலம் குளோரைடு பிரிகையைத் தூண்டுகிறது.
இதைத் தொடர்ந்து அரீன் அசைல் குழுவை நோக்கி அணுக்கருகவரி தாக்குதலை நிகழ்த்துகிறது.
இறுதியாக குளோரின் அயனி வெளிப்படும் புரோட்டானுடன் இணைந்து HCl உருவாகிறது. AlCl3 வினையூக்கி மீளுருவாக்கம் செய்யப்படுகிறது.
கடுமையான நிபந்தனைகள் மற்றும் இடைநிலைகளின் வினைகளால் பயனுள்ள இவ்வினை குளறுபடிக்கு உள்ளாகிறது. உடல்நலத்துக்கும் சுற்றுச்சூழலுக்கும் கேடு விளைவிப்பதிலும் முடிகிறது.
தீங்குகள்
அசைல் குளோரைடுகள் இத்தகைய வினைத்திரன் மிக்க சேர்மங்கள் என்பதால், அவற்றை கையாளும்போது முன்னெச்சரிக்கைகள் எடுக்கப்பட வேண்டும். கண்களுக்கு மேற்பரப்பில் உள்ள தண்ணீருடன் வினைபுரிந்து ஐதரோகுளொரிக் அமிலம் மற்றும் கரிம அமிலங்களை உருவாக்கும் தன்மை கொண்டவை என்பதால் கண்களுக்கு எரிச்சலூட்டும் பொருளாக கருதப்படுகின்றன. அசைல் குளோரைடுகளை உள்ளிழுக்க நேர்ந்தாலும் இதே போன்ற சிக்கல்கள் ஏற்படலாம்.
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.