Toppfrågor
Tidslinje
Chatt
Perspektiv
Kol
grundämne Från Wikipedia, den fria encyklopedin
Remove ads
Kol (latin: Carbo) är ett grundämne som har det kemiska tecknet C och atomnumret 6. Livet vi känner är baserat på grundämnet kol. Av detta skäl kallas alla molekyler, där kol- och väteatomer ingår, för organiska. Oorganiska ämnen är således de ämnen som innehåller vilket som helst av de övriga grundämnena, utom både kol och väte samtidigt. Trots detta känner vi idag till fler organiska ämnen än icke-organiska.
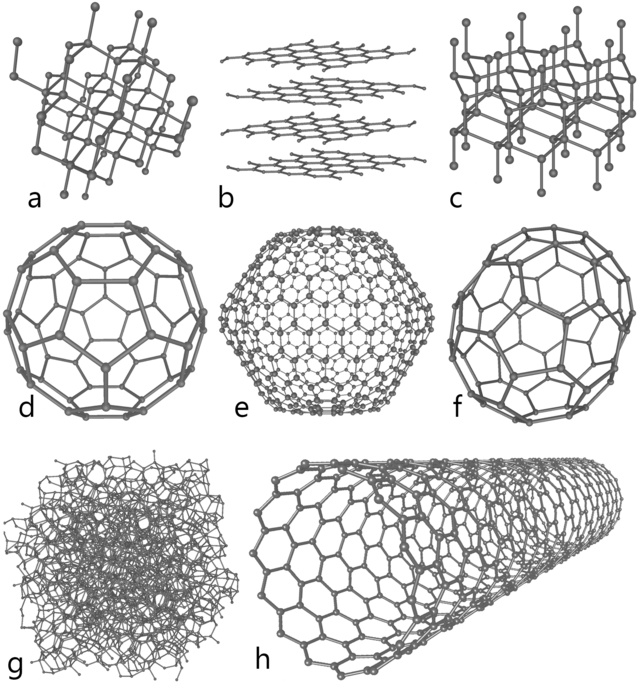
Som rent material förekommer kol i flera olika former (allotroper), som grafit, diamant, fullerener och amorft kol.
Det rena kolets egenskaper och dess användning beskrivs under respektive uppslagsord (se nedan). Grafit, diamant och stenkol bryts i gruvor. Alla allotroper av kol är kemiskt motståndskraftiga, men kan oxideras med syre eller halogener. Kol finns med några procents halt i de flesta sorters stål och järn. Kolet är då legerat i järnet och bidrar till järnets hårdhet.
Av de oorganiska kemiska kolföreningarna kan speciellt nämnas:
- Kiselkarbid (SiC) – ett mycket hårt syntetiskt ämne som bland annat används som slipmedel.
- Koldioxid (CO2) – spelar stor biologisk roll, och produceras när levande varelser andas, används för att få piff på läskedrycker och för viss eldsläckning. Koldioxid är även en viktig växthusgas.
- Kolmonoxid (CO) – en mycket giftig gas som produceras vid ofullständig förbränning, men som också används för ett stort antal tekniskt–kemiska processer, bland annat nickelframställning.
- Karbonater (metall + CO32−) – många former förekommer i naturen som mineral.
- Cyanider (ämne + CN−) – mycket giftiga eftersom de liksom kolmonoxid har förmågan att förhindra syreupptagning genom att blockera hemgruppen i hemoglobin.
Kol ingår också i alla organiska föreningar, där dess förmåga att bilda kedjor är en förutsättning för livets komplexa molekyler.
Kol är universums fjärde vanligaste atomslag. Endast väte, helium och syre är vanligare.
”Kol” är också en beteckning på ett antal bränslen i fast form (se vidare artikeln ”Kol (bränsle)”) med en hög andel av grundämnet kol. Inget av dem utgörs dock av grundämnet i ren form, vilket ibland skapar viss begreppsförvirring på svenska. På de flesta andra språk har grundämnet och bränslet olika namn, exempelvis carbon (grundämnet) respektive coal (bränslet) på engelska och Kohlenstoff (grundämnet) respektive Kohle (bränslet) på tyska.
Remove ads
Historia

Diamant, grafit och förbränningskol har varit känt sedan urminnes tid, och det antas också att man har känt till att de var olika former av ett och samma ämne. Engelsmannen John Dalton var dock den förste som förstod att kol var ett grundämne (1803) – ett resultat som inte publicerades förrän 1807. Den senast upptäckta formen (grafen) fick 2010 års nobelpris i fysik.
Artificiella diamanter framställdes första gången av fransmannen Henri Moissan (1893).[22]
Remove ads
Användning
- Grafit används som smörjmedel och, blandad med lera, till blyertspennor.
- Diamant används till skärverktyg, borrkronor och smycken.
- Stenkol – som är en oren form av kol – används som bränsle. Efter upphettning, utan lufttillträde, erhålls stadsgas, stenkolstjära och koks av stenkol.
- Träkol – även det en oren form av kol – används bland annat i svartkrut till fyrverkerier.
- Aktivt kol används i filter samt medicinskt vid förgiftningar.
Remove ads
Orbitaler
Anledningen till att ämnet kol förekommer i en sådan mångfald av former är att dess elektronkonfiguration gör att det har exakt fyra valenselektroner. Dessa kan hybridiseras på tre olika sätt (sp3, sp2 och sp), vilket innebär att en kolatom kan bilda en enkel-, dubbel- eller trippelbindning till en annan kolatom. Kol kan därmed skapa extremt starka riktade kovalenta bindningar mellan atomer.
Isotoper
Kol har endast två stabila isotoper, nämligen 12C (vars massa atommassenheten u definieras utifrån) och 13C. Av de radioaktiva isotoperna är 14C den klart viktigaste, eftersom dateringsmetoden 14C-metoden baseras på dess sönderfall. Eftersom alla livsformer på jorden är kolbaserade – och 14C ständigt nybildas i atmosfären – kommer det att upptas i alla levande organismer och förhållandet mellan 14C och de stabila isotoperna kommer att vara någorlunda konstant under organismens livstid, med undantag för långlivade arter som träd (vilka å andra sidan kan användas för att kalibrera skalan). När organismen dör börjar 14C direkt sönderfalla till kväve. Eftersom halveringstiden för 14C är 5 730 år har det förutom att det ingår i alla levande organismer i någorlunda höga halter dessutom fördelen att det sönderfaller över en tidsskala som är lämplig för att mäta mänskliga aktiviteter, och är därför ett ovärderligt verktyg för arkeologer. Emellertid, ju äldre materialet är desto mindre precis blir den, och den kan därför knappast användas för föremål som är äldre än 40 000 år.
Remove ads
Former
Sammanfatta
Perspektiv
Kristallint kol antar flera former, med kraftigt varierande egenskaper:
- Diamant – ett av de hårdaste ämnena människan känner till som förekommer naturligt. Det används därför som skärverktyg och i borrspetsar. Dessutom är den en ädelsten och används ofta i smycken.
- Grafit – kol ordnat i lager, där bindningarna i varje lager är mycket starka medan bindningarna mellan lagren är betydligt svagare. Detta gör att grafit används i både blyertspennor och som smörjmedel. Endast ett enkelt lager av grafit kallas grafen.
- Fullerener – kolatomer formade i ”bollar” eller nanorör, med ett flertal olika möjliga varianter av båda. Båda har intressanta egenskaper för nanoteknik, bland annat för att rören är extremt hållfasta samtidigt som den elektriska ledningsförmågan varierar mellan olika varianter av dem.
- Grafen – ett material som till stora delar har samma egenskaper och uppbyggnad som grafit. Till skillnad från grafit utgörs grafen av en ytterst tunn skiva, endast en atom tjock. Atomerna är ordnade i ett hexagonalt mönster vilket ger materialet ett antal unika egenskaper utöver de som delas med grafit. Grafen upptäcktes av Andre Geim och Konstantin Novoselov som fick Nobelpriset i fysik år 2010 för upptäckten.[23] Grafen är mycket speciellt på grund av att det är just en atom tjockt men kan ändå bära vikten av en katt ifall man formade ett "lakan" av det. Styrkan i materialet är 300 gånger den hos stål, dessutom har materialet en utmärkt förmåga att leda elektricitet.
Utöver de kristallina formerna förekommer rent kol i naturen i varierande blandningar av amorft och kristallint kol, till exempel som sot eller stenkol.
Remove ads
Galleri
- Stiften i blyertspennor består av grafit
- En solid kiselkarbidkristall (SiC)
- Kol är basen i alla moderna plastprodukter
- En oslipad diamant
Se även
Referenser
Externa länkar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads