From Wikipedia, the free encyclopedia
Метан (), познат и као блатни гас је најпростији засићени угљоводоник (алкан). Уколико владају нормални услови он је безбојан гас. У природи метан настаје услед бескисеоничног распада органских материја (нпр. у мочварама). Метан је главни састојак земног гаса. Користи се као гас за грејање и као сировина за добијање органских једињења. Запаљен гори светлим модрикастим пламеном, а његовим сагоревањем у присуству кисеоника настаје угљен-диоксид и вода. Нерастворан је у води, а у смеши са ваздухом врло експлозиван. Релативно велика количина метана на Земљи даје му статус алтернативног, атрактивног извора енергије. Међутим, пошто је на нормалној температури и притиску у гасовитом стању, метан је веома тешко транспортовати из његових налазишта. Као гас, обично се превози путем гасовода или цистернама утечњен као течност на температури испод -162 °C (као ).
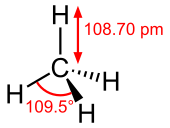 | |||
| |||
| Називи | |||
|---|---|---|---|
| Преферисани IUPAC назив
Метан[1] | |||
| Системски IUPAC назив
Карбан (није препоручен[1]) | |||
Други називи
| |||
| Идентификација | |||
3Д модел () |
|||
| B01453 | |||
| Бајлштајн | 1718732 | ||
| 100.000.739 | |||
| број | 200-812-7 | ||
| Гмелин Референца | 59 | ||
| KEGG[2] | |||
| MeSH | Methane | ||
| PA1490000 | |||
| UN број | 1971 | ||
| Својства | |||
| 4 | |||
| Моларна маса | 16,04 g·mol−1 | ||
| Агрегатно стање | Безбојни гас | ||
| Мирис | Без мириса | ||
| Густина | |||
| Тачка топљења | −182,5 °C; −296,4 °F; 90,7 K | ||
| Тачка кључања | −161,50 °C; −258,70 °F; 111,65 K[6] | ||
| 22,7 mg·L−1 | |||
| Растворљивост | Растворан у етанолу, диетил етру, бензену, толуену, метанолу, ацетону и није растворан у води | ||
| 1,09 | |||
| 14 | |||
| Конјугована киселина | Метанијум | ||
| Конјугована база | Метил анјон | ||
| Магнетна сусцептибилност | −12,2×10−6 | ||
| Структура | |||
| Облик молекула (орбитале и хибридизација) | Тетраедар | ||
| Диполни момент | 0 | ||
| Термохемија | |||
| Специфични топлотни капацитет, | 35,69 −1 | ||
Стандардна моларна ентропија (S |
186,25 −1 | ||
Стандардна енталпија стварања (ΔfH |
−74,87 −1 | ||
Стд енталпија сагоревања (298) |
−891,1 до −890,3 −1 | ||
| Опасности[7] | |||
| ГХС пиктограми |  | ||
| ГХС сигналне речи | Опасност | ||
| H220 | |||
| P210 | |||
| NFPA 704 | |||
| Тачка паљења | −188 °C (−306,4 °F; 85,1 K) | ||
| 537 °C (999 °F; 810 K) | |||
| Експлозивни лимити | 4,4–17% | ||
| Сродна једињења | |||
Сродна алкани |
|||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
Молекул метана има облик тетраедра. Атом угљеника с има хибридизацију. Остале орбитале граде хемијску везу са четири атома водоника. Све четири везе су подједнаке (углови између веза износе 109°28') и веома су мало поларизоване, што је заједно са недостатком слободних електронских парова велике постојаности овог једињења. Метан може да учествује само у реакцијама типичним за алкане (нпр: сагоревање).
Метан има потенцијално деловање као стакленички гас са високим потенцијалом за глобално затопљење са индексом од 72 (уз просек од 20 година) односно индексом 25 (уз просек од 100 година)[9]. Метан се у атмосфери оксидује, производећи угљен-диоксид и воду. Због тога, метан у атмосфери има полувреме постојања од око седам година.
Распрострањеност метана у Земљиној атмосфери у току 1998 године је процењена на 1745 (милијардити део, ), а процењује се да се у 1750. години у атмосфери налазило око 700 . Метан може задржавати и до 20 пута више топлоте од угљен-диоксида. У истом периоду (1750—1998) количина 2 у атмосфери је порасла са 278 на 365 . Топлотни ефект због овог повећања количине метана је око једне трећине од истог ефекта повећања 2[10]. Поред тога, постоје огромне али непознате количине метана у облику метан хидрата на дну океана. Земљина кора такође садржи огромне количине метана. Велике количине се произведу анаеробним путем метаногенезе. Остали извори метана су вулканске ерупције и ферментацијом унутар стоке (крава, оваца, коња и других животиња).
Реч метан вероватно потиче из старогрчког језика. Већ се у време античке Грчке знало о запаљивом гасу. Тако су у Малој Азији постојала места извора метана. Вулканско подручје, у којем су пронађени такви гасови, је добило име по овом гасу.
Метан је био познат и алхемичарима у средњем веку као саставни део гасова који настају при распадању, а имао је и име мочварни гас. Метан је открио Томас Ширли 1667. године. Џозеф Пристли је открио 1772. године да метан настаје при процесима распадања. Алесандро Волта га је изоловао између 1776. и 1778. године док је студирао мочварни гас из језера Мађоре. Године 1856. Марселин Бертело је први синтетизирао метан из угљен-дисулфида и водоник-сулфида.
Лабораторијски метан се добија пржењем натријум октана са натријум хидроксидом:
Друга метода је хидролиза алуминијум карбида:
Метан је једна од основних компонената земног гаса, од око 87% по запремини. На собној температури и стандардном притиску, метан је безбојни гас, без мириса и укуса. Наводни мирис земног гаса, који се користи у домаћинству, је вештачки направљен као једна од сигурносних мера, додавањем одоранта, најчешће метантиола или етантиола. Метан има тачку кључања од око -161 °C при притиску од једне атмосфере. Као гас је лако запаљив, већ при мањим концентрацијама у ваздуху (5-15%). Течни метан није запаљив све док се не изложи великом притиску (обично 4-5 атмосфера).
Мешавина метана са ваздухом у размери 1:10 има експлозивно дејство. Настанак овакве смеше у рудницима је често разлог великих експлозија и смрти многих људи. Велике количине метана се налаза на планетама у облику мора (као што на земљи постоје мора воде, тако на неким планетама постоје мора метана)
Метан није отрован. Међутим, веома је запаљив и у смеси са ваздухом може бити експлозиван. Бурно реагује са оксидационим средствима, халогеним елементима и супстанцама које садрже халогене. Метан је асфиксиони гас, што значи да може истиснути кисеоник у затвореним просторијама, али су концентрације при којима он може експлодирати или запалити се, далеко ниже од концентрација на којима се може развити ризик од гушења. Највећа опасност од експлозије мешавине метана и ваздуха постоји у рудницима угља.
Основне реакције у које ступа метан су: горење, халогенација и активација водоника. Генерално, реакције метана је доста тешко контролисати. На пример, врло тешко је доћи до делимичне оксидације метанола, јер се реакција обично наставља све до настанка угљен-диоксида и воде.
При сагоревању метана, дешавају се бројне реакције:
Верује се да метан формира формалдехид ( или ). Формалдехид даје формил радикал (), који даље формира угљен моноксид (). Овај процес се назива оксидативна пиролиза:
У току оксидативне пиролизе, 2 се оксидује дајући воду () отпуштајући топлоту. Ово се дешава веома брзо, обично за мање од једне милисекунде.
На крају, се оксидује дајући 2 и отпушта још више топлоте. Овај процес је генерално спорији од других хемијских корака и обично траје неколико милисекунди.
Резултат горњих реакција је следећа тотална реакција:
Јачине ковалентне везе између угљеника и водоника у молекулу метана су међу најснажнијим међу свим угљоводоницима, те је њихово кориштење у хемијским реакцијама ограничено. Поред високе границе активације за разбијање веза, метан је и даље главни почетни материјал за алкане у областима истраживања и са изузетним индустријским значајем. У метановом молекулу везе затварају угао од 109,5 степени.
Метан реагује са свим халогеним елементима, у датим условима и околностима:
где је X неки халогени елемент: флуор (), хлор (), бром () или јод (). Овај механизам за овај процес се назива халогенација слободним радикалима. Ако су метан и халогени елемент (X2) употребљени у еквимоларним количинама, могу се формирати , па чак и . Користећи веће количине метана, смањује се производња , , , а више се формира .
Метан је важан за производњу електричне енергије путем сагоревања као горива у гасним турбинама или парним бојлерима. У поређењу са фосилним горивима, сагоревањем метана се производи мање угљен-диоксида по јединици отпуштене топлоте. Са око 890,8 топлоте при сагоревању метана[11], иако је најједноставнији угљеноводоник, даје више топлоте по јединици масе него други комплекснији угљеноводоници. У многим насељима, метан се транспортује цевима до домаћинстава у сврху грејања. У овом контексту је обично познат као земни гас, а има енергетску вредност од око 39 по 3.
Метан у облику компресованог природног гаса () се користи као погонско гориво, а сматра се да проузрокује мање загађење од других фосилних горива попут нафте и дизела[12].|first=Clayton B. је вршила одређена истраживања о потенцијалу метана као ракетног горива[13]. Једна од предности метана је да је присутан у многим деловима сунчевог система, те би се потенцијално могао експлоатирати на површини других небеских тела, дајући гориво за путовање[14].
Тренутно се развијају мотори на метански погон који могу да развију потисак од 7.500 фунти, што је далеко мање од 7 милиона фунти неопходних да се лансира Спејс Шатле. Уместо тога, такви мотори би се могли користити за погон летелица са површине Месеца или слање роботских експедиција на друге планете сунчевог система[15].
Недавно, метан који настаје у рудницима угља је успешно искориштен у производњи електричне енергије[16].
Метан се користи у процесима хемијске индустрије а може се транспортовати у виду охлађеног текућег (). Иако је као гас лакши од ваздуха, у течном, охлађеном стању је тежи од ваздуха због повећања густине. Путем гасовода се дистрибуирају велике количине природног гаса, у којем је метан главна компонента.
У хемијској индустрији, метан је један од главних ресурса у производњи водоника, метанола, сирћетне киселине и ацетатног анхидрида. При производњи ових супстанци, метан се прво конвертује у гас за синтезу, мешавину угљен моноксида и водоника деловањем паре. У том процесу, метан и пара реагују на високим температурама (700-1000 °C) уз никл као катализатор.
Однос угљен моноксида и водоника у гасу за синтезу може бити подешен преко реакције отклона воденог гаса на одређену вредност у зависности од намераване сврхе употребе.
Мање значајне хемикалије које се изводе из метана су ацетилен, добијен проласком метана кроз електрични лук, и хлорометани (хлорометан, метилен хлорид, хлороформ и угљен тетрахлорид, који се добијају реакцијом метана са хлором. Међутим, употреба ових хемикалија све више опада. Ацетилен је замењен јефтинијим супституентима, а кориштење хлорометана је упитно због ризика по здравље и загађење околине.
Највећи извор метана је његово издвајање из геолошких депозита познатих као поља природног плина. Углавном је повезан са другим угљоводоничним горивима, а понекад и са хелијумом и азотом. Метан под ниским притиском се формира при анаеробном разлагању органских материјала, те у природним изворима из великих дубина Земљине коре. Генерално, седименти који се налазе на већим дубинама и који су изложени вишим температурама од оних из којих настаје нафта, обично се претварају у природни гас. Метан се такође производи у већим количинама при распадању органског отпада на одлагалиштима смећа.
Поред поља гаса, алтернативни начин добијања метана је путем биогаса који се генерише ферментацијом органских материјала укључујући отпадне воде, смеће те друге отпадне материјале који садрже органске материје. Ферментацијом тих материјала у условима без присуства ваздуха (кисеоника) настаје, између осталих, метан. Метан хидрат (комбинација метана и леда, нађен је у огромним количинама на дну океана) потенцијални је извор метана у будућности. Метан настао преживањем крава чини око 16% светске годишње емисије метана у атмосферу[17]. Генерално, сектор сточарства (углавном краве, кокошке и свиње) производи око 37% метана којем је, директно или индиректно, узрок човек[18]. Ранија истраживања се пронашла бројне медицинске третмане и начине прилагођавања исхране стоке којима се помаже смањење производње метана код преживара[19][20][21].
Научни експерименти су дали различите резултате код испитивања да ли су живе биљке извор емисије метана[22][23][24].
Метан је откривен или се претпоставља да постоји на бројим местима у сунчевом систему. Верује се да настаје у небиотичким процесима, уз изузетак на Марсу, где се претпоставља да га производе микроорганизми.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.