Глукоза (од грч. — „сладак”) је најраспрострањенији моносахарид у природи,[6] међутим само као изомер који се зове декстроза или грожђани шећер.[7] Може да се нађе у крви свих сисара, као и у меду и грожђу. Молекули сложенијих угљених хидрата, као што су скроб и целулоза, настају од великог броја молекула глукозе.[8] Глукоза има врло сладак укус, лако је растворљива у води, а такође је и неопходна за одржавање живота, јер кад се разгради у цитоплазми живе ћелије ослобађа велике количине енергије потребне за многе животне функције.
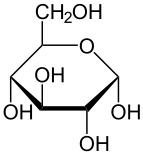
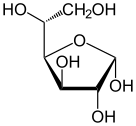
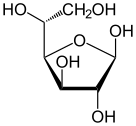
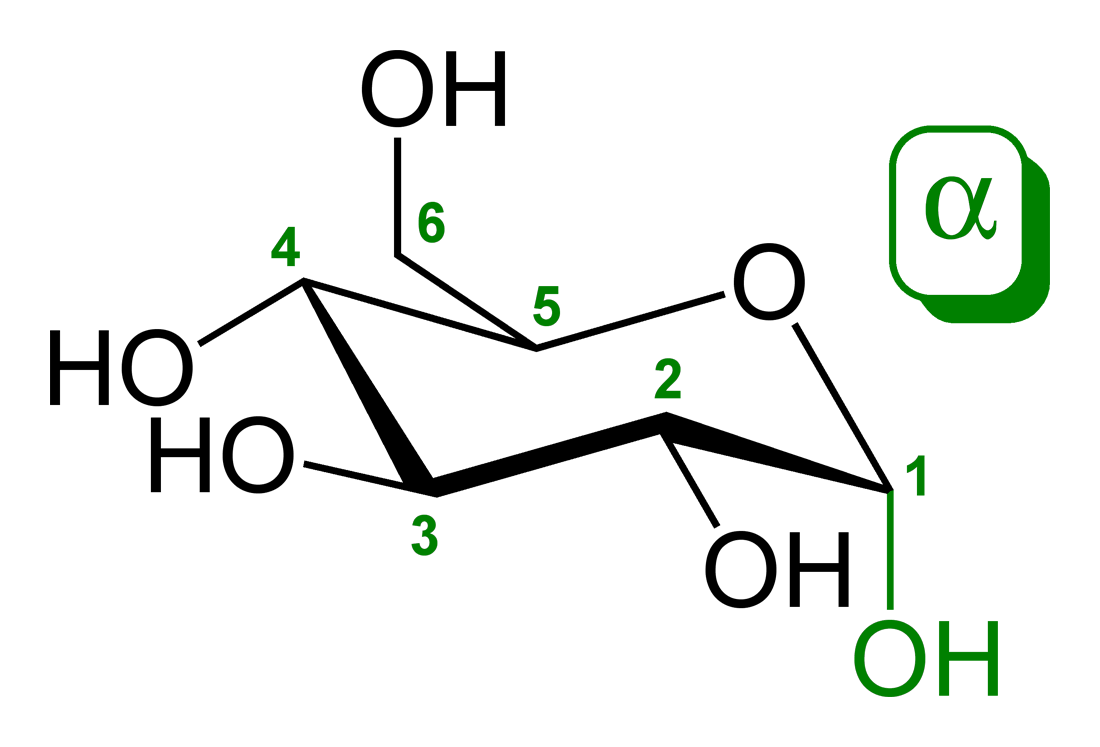
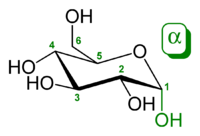 α-d-глукопираноза (облик столице) | |
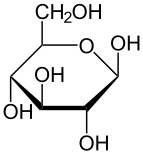
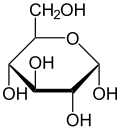 Хавортова пројекција α-d-глукопиранозе | |
 Фишерова пројекција d-глукозе | |
| Називи | |
|---|---|
| Преферисани IUPAC назив
-Глукоза | |
| Системски IUPAC назив
()-2,3,4,5,6-Пентахидроксихексанал | |
| Други називи
Крвни шећер Декстроза d-Глукоза Грожђани шећер | |
| Идентификација | |
3Д модел () |
|
| B01203 | |
| Абревијација | Glc |
| Бајлштајн | 1281604 |
| број | 200-075-1 |
| Гмелин Референца | 83256 |
| KEGG[1] | |
| MeSH | Glucose |
| LZ6600000 | |
| UNII | |
| Својства | |
| 6126 | |
| Моларна маса | 180,16 g·mol−1 |
| Агрегатно стање | Бели прах |
| Густина | |
| Тачка топљења | α-d-глукоза: 146 °C (295 °F; 419 K) β-d-глукоза: 150° |
| 909 (25 °C (77 °F)) | |
| Магнетна сусцептибилност | −101,5×10−6 |
| Диполни момент | 8,6827 |
| Термохемија | |
| Специфични топлотни капацитет, | 218,6 −1[4] |
Стандардна моларна ентропија (S |
209,2 −1[4] |
Стандардна енталпија стварања (ΔfH |
−1271 [5] |
Топлота сагоревања, већа вредност () |
2.805 kJ/mol (670 kcal/mol) |
| Фармакологија | |
| B05CX01 (WHO) V04CA02, V06DC01 | |
| Опасности | |
| Безбедност приликом руковања | ICSC 08655 |
| NFPA 704 | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Глукозу углавном праве биљке и већина алги током фотосинтезе из воде и угљен-диоксида, користећи енергију сунчеве светлости. Она се користи за израду целулозе у ћелијским зидовима, која је најзаступљенији угљени хидрат.[9] У енергетском метаболизму, глукоза је најважнији извор енергије у свим организмима. Глукоза за метаболизам се делимично чува као полимер, у биљкама углавном као скроб и амилопектин, а код животиња као гликоген. Глукоза циркулише у крви животиња као шећер у крви. Природно присутан облик глукозе је d-глукоза, док је l-глукоза синтетички произведена у релативно малим количинама и мање је важна.
Глукоза, као интравенски шећерни раствор, налази се на списку есенцијалних лекова Светске здравствене организације, најважнијих лекова неопходних у основном здравственом систему.[10] Име глукоза потиче преко француског израза из грчке речи , са значењем „сладак”, у смислу шире, слатке, свеже испресоване масе грожђа у прављењу вина.[11][12] Суфикс „-оза” је хемијски класификатор, који означава шећер.
Историја
Глукозу је први пут изоловао немачки хемичар из Андреас Марграф из сувог грожђа 1747. године.[13][14] Јохан Тобијас Ловиц је открио глукозу у грожђу 1792. године и препознао је да се разликује од шећера из шећерне трске (сахарозе). Назив глукоза је сковао Жан-Батист Дума 1838. године, и тај назив је превладао у хемијској литератури. Фридрих Кекуле је предложио термин декстроза (од лат. — „десно”), јер у воденим растворима глукозе, раван линеарно поларизоване светлости бива закренута надесно. У контрасту с тим, d-фруктоза (кетохексоза) и l-глукоза заокрећу линеарно поларизовану светлост налево. Најранија нотација према ротацији равни линеарно поларизоване светлости ( и -номенклатура) је касније напуштена у корист d- и l-нотације, која одражава апсолутне конфигурације асиметричног центра најудаљенијег од карбонилне групе, и у сагласности са конфигурацијом d- или l-глицералдехида.[15][16]
Пошто је глукоза основна потреба многих организама, правилно разумевање њеног хемијског састава и структуре увелико је допринело општем напретку у органској хемији. До овог разумевања је углавном дошло као резултат истраживања немачког хемичара Емила Фишера, који је за своја открића примио Нобелову награду за хемију 1902. године.[17] Синтеза глукозе успоставила је структуру органског материјала и консеквентно формирала прву дефинитивну валидацију Јакобус Хенрикус ван’т Хофових теорија о хемијској кинетици и распореду хемијских веза у молекулима који садрже угљеник.[18] Између 1891 и 1894, Фишер је успоставио стереохемијску конфигурацију свих познатих шећера и коректно је предвидео могуће изомере, примењујући ван'т Хофову теорију асиметричних атома угљеника. Имена су се у почетку односила на природне супстанце. Њихови енантиомери су добили исто име са увођењем систематских номенклатура, узимајући у обзир апсолутну стереохемију (нпр. Фишерова номенклатура, d/l номенклатура).
За откриће метаболизма глукозе Ото Фриц Мајерхоф је добио Нобелову награду за физиологију или медицину 1922. године.[19] Ханс фон Ојлер-Хелпин је награђен Нобеловом наградом за хемију заједно са Артуром Харденом 1929. године за њихова „истраживања ферментације шећера и учешћа ензима у том процесу”.[20][21] Године 1947, Бернардо Хоусај (за његово откриће улоге хипофизе у метаболизму глукозе и изведених угљених хидрата) као и Карл и Герти Кори (за њихово откриће конверзије гликогена у глукозу) добили су Нобелову награду за физиологију и медицину.[22][23][24] Године 1970, Луис Лелуар је награђен Нобеловом нагадом за хемију за откриће из глукозе изведених шећерних нуклеотида у биосинтези угљених хидрата.[25]
Хемијске особине
Са својих шест атома угљеника, глукоза се класификује као хексоза, поткатегорија моносахарида. d-Глукоза је један од шеснаест стереоизомера алдохексозних стереоизомера. d-изомер, d-глукоза, такође позната као декстроза, широко је заступљена у природи, док l-изомер, l-глукоза, није. Глукоза се може добити хидролизом угљених хидрата као што су млечни шећер (лактоза), тршчани шећер (сахароза), малтоза, целулоза, гликоген, итд. Обично се комерцијално производи од кукурузног скроба хидролизом путем упаравања под притиском уз контролисани , чему следи даља ензиматска деполимеризација.[26] Невезана глукоза је један од главних састојака меда. Све форме глукозе су безбојне и лако се растварају у води, сирћетној киселини, и неколико других растварача. Оне су веома малој мери растворне у метанолу и етанолу.
Структура и номенклатура

Глукоза је моносахарид са формулом или , чијих пет хидроксилних () група су распоређене на специфичан начин дуж њених шест-угљеника у ланцу. Глукоза је обично присутна у чврстој форми као монохидрат са затвореним пиранским прстеном (декстроза хидрат). У воденом раствору, с друге стране, она је отвореног ланца у малој мери и присутна је претежно као α- или β-пираноза, који се делимично међусобно спајају мутаротацијом. Из водених раствора, могу се кристалисати три позната облика: α-глукопираноза, β-глукопираноза и β-глукопиранозни хидрат.[8] Глукоза је градивни блок дисахарида лактозе и сахарозе (шећера из трске или репе), олигосахарида као што је рафиноза и полисахарида као што су скроб и амилопектин, гликоген или целулоза. Температура стаклене транзиције глукозе је 31 °C, а Гордон-Тејлорова константа (експериментално одређена константа за предвиђање температуре гласне транзиције за различите масене фракције смеше две супстанце)[27] је 4,5.[28]
| Поређење различитих форми и пројекција d-глукозе | ||
|---|---|---|
| Ната пројекција | Хавортова пројекција | |
 |
 α-d-глукофураноза |
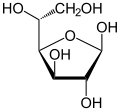 β-d-глукофураноза |
 α-d-глукопираноза |
 β-d-глукопираноза | |
| α-d-Глукопираноза у (1) Толенс/Фишеровој- (2) Хавортова пројекција (3) конформација столице (4) стереохемијски приказ | ||
 | ||
Форма с отвореним ланцeм

У својој непостојаној форми отвореног ланца, молекул глукозе има отворену (за разлику од цикличне) и неразгранату основу са шест атома угљеника, -1 до -6; где је -1 део алдехидне групе -, а сваки од осталих пет угљеника носи једну хидроксилну групу -. Преостале везе угљеничне основе су задовољене атомима водоника -. Стога је глукоза хексоза и алдоза, или алдохексоза. Алдехидна група чини глукозу редукујућим шећером дајући јој позитивну реакцију са Фелинговим реагенсом.
Сваки од четири угљеника -2 до -5 је стереоцентар, што значи да су његове четири везе повезане са четири различита супституента. (Угљеник -2, на пример, повезан је са , , , и .) У d-глукози, ова четири дела морају да буду у специфичном тродимензионалном аранжману. Наиме, кад се приказује молекул у Фишеровој пројекцији, хидроксили на , , и C-5 морају да буду с десне стране, док онај на мора да буде на левој страни.
Позиције та четири хидроксида су тачно обрнуте у Фишеровом дијаграму l-глукозе. d- и l-глукозе су два од 16 могућих алдохексоза; других 14 су алоза, алтроза, галактоза, гулоза, идоза, маноза, и талоза, са два енантиомера, “d-” и “l-”.
Важно је напоменути да линеарни облик глукозе чини мање од 0,02% молекула глукозе у воденом раствору. Остатак је један од два циклична облика глукозе који настају када се хидроксилна група на угљенику 5 () веже за алдехидни угљеник 1 ().
Циклична форма
.
Слева надесно: Хавортове пројекције и куглично-штапне структуре α- и β- аномера D-глукопиранозе (горњи ред) и D-глукофуранозе (доњи ред)
У растворима, форма глукозе са отвореним ланцом (било „D-” или „L-”) постоји у равнотежи са неколико цикличних изомера, сваки садржи прстен угљеника затворен једним атомом кисеоника. Међутим, у воденом раствору, више од 99% молекула глукозе, у било ком тренутку, постоје као пиранозни облици. Форма отвореног ланца је ограничена на око 0,25%, а фуранозни облици постоје у занемарљивим количинама. Изрази „глукоза” и „D-глукоза” се генерално користе за ове цикличне облике. Прстен настаје из форме отвореног ланца интрамолекуларном нуклеофилном адиционом реакцијом између алдехидне групе (на -1) и било -4 или -5 хидроксилне групе, формирајући хемиацеталну везу, .
Тромеров реагенс
Реагенс за доказивање глукозе зове се Тромеров реагенс. То је базни раствор бакар(II)-сулфата. У додиру с глукозом настаје црвенкасто-смеђи талог.
Извори
Литература
Спољашње везе
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.