Периода (периодни систем)
From Wikipedia, the free encyclopedia
Remove ads
Под појмом периоде периодног система елемената подразумева се у хемији сваки ред табеле периодног система хемијских елемената. Бројеви периода од 1 до 7 одговарају главним квантним бројевима, којима се још додају и словне ознаке периоде до Q према љускама атомског модела љусака..
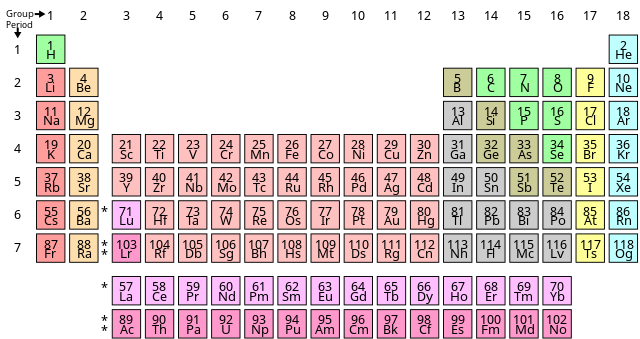

Изузев прве периоде, која садржи само елементе водоник и хелијум, свака периода садржи осам главних група елемената. Од 4. периоде надаље, постоји још десет споредних група елемената. Шеста периода садржи још и додатних 14 елемената који се називају лантаноиди, док 7. периода такође садржи 14 додатних елемената који се називају актиноиди.
Remove ads
Правила и законитости
Унутар неке периоде, по правилу, атомски радијуси елемената опадају слева надесно док истовремено расте електронегативност, док број позитивно наелектрисаних протона у атомском језгру расте, а с тим у неутралним атомима такође расте и број негативно наелектрисаних електрона у атомској љусци. Кориштењем атомског модела љусака, сматра се да се електронске љуске попуњавају истим редоследом, док новији модели атома као што је нпр. модел орбитала предвиђа да се истим редоследом заузимају одговарајуће атомске орбитале.
Промене броја атомских честица у атому унутар неке периоде узрокује и различите особине хемијских елемената унутар периоде:
- промена у броју основних честица у атомском језгру утиче углавном на различите физичке особине елемената
- број и место електрона у атомском омотачу утиче највише на разлике у хемијским особинама елемената.
Remove ads
Периоде
Тренутно постоји седам комплетних периода у периодичној табели, која садржи 118 познатих елемената. Сви нови елементи биће смештени у осму периоду; погледајте проширени периодни систем.
Периода 1
Прва периода садржи мање елемената од било које друге, само два, водоник и хелијум. Они стога не следе октетско правило. Хемијски се хелијум понаша попут племенитог гаса, те је прихваћен као део елемената групе 18. Међутим, у погледу његове нуклеарне структуре, он припада s блоку и зато се понекад класификује као елемент групе 2, или истовремено 2 и 18. Водоник лако губи и добија електрон, и стога се хемијски понаша као припадник обе групе, прве и седамнаесте.
- Водоник () је најобилнији од хемијских елемената, и сачињава око 75% елементарне масе свемира.[1] Јонизовани водоник је само протон. Звезде у главном низу углавном су састављене од водоника у стању плазме. Елементарни водоник је релативно редак на Земљи, а индустријски се производи из угљоводоника као што је метан. Водоник може да формира једињења са већином елемената и присутан је у води и већини органских једињења.[2]
- Хелијум () постоји само као гас, осим у екстремним условима.[3] То је други најлакши елемент и други је по заступљености у универзуму.[4] Већина хелијума је формирана током Великог праска, а нови хелијум је створен нуклеарном фузијом водоника у звездама.[5] На Земљи је хелијум релативно редак, јавља се само као нуспродукт природног распада неких радиоактивних елемената.[6] Такав радиогени хелијум је заробљен у природном гасу у концентрацијама до седам запреминских процената.[7]
Периода 2
Елементи друге периоде садрже 2 и 2 орбитале. Ова периода обухвата биолошки најбитније елементе поред водоника: угљеник, азот и кисеоник.
- Литијум () је најлакши метал и најмање густ чврсти елемент.[8] У свом нејонизованом стању један је од најреактивнијих елемената, те се у природи једино јавља у виду једињења. То је најтежи примордијални елемент формиран у великим количинама током Великог праска.
- Берилијум () има једну од највиших тачки топљења од свих лаких метала. Мале количине берилијума синтетисане су током Великог праска, иако се већина распала или даље реаговала унутар звезда да би се створила већа језгра, попут угљеника, азота или кисеоника. Међународна агенција за истраживање рака је класификовала берилијум као карциноген групе 1.[9] Између 1% и 15% људи је сензитивно на берилијум и може развити упалну реакцију у свом респираторном систему и кожи, која се назива хронична берилијумска болест.[10]
- Бор () се природно не појављује као слободни елемент, већ у једињењима као што су борати. То је есенцијални биљни микронутријент, који је потребан за снагу и развој ћелијских зидова, деобу ћелија, развој семена и плодова, транспорт шећера и развој хормона,[11][12] иако су високи нивои токсични.
- Угљеник () је четврти елемент по заступљености у свемиру по маси након водоника, хелијума и кисеоника,[13] и други је најизобилнији елемент у људском телу по маси након кисеоника,[14] трећи најзаступљенији према броју атома.[15] Постоји скоро неограничен број једињења која садрже угљеник због способности угљеника да формира дуге стабилне ланце C—C веза.[16][17] Сва органска једињења, она која су неопходна за живот, садрже најмање један атом угљеника[16][17] у комбинацији са водоником, кисеоником, азотом, сумпором и фосфором. Угљеник је основа сваког важног биолошког једињења[17]
- Азот () се налази углавном као инертни диатомски гас, 2, који чини 78% Земљине атмосфере по запремини. Он је есенцијална компонента протеина, а самим тим и живота.
- Кисеоник () сачињава 21% атмосфере по запремини и неопходан је за дисање свих (или скоро свих) животиња. Он је такође главна компонента воде. Кисеоник је трећи најзаступљенији елемент у свемиру, а једињења кисеоника доминирају Земљину кору.
- Флуор () је најреактивнији елемент у свом нејонизованом стању, тако да се никад не налази слободан у природи.
- Неон () је племенити гас који се користи у неонском осветљењу.
Периода 3
Сви елементи треће периоде се јављају у природи и имају барем један стабилан изотоп. Све осим племенитог гасног аргона од суштинског су значаја за базну геологију и биологију.
- Натријум () је алкални метал. Он је пристан у земаљским океанима у великим количинама у виду натријум хлорида (стоне соли).
- Магнезијум () је земноалкални метал. Магнезијумови јони су присутни у хлорофилу.
- Алуминијум () је постпрелазни метал. Он је најизобилнији метал у Земљиној кори.
- Силицијум () је металоид. Он је полупроводник, што га чини главном компонентом многих интегрисаних кола. Силицијум диоксид је главни конституент песка. Оно што је угљеник за биологију, силицијум је за геологију.
- Фосфор () је неметал који је есенцијала у ДНК. Он је веома реактиван, и стога се никад не налази као слободни елемент у природи.
- Сумпор () је неметал. Он је јавља у две аминокиселине: цистеин и метионин.
- Хлор () је халоген. Он се користи као средство за дезинфекцију, посебно у пливачким базенима.
- Аргон () је племенити гас, те је скоро потпуно нереактиван. Инкандесцентне сијалице се често пуне племенитим гасовима као што је аргон да би се очували филаменти при високим температурама.
Периода 4

Четврта периода обухвата биолошки есенцијалне елементе калијум и калцијум, и она је прва периода у -блоку са лаким прелазним металима. Она садржи гвожђе, најтежи елемент формиран у звездама главног низа и једну од главних компоненти Земље, као и друге важне метала као што су кобалт, никал, и бакар. Скоро сви припадници ове периоде имају биолошке улоге.
Четврту периоду комплетирају постпрелазни метали цинк и галијум, металоиди германијум и арсен, и неметали селен, бром, и криптон.
Периода 5
Пета периода има исти број елемената као и четврта периода, и следи исту општу структуру али са једним постпрелазним металом више и једним неметалом мање. Од три најтежа елемента са биолошким улогама, два (молибден и јод) су у овој периоди; волфрам, у шестој периоди, је најтежи, заједно са неколико првих лантаноида. Пета периода такође садржи техницијум, најлакши искључиво радиоактиван елемент.
Периода 6
Шеста периода је прва периода који садржи -блок, са лантаноидима (такође познатим као реткоземни елементи), и обухвата најтеже стабилне елементе. Многи од ових тешких метала су токсични и неки од њих су радиоактивни, док су платина и злато углавном инертни.
Периода 7
Сви елементи седме периоде су радиоактивни. Ова периода садржи најтежи елемент који се природно јављају на Земљи, плутонијум. Сви наредни елементи у овој периоди су вештачки синтетисани. Иако је њих пет (од америцијума до ајнштајнијума) сада доступно у макроскопским количинама, већина је изузетно ретка, припремљена само у микрограмским количинама или мањим. Неки од каснијих елемената једино су идентификовани у лабораторијама у количинама од по неколико атома.
Иако реткост многих ових елемената значи да експериментални резултати нису веома опсежни, периодични и групни трендови у понашању изгледају мање прецизно дефинисани за седму периоду него за друге периоде. Док францијум и радијум показују типична својства група 1 и 2, актиноиди показују много већу разноликост понашања и оксидационих стања него лантаноиди. Ове особитости седме периоде могу бити последица разних фактора, укључујући велики степен спинско-орбитне спреге и релативистичких ефеката, који ултимативно узрокују врло висока позитивна електрична наелектрисања из њихових масивних атомских језгара.
Периода 8
Ни један елемент осме периоде до сада није синтетисан. Предвиђа се постојање g-блока. Није јасно да ли сви претпостављени елементи осме периоде физички могу да постоје. Постоји и могућност да нема осме периоде.
Remove ads
Референце
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
