Ернест Радерфорд
Британски физичар новозеландског порекла, добитник Нобелове награде за хемију (1908) (1871–1937) From Wikipedia, the free encyclopedia
Ернест Радерфорд (енгл. ; Нилсон, 30. август 1871 — Кембриџ, 19. октобар 1937) је био британски физичар који се сматра оцем нуклерних реакција.[2][3]
| Ернест Радерфорд | |
|---|---|
 Ернест Радерфорд | |
| Датум рођења | 30. август 1871. |
| Место рођења | Нилсон, Нови Зеланд |
| Датум смрти | 19. октобар 1937. (66 год.) |
| Место смрти | Кембриџ, Уједињено Краљевство |
| Образовање | University of Canterbury, Универзитет у Кембриџу, Тринити колеџ, Nelson College |
| Поље | физика, хемија |
| Познат по | отац нуклеарне физике Радерфордов модел откриће протона радерфорд (јединица) |
| Награде | Нобелова награда за хемију (1908)[1] Рамфордова медаља (1905) Медаља Елиот Кресон (1910) Мателучијева медаља (1913) Коплејева медаља (1922) Медаља Френклин (1924) |
| Потпис | |

Био је професор на факултету у Монтреалу; био је професор физике на Универзитету у Манчестеру (од 1907), а од 1919. директор Кевендишова лабораторије у Кембриџу. Године 1903. изабран за члана (1925-30 за председника) Краљевског друштва. Нобелову награду за хемију добио је 1908. године. У почетку се бавио проучавањем радиоактивних распада. Први је уочио да се зрачење радијума састоји од три врсте, које је назвао α- β- и γ-зрачење.[4] Заједно са Фредериком Содијем увео је појам време полураспада и формулисао законе радиоактивног распада. Проучавањем распадања алфа-честица на атомима Радерфорд је дошао до закључка да атом чија је величина 10−8 цм није компактан делић материје, него сложен од позитивног језгра (величине 10−12 цм) и електрона који круже око њега. Радерфорд је први употребио реч протон за позитивно наелектрисану честицу у језгру атома.
Од њега потиче и формула (названа његовим именом) за расејање алфа-честица нај језгрима атома; касније (1925. године), Радерфорд је утврдио и одступање од те формуле до којег долази код врло блиских судара α-честице и језгра, кад нуклеарно међуделовање постаје много важније од електричног.[5]
Године 1919. Радерфорд је, бомбардујући азот алфа-честицама извео прву (трансмутацију) једног елемента у други јер је из азота успео да добије кисеоник. Тако је извршена прва нуклеарна реакција. Вештачки хемијски елемент радерфордијум од 1997. године по њему носи име.
Биографија
Радерфордови родитељи су били фармери, који су емигрирали из Шкотске на Нови Зеланд, да би лакше подигли велику породицу. Ернест је завршио електротехничку школу, а касније је путовао у Велику Британију, да би се усавршио у мерењу и откривању електромагнетских таласа. Био је професор на универзитету у Монтреалу; начелник одељења за физику универзитета у Манчестеру (од 1907), а од 1919. директор Кавендишове лабораторије у Кембриџу. Године 1900. се оженио и имао је једну кћер.[6]
Научна истраживања
Почетком 20. века било је познато 5 радиоактивних елемената: уранијум, торијум, полонијум, актинијум и радијум. Међу њима највише се употребљавао радијум и то за лечење рака. Из радијума и његових хемијских једињења стално се развијао један гас, који је исто тако био радиоактиван, а назван је радијумова еманација или радон. Осим радона настајао је и хелијум. Из тога се закључило да се радијум, али и сви остали радиоактивни елементи, претварају у друге елементе с мањом тежином и при том поступку зраче. Уочено је такође да је та природна радиоактивност својствена атомима с највећим атомским масама и да је то процес који се дешава у унутрашњости атома, значи не зависи од спољних утицаја, као што су притисак, температура или нека хемијска реакција.
Радиоактивно зрачење
Већ 1900. било је познато да један део радиоактивног зрачења може да скреће у магнетском пољу. Радерфорд је на основу испитивања пролаза радиоактивних зрака кроз танке листиће алуминијума утврдио да код зрачења уранијумових једињења постоје две врсте зрака. Ону врсту зрака који не могу да прођу кроз алуминијску плочицу дебљине 0,02 назвао је алфа-честицама, а ону врсту која је пролазила и кроз дебље слојеве назвао је бета-честицама. Исте године француски научник Пол Вилард је открио и трећу врсту радиоактивног зрачења, за коју се утврдило да има велику продорну моћ и да не скреће у магнетском пољу, а названа је гама-честицама. На основу скретања у магнетском пољу, утврђено је да алфа-честице имају позитивни електрични набој, а бета-честице негативан електрични набој.
Године 1908. су Радерфорд и Ханс Гајгер мерењем утврдили да алфа-честице имају двоструки електрични набој, а да им је маса једнака четворострукој маси атома водоника. Када алфа-честица привуче два електрона, она прелази у атом хелијума.[7][8] Из тога је Радерфорд закључио да су алфа-честице у ствари јони хелијума или само атомска језгра хелијума. За бета-честице се утврдило да се у магнетном и електричном пољу понашају исто као и катодни зраци или електрони. То значи да су бета-честице у ствари електрони великих брзина, али за разлику од електрона у електронском омотачу атома, настају из атомског језгра.
За гама-честице је утврђено да одговарају тврдим рендгенским зракама. То су доказали Радерфорд и Е. Н. да Коста Андраде 1914, дифракцијом гама-честица кроз одговарајућу кристалну решетку, помоћу које су успели и да одреде и њихову таласну дужину. Према досадашњим мерењима утврђено је да су таласне дужине гама-честица између 0,000466 и 0,0428 . Према томе, гама-честице одговарају краткоталасном рендгенском зрачењу, али за разлику од рендгенског зрачења настају у атомском језгру.
Теорија радиоактивног распадања
У то време се није могло објаснити одакле потиче тако велика енергија којом зраче радиоактивне материје. На основу чињенице да се атоми радиоактивних материја заиста распадају и прелазе у атоме других елемената мање тежине, тј. да се трансмутирају, Радерфорд и Фредерик Соди поставили су 1903. теорију радиоактивног распадања. Према њој атоми радиоактивних елемената нису стабилни, него се спонтано распадају (дезинтегрирају или трансмутирају), уз зрачење радиоактивних честица (алфа-честица, бета-честица или гама-честица), при чему прелазе у атоме других елемената.
Нуклеарна реакција
Теорија радиоактивног распадања је врло значајна, јер из ње произлази да су атоми дељиви и да могу прелазити у атоме других хемијских елемената. Пошто је прелажење једног хемијског елемента могуће само ако се промена догађа у атомском језгру, може се закључити да је радиоактивност у ствари распадање језгра атома неких хемијских елемената. Промена стања атомског језгра код радиоактивних елемената се назива нуклеарна реакција.[9]
Према закону помицања атоми радиоактивних елемената који емитирају алфа-честице прелазе у атоме чија је атомска маса мања за 4 атомске јединице, а атомски број мањи за 2, тј. прелазе у атоме елемената који у периодном систему заузимају положај померен за два места улево, а атоми који емитују бета-честице прелазе у атоме који уз исту атомску масу повећавају свој атомски број за 1, тј. прелазе у атоме елемената који у периодном систему заузимају положај померен за једно место удесно.
Време полураспада
Године 1904. је Радерфорд увидео да време, у току којег се распадне половина почетне количине неког радиоактивног елемента, може послужити као податак о брзини његовог распадања, па је зато величину тог времена увео као својствену константу, која се назива време полураспада.[10]
Сцинтилација
Године 1899. Бекерел је запазио још једно својство радиоактивног зрачења и то да изазивају луминисценцију код многих хемијских материја, као што су на пример цинков сулфид (), баријумов платиноцијанид () и дијамант. Запажено је помоћу микроскопа да се луминисцентно светлуцање цинковог сулфида, изазвано алфа-честицама, састоји из великог броја појединачних бљескова светлости. Зато што ово краткотрајно светлуцање има сличан изглед светлуцању искри, названо је сцинтилација (лат. значи искра). Пошто свака алфа-честица својим ударом о луминисцентни застор изазива једну сцинтилацију или искру, Радерфорд је предложио да је то врло погодан начин за бројање радиоактивних честица. На тај начин је сцинтилација послужила као први начин за истраживање количине алфа-честица.
Радерфорд је наставио експерименте, те је користио затворену посуду (која се могла пунити различитим гасовима) с покретним извором алфа честица који се могао ставити на различите удаљености од застора. На застору су се уз помоћ микроскопа мотриле сцинтилације - ударци честица у застор који су изазивали светлуцање. Кад је у посуду ставио кисеоник број сцинтилација се смањио због апсорпције алфа честица у слоју гаса. Кад је у уређај ставио суви ваздух јавио се ефект супротан очекиваном – број сцинтилација се повећао. Затим је посуду напунио чистим азотом и број сцинтилација био је још и већи. На основу многобројних експеримената закључио је да честице које су продорније, прелазе већи пут и изазивају сцинтилације настају због судара алфа честица с атомима азота, те да су те нове честице атоми водоника.
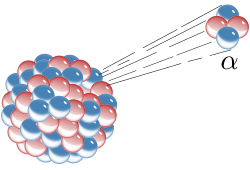
Експеримент с алфа-честицама и златним листићем
Експеримент с алфа-честицама и златним листићем је био један од најзначајнијих експеримената у нуклеарној физици, јер је то био први доказ да у атому постоји атомско језгро. Радерфорд окупља плодан тим истраживача, међу којима су Ханс Гајгер, Ернест Марсден, Џорџ Хевеси, Хенри Мозли, а неколико је година члан тима био и Нилс Бор.
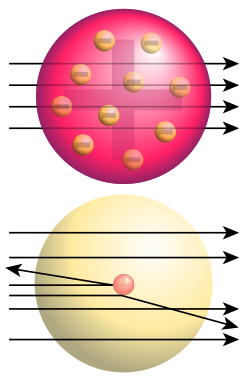
Кључни се експеримент за то откриће догодио 1909. када су научници врло танку златну фолију изложили деловању алфа-честица. Томпсонов модел атома је предвиђао ће алфа-честице проћи кроз танки метални филм и распршити се под одређеним малим угловима. Међутим, на велико је изненађење истраживачкога тима установљено распршење и под великим угловима, а нека су се хелијумска језгра од металне фолије одбила потпуно уназад. Радерфорд је то упоредио с вероватноћом да лист папира одбије топовску куглу. Резултат је експеримента водио према новом моделу атома, који је Радерфорд предложио 1911.: атом се састоји од средишњег набоја окруженога сферичном расподелом набоја супротнога предзнака. У почетку се претпостављало да су и електрони градивне честице атомског језгра, па је у моделу за атом азот редног броја 7 било претпостављено да у језгру има 21 честицу, и то 14 протона и 7 електрона, а у електронском омотачу још 7 електрона. Откриће је спина и спектроскопија азотних језгара, до чега је 1930. дошао италијански физичар Франко Расети, показало да се азотна језгра понашају као честице целобројног спина, тј. као бозони. То је било у потпуном нескладу с предложеним моделом азотног језгра са 21 нуклеоном, па је то неслагање названо „азотном катастрофом“. Међутим, „катастрофа“ је разрешена открићем неутрона, које је 1932. објавио Џејмс Чедвик и његовог спина 1/2. Руски је физичар Дмитри Иваненко предложио данашњи модел атома према којем су атомски нуклеони протони и неутрони, а не електрони. Назив протон за позитивно наелектрисани нуклеон први је употребио Радерфорд, а он је 1919. године извео и прво претварање (трансмутацију) једнога елемента у други; тој је првој нуклеарној реакцији у историји бомбардовао азот алфа-честицама и тако добио кисеоник.
Радерфордово распршење
Радерфордово распршење је појава из нуклеарне физике, којом се објашњава скретања алфа-честица које ударају у танке листиће метала, а с њим се доказује постојање позитивно наелектрисаног атомског језгра, које има готово сву масу атома.Rutherford, Ernest (1911). The scattering of alpha and beta particles by matter and the structure of the atom. Taylor & Francis. стр. 688.</ref> Радерфордово распршење је објашњење структуре атомско језгра, које је настало након експеримента с алфа-честицама и златним листићем, који су извели Ернест Радерфорд, Ханс Гајгер и Ернест Марсден. Резултати тог експеримента су показали да су скретања алфа-честица под великим угловима била јако ретка, на пример при пролазу кроз листић платине на сваких 8000 једна алфа-честица би скренула под углом већим од 90º.
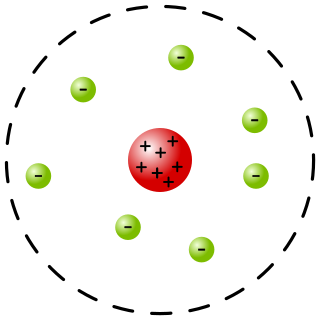
Радерфордов модел атома
Чињеница коју је утврдио Радерфорд, да је алфа-честица у ствари јон атома хелијума, да је њена маса 4 пута већа од масе атома водоника и да њен електрични набој износи два елементарна електрична набоја, омогућила је одређивање електричног набоја сваког атома.[11] Осим тога, Радерфорд је запазио још једну важну појаву, да се алфа-честице распршују при пролазу кроз неки материјал, на основу које је засновао Радерфордов модел атома. Он је запазио да се уски сноп алфа-честица, након пролаза кроз танки листић (фолију) метала, скреће од полазног снопа и да се распрши. Запазио је и да се алфа-честице више распрше код пролаза кроз метал, него код пролаза кроз ваздух.
Прво нуклеарно претварање
Године 1919. Радерфорд је бомбардујући азот алфа-честицама извео прво претварање (трансмутацију) једног елемента у други. Радерфорд је приликом истраживања распршења алфа-честица кроз ваздух, открио да приликом бомбардовања атома азота с алфа-честицама настају нова језгра атома кисеоника и водоника.
Неутрон
Године 1921. Радерфорд је радио с Нилсом Бором и претпоставио је постојање неутрона, којег је 1932. доказао његов колега Џејмс Чедвик и 1935. добио Нобелову награду за физику за то откриће.
Публикације
- Radio-activity (2nd изд.). 1904. ISBN 978-1-60355-058-1. , (1905).
- Radioactive Transformations. 1906. ISBN 978-1-60355-054-3. .
- (1913)][12]
- (1926)
- (1933)
- (1937)
Чланци
- "Disintegration of the Radioactive Elements" Harper's Monthly Magazine, January 1904, pages 279 to 284.
Види још
- Планетарни модел атома
- Радерфордов оглед
Референце
Литература
Спољашње везе
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
