From Wikipedia, the free encyclopedia
Алдехид је органско једињење које садржи терминалну карбонилну групу . Ова функционална група, која се састоји из атома угљеника који је везан за атом водоника и двоструком везом за атом кисеоника (општа формула: ) назива се алдехидна група.[1] Алдехиди имају општу формулу , односно, једна алкил (или арил) група и један водоников атом везани су за карбонилни угљеников атом.[2] Алдехиди се разликују од кетона по томе што се карбонил налази на крају угљеничног скелетона, а не између два атома угљеника. Алдехиди су уобичајени у органској хемији. Многи мириси су алдехиди.[3][4]
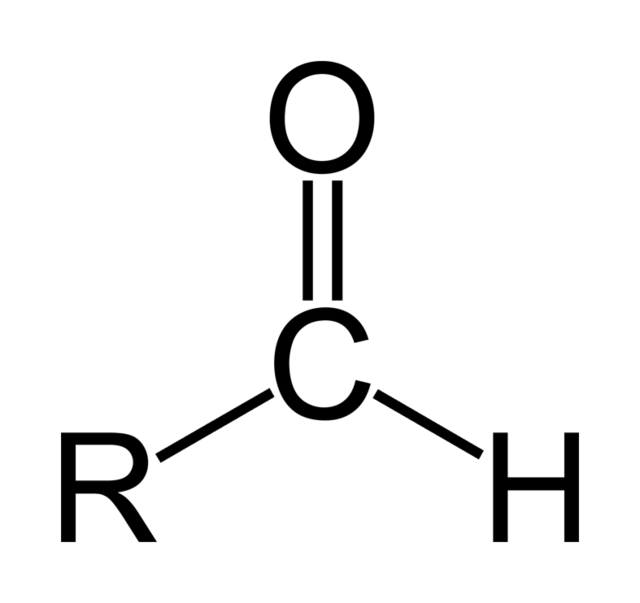

Карбонилна група садржи један 2 хибридизован угљеников атом, који је са кисеониковим атомом везан једном (сигма) и једном π(пи)-везом. -везе леже у једној равни и угловима веза од приближно 120°. π-веза, која спаја угљеник и кисеоник, налази се изнад и испод равни -веза. Карбонилна група је поларна; електрони у -везама, а посебно у π-вези, померени су ка електронегативнијем кисеониковом атому. Осим тога, кисеоников атом карбонилне групе садржи и два слободна електронска пара. С обзиром на то да је карбонилни угљеников атом позитивно поларизован, њега ће нападати нуклеофилни реагенси, док ће кисеоников атом, који је негативно поларизован, нападати електрофилни реагенси. Веза није кисела. Због резонантне стабилизације конјуговане базе, која је са α-водоником у алдехиду (није приказан на слици горе) далеко киселија, са близу 17, од везе у типичном алкану ( око 50). Ово закисељавање се приписује електронском губитку квалитета формил центра и чињеници да конјугована база, енолатни анјон, делокализује своје негативне набоје у вези, а алдехидна група је донекле поларизирана.[5][6][7][8][9]
Алдехиди (осим оних без алфа угљеника, или без протона на алфа угљенику, као што су формалдехид и бензалдехид) могу постојати било у кето или енол таутомеру. Кето-енолни таутомеризам је катализиран било киселином или базом. Обично је енол мањински таутомер, али је реактивнији.
Уобичајена имена алдехида не следе стриктно службена упутства, која препоручује IUPAC, али су та правила корисна. IUPAC прописује следећу номенклатуру алдехида.[10][11][12]

Реч алдехид је сковао Јустус фон Либиг као конструкцију од латинских речи (дехидрогенисани алкохол).[13][14] У прошлости, алдехиди су понекад именовани по кореспондирајућим алкохолима, на пример, сирћетни алдехид за ацеталдехид.
Термин формил група је изведен из латинске речи formica „мрав”. Та реч се може препознати у најједноставнијем алдехиду, формалдехиду, и у најједноставнијој карбоксилној киселини, формична киселина.
Због тога што су поларна једињења, код алдехида постоје интермолекулске дипол-дипол интеракције, услед чега су њихове тачке кључања више од тачака кључања одговарајућих једињења сличне молекулске масе. Тачке кључања расту с повећањем броја угљеникових атома. Нижи алдехиди (нпр формалдехид и ацеталдехид) се добро растварају у води, због остваривања водоничне везе. Алдехиди имају разнолика својства која која зависе од остатка молекула. Алдехиди могу да имају опор мирис. У процесу аутооксидације, алдехиди се деградирају и одлазе у ваздух.
Два алдехида која су од у највеће важности у индустрији, формалдехид и ацеталдехид, испољавају комплексно понашање због тенденције да се олигомеризују или полимеризују. Такође су подложни хидратацији, формирањем геминалног диола. У олигомерима/полимерима и хидратима постоје у равнотежи с родитељским алдехидом.
Алдехиди су лако препознатљиви спектроскопским методама. Користећи ИР спектроскопију, показују снажну ν vezu blizu 1700 −1. У свом 1 НМР спектру, формил водоников центар апсорбује у близини δ9, што је препознатљиви део спектра. Овај сигнал показује карактеристично спаривање на било којем протону алфа угљеника.

Трагови многих алдехида се налазе у етеричним уљима и често доприносе њиховом пријатном мирису, нпр. цинамалдехид, цилантро и ванилин. Вероватно због високе реактивности формил групе, алдехиди нису уобичајени у природним грађевним компонентама, као што су: аминокиселине, нуклеинске киселине, липиди. Већина шећера, међутим, су деривати алдехида. Ове „алдозе” се испољавају као хемиацетали, неке врсте маскираних облика родитељских алдехида. На пример, у воденом раствору само мали део глукозе се јавља као алдехид.
Постоји неколико метода за припрему алдехида,[15] али је доминантна технологија хидроформилација.[16] Илустративна је генерација бутиралдехида хидроформилацијом пропена:
Алдехиди се добити контролисаном оксидацијом примарних и секундарних алкохола. У индустрији, формалдехид се производи у великим количинама оксидацијом метанола.[17] Кисеоник је преферентни реагент, јер је „зелен” и јефтин. У лабораторији се користе специјализовани оксидациони агенси. У индустрији се оксидација алкохола врши тако што се паре алкохола преводе преко бакра као катализатора, при температури од 300 °. На пример:
Калцијумове соли се загревањем (400° ) без присуства ваздуха декарбоксилују (разлажу уз губитак ) и дају алдехиде и кетоне.
У киселој средини, у присуству жива(II) сулфатa као катализатора, алкини адирају воду и дају адиционе производе које одмах прелазе у алдехид, односно кетон.
Као оксидациона средства најчешће се користе калијум дихромат и анхидрид хромне киселине , као и калијум-перманганат. Оксидација се може остварити загревањем алкохола са закисељеним раствором калијум дихромата. У том случају, вишак дихромата се даље оксидује алдехидом до карбоксилне киселине, тако да се било алдехид издестилује док се формира (ако је испарљив) или се користе блажи реагенси као што је пиридинијум хлорохромат.[18]
Оксидација примарних алкохола којом се формирају алдехиди се може остварити под блажим, безхромним условима користећи методе или реагенсе као што су 2-јодоксибензојева киселина, Дес–Мартинов перјодинан, Свернова оксидација, , или Опенауерова оксидација. Још једна оксидациона рута од индустријског значаја је Вакеров процес, при чему се етилен оксидује до ацеталдехида у присуству бакарног и паладијумског катализатора (ацеталдехид се исто тако производи у великим размерама хидрацијом ацетилена).
У лабораторијама, α-хидрокси киселине се користе као прекурзори за припрему алдехида путем оксидативног одвајања.[19][20]
Најважнија реакција алдехида је нуклеофилна адиција. Електронски пар неког нуклеофила напада електрофилни карбонилни угљеников атом, и при томе се расида двострука веза, па један електронски пар те везе прелази на кисеоников атом при чему постаје интермедијарни анјон. Протоновањем насталог анјона добија се неутрални адициони производ. Најчешћи нуклеофили су: хидроксидни јон , вода , амонијак , цијанидни јон , и др.
Реакције:
и др.
Метанал (формалдехид) (), гасовито једињење растворљиво у води. Обично се чува растворен у води под називом формалин (37% формалдехида и око 15% метанола у води), или у облику чврстог полимера - параформалдехида (параформ). Најчешће се примењује у индустрији пластичних маса, бакелита, коже, као и дезинфекционо средство.
Етанал (), је безбојна, лако испарљива течност, такође добро растворљива у води. Чува се као паралдехид (циклични тример). Паралдехид се у медицини употребљава као хипнотик и средство за умирење (седатив). Важан је полазни материјал за изградњу других једињења (сирћетна киселина, 1,3-бутадиен, хлорал, винил ацетат и др.).
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.