хемијски елемент са атомским бројем 70 From Wikipedia, the free encyclopedia
Итербијум (, лат. ), је хемијски елемент из групе лантаноида са редним бројем 70.[6][7] Он је један од четири хемијска елемента који су добили име по шведском селу Итерби. Попут осталих лантаноида, он је сребрено-сјајни тешки метал. Особине итербијума не следе контракцију лантаноида, а због своје електронске конфигурације овај елемент има значајно мању густину као и ниже температуре топљења и кључања од суседних елемената у периодном систему. Итербијум је заступљен у земљиној кори у количини од 3,3 ppm. Најважнији минерал му је монацит
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општа својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | итербијум, Yb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | сребрнасто бео; са бледо жутом нијансом[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| У периодноме систему | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број (Z) | 70 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група, периода | група Н/Д, периода 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | f-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | лантаноид | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 173,045(10)[2][3][4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ел. конфигурација | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по љускама | 2, 8, 18, 32, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физичка својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка топљења | 1097 K (824 °C, 1515 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка кључања | 1469 K (1196 °C, 2185 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина при с.т. | 6,90 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| течно ст., на т.т. | 6,21 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота фузије | 7,66 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлота испаравања | 129 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мол. топл. капацитет | 26,74 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Напон паре
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомска својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | 1,1 (?) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергије јонизације | 1: 603,4 kJ/mol 2: 1174,8 kJ/mol 3: 2417 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски радијус | 176 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентни радијус | 187±8 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Остало | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | постраничноцентр. кубична (FCC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина звука танак штап | 1590 m/s (на 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топл. ширење | β, поли: 26,3 µm/(m·K) (на с.т.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топл. водљивост | 38,5 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електроотпорност | β, поли: 0,250 µΩ·m (на с.т.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетни распоред | парамагнетичан | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | +249,0·10−6 cm3/mol (2928 )[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Јангов модул | β форма: 23,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул смицања | β форма: 9,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул стишљивости | β форма: 30,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов коефицијент | β форма: 0,207 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Викерсова тврдоћа | 205–250 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдоћа | 340–440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS број | 7440-64-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Именовање | по Итербију (Шведска), где је ископаван | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриће | Жан Шарл Галисад де Марињак (1878) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прва изолација | Карл Ауер фон Велсбах (1906) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Главни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Итербијум је открио Жан Шарл Галисад де Марињак 1878. године приликом проучавања минерала гадолинита. Касније, 1907. године, Жорж Ирбен, Карл Ауер фон Велсбах и Чарлс Џејмс, независно један од другог, успели су из Марињаковог итербијума издвоје још један елемент, лутецијум. Велсбах је за име новог елемента предлагао алдебаранијум, међутим ипак је након дугих расправа и противно његовој вољи, задржано данашње име итербијум.
У техничком погледу елемент и његова једињења користе се у врло малим количинама, углавном због врло сложеног начина његовог одвајања од других лантаноида, између осталог користи се као дотирајуће средство за ласере на бази итријум-алуминијум граната. Итербијум() хлорид и итербијум() јодид су реагенси који се користе у разним органским реакцијама синтезе.
Итербијум је 1878. открио швајцарски хемичар Жан Шарл Галисад де Марињак. Он је детаљније проучавао гадолинит, те је покушао да одвоји ербијум који је нерастворљив у врелој води од других минералних састојака путем разлагања нитрата. При томе открио је да преостали кристали нису у потпуности изграђени од црвенкастог ербијум нитрата, већ су били видљиви и неки безбојни кристали. Измерени апсорпцијски спектар показао је да се у том случају морало радити о кристалима неког до тад непознатог елемента. Марињак је елементу дао име итербијум, према месту проналаска гадолинита у шведском Итербију, као и његовој сличности са итријумом. Одвајање оба елемента уследило је након другог експеримента додавањем хипосулфитне киселине у раствор хлорида.[8][9]
Француз Жорж Ирбен, Аустријанац Карл Ауер фон Велсбах и Американац Чарлс Џејмс су, независно један од другог, објавили 1907. године да Марињаков итербијум није чисти елемент, већ представља смешу два елемента. Ту смешу су успели да раздвоје на чисте хемијске елементе итербијум и лутецијум. Том приликом Карл Ауер фон Велсбах је новим елементима дао назив алдебаранијум (према звезди Алдебаран) и касиопеијум, док је Ирбен предложио називе неоитербијум и лутецијум.[10][11] Године 1909. међународна комисија за атомску масу, у чијем саставу су били Франк Виглсворт Кларк, Вилхелм Оствалд, Томас Едвард Торп i Жорж Ирбен, одлучила је да се Ирбену призна откриће лутецијума, те у складу с тим прихвати његово предложено име за елемент.[12] Такође је и задржано старо Марињаково име за итербијум.
Елементарни итербијум први су добили 1936. хемичари Вилхелм Клем и Хајнрих Бомер. Они су метални итербијум добили редукцијом итербијум() хлорида помоћу калијума при температури од 250 °. Осим тога, одредили су и кристалну структуру и магнетске особине овог метала.[13]
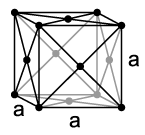
Као и други лантаноиди, итербијум је такође сребрнасто-светли, меки тешки метал. Он има неуобичајено ниску густину од 6,973 3, што је знатно мање од густине суседних лантаноида попут тулијума односно лутецијума односно приближно густинама неодијума или празеодијума. Слично поређење вреди и за неуобичајено ниску тачку топљења од 824 ° и тачку кључања од 1430 ° (за лутецијум: тачка топљења 1652 °, а кључања 3330 °). Ове вредности су у одређеној противречности са уобичајеном контракцијом лантаноида а узрок јој је електронска конфигурација итербијума . Због потпуно попуњење -љуске, за металну везу доступна су само два валентна електрона, па долази до знатно слабијих сила везе и знатно већег атомског радијуса метала.[14]
Постоји три различите кристалне структуре при атмосферском притиску као и друге три модификације итербијума високог притиска. На собној температури, метал се кристализује у кубном густо сложеном кристалном систему са параметром решетке .[15] При вишим температурама и притисцима ова структура прелази у кубно-унутарцентрирани кугласти систем, с тим да при атмосферском притиску, температура преласка износи око 770 °; док при собној температури, притисак преласка износи 4 .[16] На ниским температурама стабилна је хексагонална најгушћа структура, при чему се структурални фазни прелаз налази између 0 и 45 °, који јако много зависи од чистоће, притиска и напрезања унутар метала. Ове фазе имају различит магнетизам. Док је хексагонална фаза дијамагнетична (што је и очекивано због потпуно попуњене орбитале), кубна површинско-центрирана структура исказује парамагнетичне особине (вероватно због малог броја 3+ јона у металу).[17]
Редослед модификација високог притиска не одговара низу који се најчешће може наћи код других лантаноида. Тако на пример код итербијума нису познате модификације са двоструком хексагоналном најгушћом структуром или структуром самаријума. При притиску од 4 стабилну кубну унутар-центрирану структуру следи хексагонална најгушћа структура при 26 . Следећи фазни прелаз настаје при повећању притиска на 53 а изнад овог притиска поново настаје кубна најгушћа структура. Нови фазни прелаз следи на 98 . При овом притиску па све до најмање 202 , хексагонална структура је најстабилнија са просторном групом 3121 (бр. 152), а која се још зове и структура. Повећањем притиска следи и промена електронске структуре елемента, при чему електрон из -орбитале прелази у -орбиталу, а онда електронска конфигурација постаје тровалентна као и код других лантаноида.[18]
Итербијум је типични неплеменити метал, који при вишим температурама реагује с већином неметала. Са кисеоником споро реагује на сувом ваздуху при стандардним условима температуре и притиска, а много брже ако је у ваздуху присутна и влага. Фино иситњени метални итербијум је, попут других неплеменитих метала, врло лако запаљив на ваздуху или у присуству кисеоника. Смеса финог праха итербијума и органохалогених једињења, као што су хексахлороетан или политетрафлуороетилен, сагорева уз смарагдно-зелени пламен.[19] Реакција итербијума и водоник није потпуна, јер водоник улази у октаедарске шупљине у металној решеци те гради нестехиометријске хидридне фазе, при чему састав зависи од температуре и притиска водоника.[14][20]
У води итербијум се врло споро раствара, а много брже у киселинама истискујући водоник. У раствору, јони итербијума су већином тровалентни, безбојни, у облику хидрата . Жуто-зелени двовалентни јон итербијума није стабилан у воденим растворима, оксидира истискујући водоник са временом полураспада од око 2,8 сати, прелазећи у тровалентни јон.[14] Када се итербијум раствори у течном амонијаку, као и код натријума, настаје плави раствор због солватизираних електрона.[21]
Позната су укупна 33 изотопа између 148 и 181 као и других 12 нуклеарних изомера итербијума. Од њих, само седам се налази у природи са различитим уделом и заступљеношћу. Највећи удео у природној изотопској смеши итербијума има изотоп 174 од 31,8%, а следе га изотопи 172 са 21,9%; 173 са 16,12%; 171 са 14,3% те 176 са 12,7%. Изотопи 170 и 168 са удјелима од 3,05% одн. 0,13% су знатно ређи.[22]
Радиоактивни изотоп 169 са временом полураспада од 32 дана, настаје заједно са краткоживећим 175 (време полураспада 4,2 дана) путем активирања неутронима приликом излагања итербијума радијацији у нуклеарним реакторима. Он се може користити и као извор гама-зрачења, на пример у нуклеарној медицини и радиографији.[21][23]
На Земљи, итербијум је врло редак елемент, његов удео у континенталној Земљиној кори износи око 3,2 ppm (0,00032%).[24] Овај метал јавља се као саставни део ретких минерала, пре свега оних који садрже итријум и теже лантаноиде попут ксенотима и гадолинита. Тако на пример ксенотим из Малезије садржи до 6,2% итербијума. За разлику од њега, церитне земље попут монацита и бастнесита садрже доста мале количине итербијума. Монацит, у зависности од налазишта, садржи од 0,12% до 0,5% итербијума.[20]
Познато је више врло ретких минерала у којим се итербијум налази као најчешћи ретки земни метал. У такве спадају ксенотим-(Yb), где итербијума има 32% мерено по маси, а емпиријска формула је (Yb0,40Y0,27Lu0,12Er0,12Dy0,05Tm0,04Ho0,01)PO4.[25] Осим њега, итербијум је садржан у кеивииту-(Yb) са емпиријском формулом (Yb1,43Lu0,23Er0,17Tm0,08Y0,05Dy0,03Ho0,02)2Si2O7.[26] Међутим, ови минерали су делови једног низа мешаних кристала, који су такође и другачијег природног састава, гдје је итријум главни „састојак”.
Најважнији извори итербијума су лежишта монацита и ксенотима у Кини и Малезији (тамо је у виду пратећег минерала каситериту). Због слабе потражње на светском тржишту за овим металом, ситуација са производњом и залихама итербијума не сматра се критичном.[27]

Због тешког раздвајања лантаноида, добијање итербијума је изузетно компликовано и дуготрајно. Полазни минерали попут монацита или ксенотима се најприје растапају помоћу киселина или база у раствор. Одвајање итербијума од других лантаноида могуће је помоћу различитих метода, при чему технички најважнију представља јонско-измењивачка метода одвајања, као и за друге ретке лантаноиде. У том процесу раствор са ретким земљама се наноси на погодну смолу, на коју се појединачни јони лантаноида различито јако могу везати. Затим се раствор одваја од смоле јонскоизмењивачком хроматографијом помоћу средстава који с јонима граде комплексе попут EDTA, DTPA и HEDTA, те се због различите јачине веза између смоле и јона лантаноида могу одвојити жељени јони одређеног лантаноида.[20][28][29]
Хемијско одвајање је могуће путем различитих реакција итербијум-, лутецијум- и тулијум-ацетата са амалгамом натријума. Тако итербијум гради амалгам, док једињења лутецијума и тулијума не реагују.[30]
Добијање металног итербијума може се изводити електролизом истопљених једињења итербијум(III)-флуорида и итербијум(III)-хлорида, са алкалним или земноалкалним халогенидима до редукције при тачки топљења, те течним кадмијумом или цинком као катодом. Осим ове, итербијум се може добити и металотермичком редукцијом итербијум(III)-флуорида са калцијумом или итербијум(III)-оксида са лантаном или церијумом. Ако се ова посљедња реакција изводи у вакууму, итербијум се мора дестилисати те се тако може одвојити од других лантаноида.[20]
Итербијум и његова једињења комерцијално се користе у врло ограниченом обиму. Као легирни метал, побољшава чврстоћу, смањује зрна кристала и неке механичке особине нехрђајућег челика. У току су истраживања о употреби легура итербијума у стоматологији.[31]
Као и други лантаноиди, итербијум се такође користи као средство за допирање итријум-алуминијум-гранатских ласера (Yb:YAG ласер). Предности овог ласера над Nd:YAG ласерима је у већем могућем максималном допирању, дужем веку кориштења на вишим енергетским нивоима те ширим распонима апсорпције.[32] Итербијум је такође важно средство за допирање фибер-ласера због сличних предности као и код YAG ласера, може се користити и за фибер-ласере високих перформанси. Ту се такође убраја и висока моћ допирања, шири распон апсорпције између 850 и 1070 nm те такође шири распон емисије између 970 и 1200 nm.[33]
Експериментално се истражује кориштење овог метала као алтернатива за цезијум за покретање атомских сатова. У тестовима је измерен четири пута већи степен тачности од атомских сатова на бази цезијума.[34] Итербијум се такође испитује као замена за магнезијум у кинематичким ИЦ мамцима за борбене авионе. При томе итербијум(III)-оксид показује знатно виши степен емисије у инфрацрвеном спектру у односу на магнезијум-оксид те бољу перформансу зрачења од уобичајених сличних материјала на бази МТВ-а (магнезиј-тефлон-витон).[35]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.