Ionska spojina je snov, ki je sestavljena iz pozitivnih delcev (kationov) in negativnih delcev (anionov). Delci so med sabo povezani z močnimi elektrostatskimi vezmi, ki jih pri kemiji označujemo pod pojmom ionska vez. Najpreprostejša ionska spojina je natrijev klorid (NaCl), ki je sestavljen iz natrijevih (Na+) in kloridnih (Cl-) ionov.

Beseda ion je beseda grškega izvora [ἰέναι], ki v prevodu pomeni iti. Leta 1834 je ta izraz prvič omenil angleški fizik in kemik Michael Faraday za takrat neznano vrsto delcev, ki potujejo od ene elektrode na drugo preko nekega medija. To odkritje je bilo ključnega pomena pri omogočanju preoblikovanja električne energije v novejšo in močnejšo tehnologijo.[1]
Leta 1913 sta kristalno strukturo natrijevega klorida določila William Henry Bragg in William Lawrence Bragg. Odkrila sta, da je bilo okoli vsakega atoma natrija oziroma klora natanko šest enakovrednih nasprotno nabitih delcev, kar je bil dovolj močan dokaz, da sestavine niso bile razporejene v molekule ampak v kristalne strukture, ki imajo enakomerno zgradbo. Na ta način so drugi znanstveniki ugotovili, da imajo podobne strukture tudi ostale anorganske spojine.

Ionske spojine nastanejo iz njihov sestavnih ionov z izhlapevanjem, utekočinjenjem ali zmrzovanjem. Reaktivne kovine (predvsem alkalijske kovine) lahko reagirajo neposredno z zelo elektronegativnimi halogenimi plini. Posledica takšnih reakcij je tvorba ionskih spojin. Ionske spojine nastanejo tudi kot produkt zaradi visoke temperature pri kemijski reakciji dveh trdnih snovi.
Večina ionskih spojin nastane predvsem pri ionskih reakcijah, ki so temelj anorganske kemije. Za ionske reakcije je značilno, da potečejo zelo hitro. Če pomešamo raztopino natrijevega klorida (NaCl) in raztopino srebrovega nitrata(V) (AgNO3), v trenutku izpade kosmičasta bela oborina srebrovega klorida (AgCl). Enaka kosmičasta bela oborina nastane, če pomešamo raztopino srebrovega nitrata(V) s solno kislino (HCl) ali z raztopino kalijevega klorida (KCl).[2] Kemijske formule teh spojin ne pomenijo obstoja takih molekul ali ionskih parov, temveč kažejo le stehiometrično razmerje atomov oziroma ionov v snovi.
Reakcija med solno kislino in srebrovim nitratom(V):
Reakcija med kalijevim kloridom in srebrovim nitratom(V):
V opisanih primerih gre za nastanek v vodi netopne ionske spojine, to je srebrov(I) klorid. ioni, ki ne reagirajo, ostanejo v vodni raztopini skoraj nespremenjeni, zato lahko reakcijo skrajšamo in posplošimo v ionsko enačbo.[2]
Primer enostavne ionske enačbe:
Topnost
Topnost je pojem, ki označuje največjo količino topljenca, ki ga lahko raztopimo v neki količini določenega topila pri določeni temperaturi.[3]
Dobro topne ionske spojine
Nekatere ionske spojine so topne v topilu. Če je ionska spojina topna v topilu, nastane raztopina elektrolita, ki vsebuje raztopljene ione. Takšno raztopino lahko segrevamo in tako izparevamo topilo. Ioni, ki so bili raztopljeni v raztopini, ostanejo v posodi in ne izparijo. Ostanek ionov v raztopini se začne koncentrirati. Oblikujejo mala kristalna jedra, iz katerih se razvijejo večja kristalna jedra oziroma ionski kristali.
Pravilo
Vse spojine, ki vsebujejo anione: NO3-, CH3COO- ali ClO3-, so v vodi dobro topne. Primeri takih spojin so NaNO3, Ca(CH3COO)2 in KClO3.[4]
Vse spojine, ki vsebujejo enega od kationov 1. skupine periodnega sistema ali amonijev ion (NH4+), so v vodi tudi dobro topne. Primeri takih ionskih spojin so LiOH, Na2SO4, K3PO4, RbBr, CsCl in (NH4)2CO3.[4]
| Ionska spojina | Kation | Anion |
|---|---|---|
| NaCl | Na+ | Cl- |
| Na2SO4 | Na+ | SO42- |
| KOH | K+ | OH- |
| NH4NO3 | NH4+ | NO3- |
Slabo topne ionske spojine
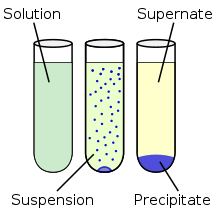
Netopne ionske spojine lahko nastanejo ob mešanju dveh raztopin, ki imata vsaka svojo vrsto ionov (npr. prva raztopina ima srebrove katione, druga pa kloridne anione). V raztopini se izloči težka netopna oborina, ki se vidi kot motna raztopina. Proces nastajanja netopne ionske spojine (oborine) imenujejo obarjanje. Postopek, ki ga uporabljamo za ločevanje oborine od raztopine, se imenuje filtracija.
Pravilo
Vse ionske spojine, ki vsebujejo težke kovine, so netopne. To so na primer spojine AgX, kjer je X halogeni element (jod, klor in brom).[4]
Vsi sulfidi (S2-) in hidroksidi (OH-), razen tistih iz 1. in 2. skupine periodnega sistema elementov in iona NH4+, so netopni.[4]
Vsi karbonati (CO32-), sulfati(IV) (SO32-) in fosfati(V) (PO43-), razen tistih iz 1. skupine periodnega sistema elementov in iona NH4+, so prav tako netopni.
| Ionska spojina | Kation | Anion |
|---|---|---|
| CaCO3 | Ca2+ | CO32- |
| Ag2SO4 | Ag+ | SO42- |
| Fe(OH)3 | Fe3+ | OH- |

Atomi 1. in 2. skupine periodnega sistema elementov oddajajo elektrone in postanejo pozitivno nabiti kationi, ki imajo za določeno število manj elektronov kot njihov atom. Atomi 5., 6. in 7. glavne skupine sprejemajo elektrone in postanejo negativno nabiti anioni. Pozitivno nabiti kationi in negativno nabiti anioni se med seboj privlačijo zaradi različne nabitosti. Posledica teh privlak je ionska vez. V ionskih spojinah so interakcije med kationi in anione t. i. ionske vezi.
Medsebojna razporeditev ionov v ionskih kristalih enostavnih binarnih spojin je odvisna od:
- stehiometrije spojine, tj. od razmerja števila enih in drugih drugih atomov v spojinah tipa AB, AB2, AB3, A2B3 itd.
- od razmerja velikosti oziroma polmerov ionov v kristalni strukturi. [5]
Razporeditev atomov ali enoatomnih ionov v kristalu opredeli koordinacijsko število, ki pove, s kolikimi atomi je obkrožen atom v centru koordinacijskega poliedra.
Za najenostavnejše ionske spojine tipa AB in AB2 so koordinacijska števila največkrat 6, 8 in tudi 4. Enostavni liki in geometrijska telesa so koordinacijski poliedri, ki jih opišejo atomi ene vrste (A), obkroženi z atomi druge vrste (B). Najenostavnejši med njimi so trikotnik (3), tetraeder in kvadrat (4), oktaeder (6) in kocka (8). Številka v oklepaju pove število enakih atomov ali ionov v poliedru.
Binarne spojine tipa AB
| Razmerje radijev med | Spojina tipa AB | ||
|---|---|---|---|
| Koordinacijski števili | Strukturni tip | Koordinacijski polieder | |
| 1 : 0,732 in 1 : 1 | 8 : 8 | CsCl | kocka |
| 1 : 0,414 in 1 : 0,732 | 6 : 6 | NaCl
NiAs |
oktaeder
trikotna prizma |
| 1 : 0,225 in 1 : 0,414 | 4 : 4 | ZnS(kubični najgostejši sklad)
ZnS(heksagonalni najgostejši sklad) |
tetraeder
tetraeder |

Struktura AB8/8
Koordinacijsko število je v večini primerov 8, če je razmerje polmerov ionov v spojini AB večje od 0,73. V sredini kocke je atom ene vrste, na ogliščih pa nasprotno nabiti ioni (slika desno).[5] Razmerje obeh ionov se izračuna tako, da število oglišč (8) pomnožimo z 1/8 in naredimo razmerje 1 : 1. Za lažji pregled napišemo, da ima spojina AB strukturo AB8/8.
Izračun razmerja ionov se izračuna po enačbi:
Spojine, ki imajo strukturo in razmerje ionov 1 : 1, so poimenovane po cezijevem kloridu (CsCl), torej jim pravimo, da imajo strukturo cezijevega klorida, kar je posledica kristalizacije po CsCl-tipu. Ioni cezijevega klorida (Cs+ in Cl-) se razporedijo v obliko dveh primitivnih skladov, ki sta strukturno zamaknjena za eno polovico telesne diagonale v smeri oglišča proti centru kocke.[5] Med alkalijskimi halogenidi imata takšno strukturo tudi cezijev bromid (CsBr) in cezijev jodid (CsI).[6]
Struktura AB6/6

Vsa razmerja med 0,41 in 0,73 opredelijo večinoma oktaedrsko koordinacijo AB6/6. Eni atomi ali ioni zasedejo lege v točkah ploskovno centrirane kocke, drugi pa oktaedrske praznine na sredini robov in v centru kocke. Oboji se razporedijo v kubično najgostejša sklada, ki sta zamaknjena za polovico roba kubične ploskovno centrirane osnovne celice. Spojine AB z oktaedrično koordinacijo kristalizirajo po t. i. NaCl-tipu strukture oziroma po strukturi natrijevega klorida.[6]
Struktura AB4/4
Na razmerja, ki so manjša od 0,41, naletimo v spojinah, ki so zgrajene iz dovolj majhnih kationov A2+ (npr. Mg2+ in Zn2+) in velikih anionov B2- (npr. S2-, Se2- in I-). Koordinacija je tetraedrska oziroma AB4/4. Ioni so razporejeni v:
- kubična najgostejša sklada, ki sta zamaknjena za 1/4 prostorske diagonale v smeri od izhodišča po diagonali. Tip take strukture je poimenovan po sfaleritu , ki je eden izmed dveh polimorfov cinkovega sulfida (ZnS). Spojine imajo sfaleritno zgradbo oziroma kristalizirajo po ZnS-tipu.
- heksagonalna najgostejša sklada , ki sta vpeta drug v drugega, tako da se polovica plasti obeh ionov v projekciji prekriva, polovica pa jih je zamaknjenih.[6]
Ionske spojine, med katere spadajo tudi soli, so praviloma trdnine s kristalno strukturo.
Gostota
Ionske spojine imajo visoko gostoto.
Tališče in vrelišče
Ionske spojine imajo visoka tališča in vrelišča, ker so kationi in anioni v spojini povezani z močnimi elektrostatskimi vezmi. Za prekinitev teh vezi je potrebna velika količina energije.
Električna prevodnost
Raztopine in taline ionskih spojin dobro prevajajo električni tok, saj vsebujejo proste katione in anione.
| Splošno | NaCl | AgCl | |
|---|---|---|---|
| Gostota [g/cm3] | visoka | 2,165 | 5,56 |
| Tališče [° C] | visoko | 801 | 455 |
| Vrelišče [° C] | visoko | 1413 | 1547 |
| Električna prevodnost v vodi | zelo dobra | da | ne |
| Topnost [g/100 g H2O] pri 20° C | dobra/slaba | 35,9 | 192,3·10-6 |
| Vez | ionska vez | ||
Iz lastnosti, ki so predstavljene v zgornji tabli, je razvidno, da določena splošna pravila nekaterih fizikalnih lastnosti ne veljajo za vse ionske spojine. Da določimo točne lastnosti ionskih spojin, moramo poiskati ustrezen fizikalno-kemijski priročnik, ki podaja fizikalne in kemijske količine za vsako kemijsko substanco posebej.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.



