Terc-Butanol
From Wikipedia, the free encyclopedia
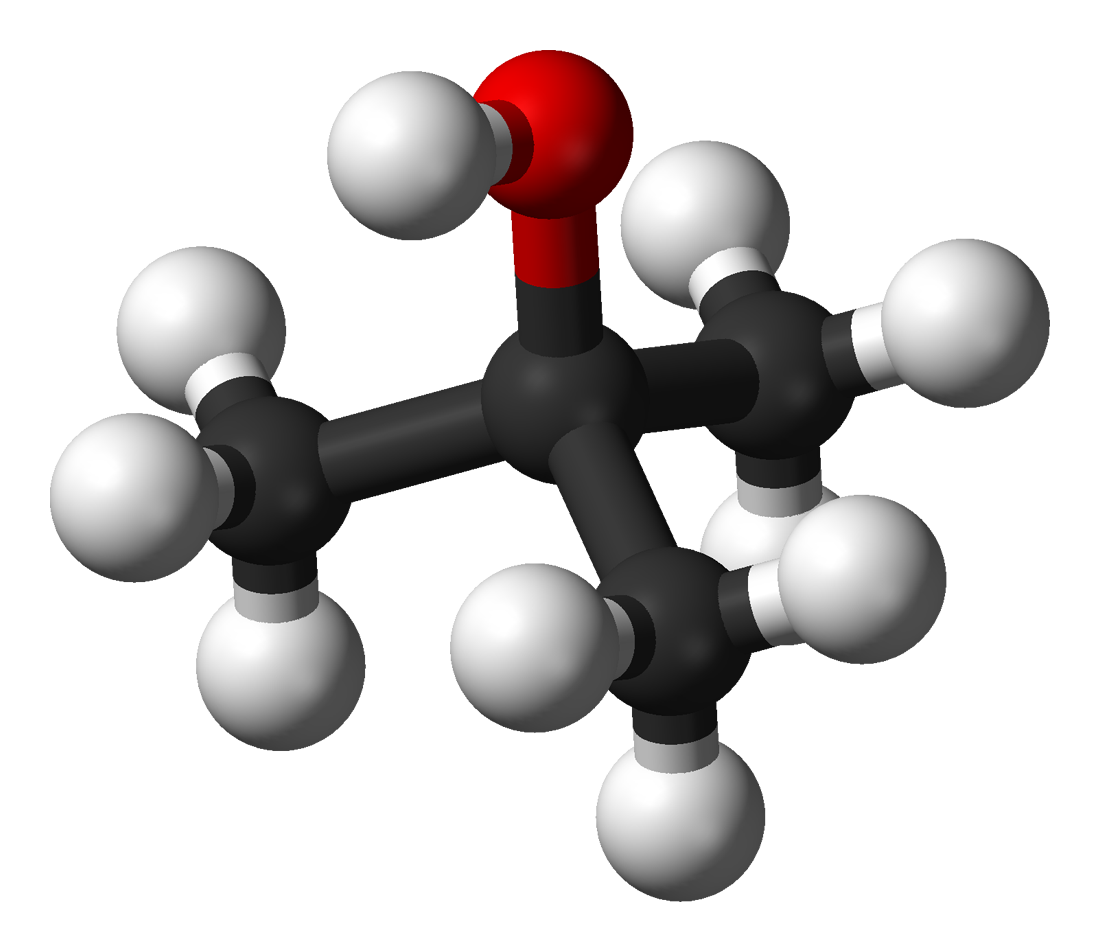
terc-Butanol (2-metil-2-propanol) je najjednostavniji tercijarni alkohol. On je jedan od četiri izomera butanola. terc-Butanol je prozirna tečnost (ili bezbojna tečnost) sa mirisom sličnog kamforu. On je veoma rastvoran u vodi i meša se sa etanolom i etrom. On je jedinstven među izomerima butanola, jer je obično čvrst na sobnoj temperaturi, sa tačkom topljenja koja je malo iznad 25 °C.
| terc-Butanol | |
|---|---|
 |
 |
 | |
| IUPAC ime | |
| Drugi nazivi | terc-Butil alkohol[1] 2-Metil-2-propanol[1] |
| Identifikacija | |
| CAS registarski broj | 75-65-0 |
| PubChem[2][3] | 6386 |
| ChemSpider[4] | 6146 |
| UNII | MD83SFE959 |
| EINECS broj | |
| UN broj | 1120 |
| DrugBank | DB03900 |
| MeSH | |
| ChEBI | 45895 |
| ChEMBL[5] | CHEMBL16502 |
| RTECS registarski broj toksičnosti | EO1925000 |
| Bajlštajn | 906698 |
| Gmelin Referenca | 1833 |
| Jmol-3D slike | Slika 1 |
| Svojstva | |
| Molekulska formula | C4H10O |
| Molarna masa | 74.12 g mol−1 |
| Agregatno stanje | Bezbojna tečnost |
| Miris | Miris kamfora |
| Gustina | 0,775 g/mL |
| Tačka topljenja |
25-26 °C, 298-299 K, 77-79 °F |
| Tačka ključanja |
82-83 °C, 355-356 K, 179-181 °F |
| log P | 0,584 |
| Napon pare | 4,1 kPa (na 20 °C) |
| Indeks prelamanja (nD) | 1,387 |
| Termohemija | |
| Standardna entalpija stvaranja jedinjenja ΔfH |
−360,04–−358,36 kJ mol−1 |
| Std entalpija sagorevanja ΔcH |
−2,64479–−2,64321 MJ mol−1 |
| Standardna molarna entropija S |
189,5 J K−1 mol−1 |
| Specifični toplotni kapacitet, C | 215,37 J K−1 mol−1 |
| Opasnost | |
| Podaci o bezbednosti prilikom rukovanja (MSDS) | inchem.org |
| EU-klasifikacija | |
| EU-indeks | 603-005-00-1 |
| NFPA 704 | |
| R-oznake | R11, R20, R36/37 |
| S-oznake | S2, S9, S16, S46 |
| Tačka paljenja | 11 °C |
| Tačka spontanog paljenja | 480 °C |
| Eksplozivni limiti | 2,4–8,0% |
| Srodna jedinjenja | |
| Srodna butanoli | 2-Butanol |
| Srodna jedinjenja | 2-Metil-2-butanol |
|
(šta je ovo?)
(verifikuj)
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |
| Infobox references | |
Hemija
Tercijarni alkohol, terc-butanol je stabilniji u pogledu oksidacije i manje je reaktivan od drugih izomera butanola.
Kad se terc-butanol deprotonizuje sa jakom bazom, produkt je alkoksidni anjon. U ovom slučaju, to je terc-butoksid. Na primer, široko korišteni organski reagens kalijum terc-butoksid se priprema reakcijom suvog terc-butanola sa kalijumom.[6]
- K + tBuOH → tBuO−K+ + 1/2 H2
Konverzija u alkil halide
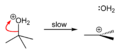
terc-Butanol reaguje sa hlorovodonikom da formira terc-butil hlorid i vodu putem SN1 mehanizma.
- Korak 1
- Korak 2
- Korak 3
Sveukupna reakcija je stoga:
Pošto je terc-butanol tercijarni alkohol, relativna stabilnost terc-butil karbokatjona u koraku 2 omogućava SN1 mehanizam. Primarni alkoholi generalno podležu SN2 mehanizmu jer je relativna stabilnost primarnog karbokatjonskog intermedijaar veoma niska. Tercijarni karbokatjon je u ovom slučaju stabilizovan putem hiperkonjugacijek, pri čem susedne C–H sigma veze doniraju elektrone u praznu p-orbitalu karbokatjona.
Reference
Vanjske veze
Wikiwand - on
Seamless Wikipedia browsing. On steroids.