From Wikipedia, the free encyclopedia
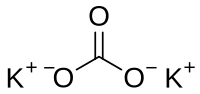
Kalijum karbonat (molekulska formula K2CO3) je hemijsko jedinjenje, kalijumova so ugljene kiseline.[1][2] Kalijum karbonat je bezbojna kristalna supstancija veoma dobro rastvorljiva u vodi; 93.7 g u 100 g vode. Temperatura topljenja kalijum karbonata iznosi 891 °C. On gradi hidrate, u vodenim rastvorima se hidrolizuje. Pod uticajem kiselina podleže raspadu na ugljen dioksid i kalijum oksid.
| Kalijum karbonat | |
|---|---|
 | |
 | |
 | |
| IUPAC ime | |
| Drugi nazivi | Potaša |
| Identifikacija | |
| CAS registarski broj | 584-08-7 |
| MeSH | |
| RTECS registarski broj toksičnosti | TS7750000 |
| Svojstva | |
| Molekulska formula | K2CO3 |
| Molarna masa | 138.2055 g/mol |
| Agregatno stanje | Čvrsta bela higroskopna supstanca |
| Gustina | 2.29 g/cm3, osnovno |
| Tačka topljenja |
891 °C |
| Tačka ključanja |
razgrađuje se |
| Rastvorljivost u vodi | 112 g/100 mL (20 °C) |
| Opasnost | |
| NFPA 704 | |
| Tačka paljenja | nije zapaljiv |
| Srodna jedinjenja | |
| Drugi katjoni | litijum-karbonat, natrijum-karbonat, cezijum-karbonat |
|
| |
| Infobox references | |
Kalijum karbonat se dobija uvođenjem ugljen dioksida u vodeni rastvor kalijum hidroksida. Koristi se u industriji stakla, keramike, za produkciju sredstava za pranje, u fotografiji i za dobijanje drugih jedinjenja kalijuma.
Molekulska masa kalijum karbonata je 138.2 u.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.