Loading AI tools
группа железосодержащих белков животных, которые обеспечивают перенос кислорода в ткани Из Википедии, свободной энциклопедии
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода[2]. Один грамм гемоглобина может переносить до 1,331 мл кислорода[3].
В другом языковом разделе есть более полная статья Hemoglobin (англ.). |
| Гемоглобин | |
|---|---|
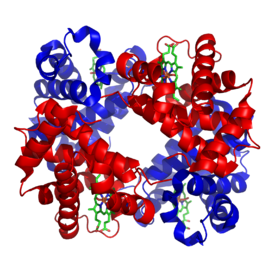 Структура человеческого гемоглобина. "'α"' и "'β"' субъединицы выделены красным и синим соответственно, а железосодержащий гем группы в зеленом цвете. Из PDB 1GZX | |
| Идентификаторы | |
| Символ | Hb |

Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[5][6]
В 1825 году Иоганн Фридрих Энгельхарт обнаружил, что соотношение железа и белка одинаково в гемоглобинах нескольких видов[7][8]. Из известной атомной массы железа он рассчитал молекулярную массу гемоглобина до n × 16000 (n = число атомов железа в гемоглобине, теперь известное как 4). Этот «поспешный вывод» вызвал в то время много насмешек со стороны учёных, которые не могли поверить, что какая-либо молекула может быть такой большой. Гилберт Смитсон Адэр подтвердил результаты Энгельхарта в 1925 году, измерив осмотическое давление растворов гемоглобина[9].
Хотя кровь была известна как переносчик кислорода по крайней мере с 1794 года[10][11], свойство гемоглобина переносить кислород было описано Хюнефельдом в 1840 году[12]. В 1851 году немецкий физиолог Отто Функе опубликовал серию статей, в которых он описал выращивание кристаллов гемоглобина путём последовательного разбавления эритроцитов растворителем, таким как чистая вода, спирт или эфир, с последующим медленным испарением растворителя из полученного белкового раствора[13][14]. Обратимая оксигенация гемоглобина была описана несколько лет спустя Феликсом Хоппе-Сейлером[15].
В 1959 году Макс Фердинанд Перуц определил молекулярную структуру гемоглобина методом рентгеновской кристаллографии[16][17]. Эта работа привела к тому, что он разделил с Джоном Кендрю Нобелевскую премию по химии 1962 года за их исследования структур глобулярных белков[18].
Роль гемоглобина в крови выяснил французский физиолог Клод Бернар. Название гемоглобин происходит от слов гем и глобин, отражая тот факт, что каждая субъединица гемоглобина представляет собой глобулярный белок со встроенной группой гема. Каждая группа гема содержит один атом железа, который может связывать одну молекулу кислорода с помощью ионно-индуцированных дипольных сил. Наиболее распространенный тип гемоглобина у млекопитающих содержит четыре такие субъединицы.


Гемоглобин состоит из белковых субъединиц (молекул глобина), а эти белки, в свою очередь, представляют собой свернутые цепочки из большого количества различных аминокислот, называемых полипептидами. Аминокислотная последовательность любого полипептида, созданного клеткой, в свою очередь определяется участками ДНК, называемыми генами. Во всех белках именно аминокислотная последовательность определяет химические свойства и функцию белка.
Существует более одного гена гемоглобина: у людей гемоглобин А (основная форма гемоглобина, присутствующая у взрослых) кодируется генами HBA1, HBA2 и HBB[19].Субъединицы альфа 1 и альфа 2 гемоглобина кодируются генами HBA1 и HBA2 соответственно, которые находятся на хромосоме 16 и близки друг к другу. Бета-субъединица гемоглобина кодируется геном HBB, который находится на хромосоме 11 . Аминокислотные последовательности глобиновых белков в гемоглобинах обычно различаются у разных видов. Эти различия растут с эволюционным расстоянием между видами. Например, наиболее распространенные последовательности гемоглобина у людей, бонобо и шимпанзе полностью идентичны, даже без единой аминокислотной разницы в белковых цепях альфа- или бета-глобина[20][21][22]. В то время как гемоглобин человека и гориллы отличается по одной аминокислоте в альфа- и бета-цепях, эти различия увеличиваются между менее близкородственными видами.
Даже внутри видов существует вариабельность гемоглобина, хотя одна последовательность обычно является «наиболее распространенной» у каждого вида. Мутации в генах белка гемоглобина у вида приводят к вариантам гемоглобина[23][24]. Многие из этих мутантных форм гемоглобина не вызывают никаких заболеваний. Однако некоторые из этих мутантных форм гемоглобина вызывают группу наследственных заболеваний, называемых гемоглобинопатиями. Наиболее известной гемоглобинопатией является серповидно-клеточная анемия, которая была первым заболеванием человека, механизм которого был понят на молекулярном уровне. (в основном) отдельный набор заболеваний, называемых талассемия включает в себя недостаточное производство нормальных, а иногда и аномальных гемоглобинов из-за проблем и мутаций в регуляции гена глобина. Все эти заболевания вызывают анемию[25].
Вариации аминокислотных последовательностей гемоглобина, как и в случае с другими белками, могут быть адаптивными. Например, было обнаружено, что гемоглобин по-разному адаптируется к большим высотам. Организмы, живущие на больших высотах, испытывают более низкое парциальное давление кислорода по сравнению с таковым на уровне моря. Это представляет проблему для организмов, населяющих такие среды, потому что гемоглобин, который обычно связывает кислород при высоких парциальных давлениях кислорода, должен быть способен связывать кислород, когда он присутствует при более низком давлении. Различные организмы приспособились к такой проблеме. Например, недавние исследования показали генетические варианты у мышей-оленей, которые помогают объяснить, как мыши-олени, живущие в горах, способны выживать в разреженном воздухе, сопровождающем большие высоты. Исследователь из Университета Небраски-Линкольна обнаружил мутации в четырёх разных генах, которые могут объяснить различия между мышами-оленями, живущими в низменных прериях, и в горах. После изучения диких мышей, отловленных как в высокогорьях, так и в низинах, было обнаружено, что: гены двух пород «практически идентичны — за исключением тех, которые регулируют способность их гемоглобина переносить кислород». «Генетическое различие позволяет высокогорным мышам более эффективно использовать свой кислород», поскольку на больших высотах, например, в горах, его доступно меньше[26]. Гемоглобин мамонта отличался мутациями, которые позволяли доставлять кислород при более низких температурах, что позволило мамонтам мигрировать в более высокие широты в плейстоцене[27]. Мутации также были обнаружены у колибри, обитающих в Андах. Колибри уже расходуют много энергии и, следовательно, имеют высокие потребности в кислороде, и все же было обнаружено, что андские колибри процветают на больших высотах. Несинонимичные мутации в гене гемоглобина нескольких видов, живущих на больших высотах (Oreotrochilus, A. castelnaudii, C. violifer, P. gigas и A. viridicuada), привели к тому, что белок имеет меньшее сродство к инозитол-гексафосфату (IHP), молекуле, обнаруженная у птиц, которая играет ту же роль, что и 2,3-BPG у людей; это приводит к способности связывать кислород при более низких парциальных давлениях[28].
Уникальные кровеносные легкие птиц также способствуют эффективному использованию кислорода при низком парциальном давлении O2. Эти две адаптации усиливают друг друга и объясняют замечательные высотные характеристики птиц.
Адаптация гемоглобина распространяется и на людей. У тибетских женщин с генотипами с высоким насыщением кислородом, проживающих на высоте 4000 метров, выживаемость потомства выше[29]. Естественный отбор, по-видимому, является основной силой, воздействующей на этот ген, потому что смертность потомства значительно ниже у женщин с более высоким сродством гемоглобина к кислороду по сравнению со смертностью потомства женщин с низким сродством гемоглобина к кислороду. Хотя точный генотип и механизм, с помощью которого это происходит, пока не ясны, отбор воздействует на способность этих женщин связывать кислород при низких парциальных давлениях, что в целом позволяет им лучше поддерживать важные метаболические процессы.
Гемоглобин (Hb) синтезируется в сложной последовательности этапов. Часть гема синтезируется в несколько этапов в митохондриях и цитозоле незрелых эритроцитов, в то время как части белка глобина синтезируются рибосомами в цитозоле[30]. Выработка Hb продолжается в клетке на протяжении всего её раннего развития от проэритробласта до ретикулоцита в костном мозге. На этом этапе ядро теряется в эритроцитах млекопитающих, но не у птиц и многих других видов. Даже после потери ядра у млекопитающих остаточная рибосомная РНК обеспечивает дальнейший синтез гемоглобина до тех пор, пока ретикулоцит не потеряет свою РНК вскоре после попадания в сосудистую сеть (эта синтетическая гемоглобином РНК фактически придает ретикулоциту его сетчатый вид и название)[31].
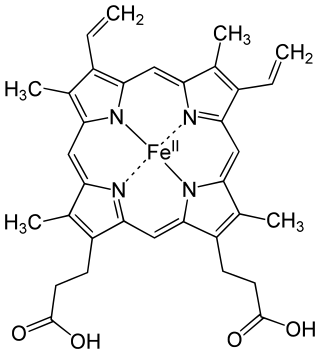
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Несмотря на то, что углекислый газ переносится гемоглобином, он не конкурирует с кислородом за железосвязывающие позиции, а связан с аминогруппами белковых цепей, присоединенных к группам гема.
Ион железа может находиться либо в двухвалентном состоянии Fe2+, либо в трехвалентном состоянии Fe3+, но ферригемоглобин (метгемоглобин) (Fe3+) не может связывать кислород[32]. При связывании кислород временно и обратимо окисляет (Fe2+) до (Fe3+), в то время как кислород временно превращается в супероксидный ион, поэтому железо должно находиться в состоянии окисления +2, чтобы связывать кислород. Если супероксидный ион, связанный с Fe3+, протонируется, железо в гемоглобине останется окисленным и неспособным связывать кислород. В таких случаях фермент метгемоглобинредуктаза сможет в конечном итоге реактивировать метгемоглобин, восстанавливая центр железа.
У взрослых людей наиболее распространенным типом гемоглобина является тетрамер (который содержит четыре субъединицы белка), называемый гемоглобином А, состоящий из двух нековалентно связанных α- и двух β-субъединиц, каждая из которых состоит из 141 и 146 аминокислотных остатков соответственно. Это обозначается как α2 β2. Субъединицы структурно похожи и примерно одинакового размера. Каждая субъединица имеет молекулярную массу около 16 000 дальтон[33], при общей молекулярной массе тетрамера около 64 000 дальтон (64 458 г/моль)[34].Таким образом, 1 г/дЛ = 0,1551 ммоль/л. Гемоглобин А является наиболее интенсивно изучаемой молекулой гемоглобина[35].
У младенцев человека молекула гемоглобина состоит из 2 α-цепей и 2 γ-цепей. По мере роста ребёнка γ-цепи постепенно заменяются β-цепями.
Четыре полипептидные цепи связаны друг с другом с помощью солевых мостиков, водородных связей и гидрофобного эффекта.
В общем, гемоглобин может быть насыщен молекулами кислорода (оксигемоглобин) или ненасыщен молекулами кислорода (дезоксигемоглобин)[36].
Оксигемоглобин образуется во время физиологического дыхания, когда кислород связывается с гемовым компонентом белка гемоглобина в эритроцитах. Этот процесс происходит в легочных капиллярах, прилегающих к альвеолам легких. Затем кислород проходит через кровоток и попадает в клетки, где он используется в качестве конечного акцептора электронов при производстве АТФ в процессе окислительного фосфорилирования. Однако это не помогает противодействовать снижению рН крови. Вентиляция, или дыхание, может обратить вспять это состояние путем удаления углекислого газа, вызывающего, таким образом, изменение рН[37].
Гемоглобин существует в двух формах: натянутой (напряжённой) форме (T, сокр от англ. tense) и расслабленной форме (R, сокр от англ. relax). Различные факторы, такие как низкий pH, высокий CO2 и высокий 2,3 BPG (2,3-бисфосфоглицерат) на уровне тканей, благоприятствуют тугой форме, которая имеет низкое сродство к кислороду и выделяет кислород в тканях. И наоборот, высокий pH, низкий CO2 или низкий 2,3 BPG благоприятствуют расслабленной форме, которая может лучше связывать кислород[38]. Парциальное давление системы также влияет на сродство к O2, где при высоких парциальных давлениях кислорода (например, присутствующих в альвеолах) благоприятствует расслабленное (высокое сродство, R) состояние. И наоборот, при низких парциальных давлениях (таких, как те, которые присутствуют в тканях дыхания) благоприятствует напряжённое состояние (низкая аффинность, T)[39]. Кроме того, связывание кислорода с гемом железа (II) вытягивает железо в плоскость порфиринового кольца, вызывая небольшой конформационный сдвиг. Сдвиг стимулирует связывание кислорода с тремя оставшимися единицами гема в гемоглобине (таким образом, связывание кислорода является кооперативным).
Дезоксигенированный гемоглобин (дезоксигемоглобин) представляет собой форму гемоглобина без связанного кислорода. Спектры поглощения оксигемоглобина и дезоксигемоглобина различаются. Оксигемоглобин имеет значительно меньшее поглощение на длине волны 660 нм, чем дезоксигемоглобин, в то время как при 940 нм его поглощение немного выше. Эта разница используется для измерения количества кислорода в крови пациента с помощью прибора, называемого пульсоксиметром. Это различие также объясняет проявление цианоза, синевато-пурпурного цвета, который развивается в тканях во время гипоксии[40].
Дезоксигенированный гемоглобин парамагнитен; он слабо притягивается магнитными полями[41][42]. Напротив, насыщенный кислородом гемоглобин проявляет диамагнетизм, слабое отталкивание от магнитного поля[42].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—140 г/л; (верхний предел - 150, нижний - 115), у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[43].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемоделюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[44].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином образуя оксигемоглобин. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество (около 1/3) диоксида углерода (CO2) образуя карбгемоглобин и освобождать его в лёгких (2/3 углекислого газа переносится в растворённом виде или в виде солей плазмой крови и цитоплазмой эритроцитов)[45].
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[46]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы (к примеру, отравление нитратами, нитритами, анилином, пиридином) приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.

В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4 субъединиц влияют на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается. Как следствие, кривая связывания гемоглобина с кислородом имеет сигмоидальную или S-образную форму, в отличие от нормальной гиперболической кривой, связанной с некооперативным связыванием.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[47].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[англ.], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Когда срок службы эритроцитов заканчивается из-за старения или дефектов, они удаляются из кровотока фагоцитарной активностью макрофагов в селезенке или печени или гемолитизируются в кровотоке. Затем свободный гемоглобин выводится из кровообращения с помощью переносчика гемоглобина CD163, который экспрессируется исключительно на моноцитах или макрофагах. В этих клетках молекула гемоглобина расщепляется, и железо перерабатывается. В результате этого процесса также образуется одна молекула монооксида углерода на каждую разрушенную молекулу гема[48]. Деградация гема является единственным естественным источником окиси углерода в организме человека и отвечает за нормальный уровень окиси углерода в крови у людей, дышащих обычным воздухом[49].
Другим основным конечным продуктом распада гема является билирубин. Повышенный уровень этого химического вещества обнаруживается в крови, если эритроциты разрушаются быстрее, чем обычно. Неправильно расщепленный белок гемоглобина или гемоглобин, который слишком быстро выделяется из клеток крови, может закупоривать мелкие кровеносные сосуды, особенно тонкие кровеносные фильтрующие сосуды почек, вызывая повреждение почек. Железо удаляется из гема и сохраняется для последующего использования, сохраняется в тканях в виде гемосидерина или ферритина и переносится в плазме бета-глобулинами в виде трансферринов. Когда порфириновое кольцо распадается, его фрагменты обычно выделяются в виде жёлтого пигмента, называемого билирубином, который выделяется в кишечник в виде желчи. Кишечник метаболизирует билирубин в уробилиноген. Уробилиноген выводится из организма с калом в виде пигмента, называемого стеркобилином. Глобулин метаболизируется в аминокислоты, которые затем высвобождаются в кровоток.

Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
Ученые согласны с тем, что событие, которое отделило миоглобин от гемоглобина, произошло после того, как миноги отделились от челюстных позвоночных[51]. Это разделение миоглобина и гемоглобина позволило возникнуть и развиться различным функциям двух молекул: миоглобин в большей степени связан с хранением кислорода, в то время как гемоглобину поручено транспортировать кислород[52]. α- и β-подобные гены глобина кодируют отдельные субъединицы белка[53]. Предшественники этих генов возникли в результате дублирования, также после того, как общий предок гнатосом произошел от бесчелюстной рыбы, примерно 450—500 миллионов лет назад[51]. Исследования реконструкции предков показывают, что предком генов α и β, предшествовавших удвоению, был димер, состоящий из идентичных субъединиц глобина, которые затем эволюционировали, чтобы после дублирования собраться в тетрамерную архитектуру[54]. Развитие α и β генов создало потенциал для того, чтобы гемоглобин состоял из множества отдельных субъединиц, физический состав которых играет центральную роль в способности гемоглобина переносить кислород. Наличие нескольких субъединиц способствует способности гемоглобина совместно связывать кислород, а также аллостерически регулироваться[52][54]. Впоследствии α-ген также подвергся дупликации с образованием генов HBA1 и HBA2[55]. Эти дальнейшие дупликации и расхождения создали широкий спектр α- и β-подобных генов глобина, которые регулируются таким образом, что определённые формы возникают на разных стадиях развития[52].
Большинство ледяных рыб семейства Channichthyidae утратили свои гены гемоглобина в результате адаптации к холодной воде[56].
Гемоглобин можно отслеживать неинвазивно, чтобы создать индивидуальный набор данных, отслеживающий эффекты гемоконцентрации и гемодилюции повседневной деятельности для лучшего понимания спортивных результатов и тренировок. Спортсмены часто обеспокоены выносливостью и интенсивностью упражнений. Датчик использует светодиоды, которые излучают красный и инфракрасный свет через ткань к детектору света, который затем посылает сигнал на процессор для вычисления поглощения света белком гемоглобина[57]. Этот датчик похож на пульсоксиметр, который состоит из небольшого чувствительного устройства, которое крепится к пальцу.

В организмах животного и растительного царств существует множество белков, переносящих и связывающих кислород. Организмы, включая бактерии, простейшие и грибы, имеют гемоглобиноподобные белки, известные и предсказанные роли которых включают обратимое связывание газообразных лигандов. Поскольку многие из этих белков содержат глобины и гемовую часть (железо в плоской порфириновой оболочке), их часто называют гемоглобинами, даже если их общая третичная структура сильно отличается от структуры гемоглобина позвоночных. В частности, различие между «миоглобином» и гемоглобином у низших животных часто невозможно, потому что некоторые из этих организмов не содержат мышц. Или у них может быть узнаваемая отдельная система кровообращения, но не та, которая занимается переносом кислорода (например, у многих насекомых и других членистоногих). Во всех этих группах молекулы, содержащие гем/глобин (даже мономерные глобиновые), которые связаны с связыванием газов, называются оксигемоглобинами. В дополнение к транспортировке и восприятию кислорода, они также могут иметь дело с NO, CO2, сульфидными соединениями и даже поглощением O2 в средах, которые должны быть анаэробными[58]. Они могут даже заниматься детоксикацией хлорированных материалов способом, аналогичным гем-содержащим ферментам Р450 и пероксидазам.
Структура гемоглобинов различается у разных видов. Гемоглобин встречается во всех царствах организмов, но не во всех организмах. Примитивные виды, такие как бактерии, простейшие, водоросли и растения, часто содержат гемоглобины с одним глобином. Многие черви-нематоды, моллюски и ракообразные содержат очень большие многоэлементные молекулы, намного большие, чем у позвоночных. В частности, химерные гемоглобины, обнаруженные у грибов и гигантских кольчатых червей, могут содержать как глобин, так и другие типы белков[59].
Одним из наиболее поразительных случаев и применений гемоглобина в организмах является гигантский трубчатый червь (Riftia pachyptila, также называемый Vestimentifera), который может достигать 2,4 метра в длину и населяет океанские вулканические жерла. Вместо пищеварительного тракта эти черви содержат популяцию бактерий, составляющих половину веса организма. Бактерии окисляют H2S из вентиляционного отверстия с помощью O2 из воды для получения энергии для приготовления пищи из H2O и CO2. Верхний конец червей представляет собой темно-красную веерообразную структуру («шлейф»), которая уходит в воду и поглощает H2S и O2 для бактерий и CO2 для использования в качестве синтетического сырья, аналогичного фотосинтезирующим растениям. Структуры ярко-красного цвета из-за содержания в них нескольких чрезвычайно сложных гемоглобинов, которые содержат до 144 цепей глобина, каждая из которых включает связанные структуры гема. Эти гемоглобины примечательны тем, что способны переносить кислород в присутствии сульфида и даже переносить сульфид, не будучи полностью «отравленными» или подавленными им, как гемоглобины у большинства других видов[60][61].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.