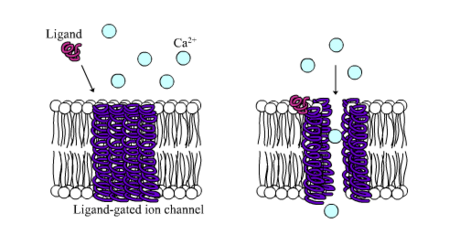
Лиганд-зависимые ионные каналы, лиганд-управляемые или лиганд-активируемые ионные каналы — также обычно называемые ионотропными рецепторами, представляют собой группу трансмембранных белков ионных каналов, которые позволяют ионам, например, Na+, K+, Ca2+ и/или Cl-, проходить через биологическую мембрану, посредством изменения конформации (открытия) в ответ на связывание химического мессенджера (то есть лиганда), такого как, например, молекулы нейромедиатора[1][2][3].
| Нейромедиатор-зависимый ионный канал, трансмембранный регион | |
|---|---|
 Лиганд-зависимый ионный канал | |
| Идентификаторы | |
| Символ | Neur_chan_memb |
| Pfam | PF02932 |
| InterPro | IPR006029 |
| PROSITE | PDOC00209 |
| SCOP | 1cek |
| SUPERFAMILY | 1cek |
| TCDB | 1.A.9 |
| OPM superfamily | 14 |
| OPM protein | 2bg9 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Ионные каналы с цистеиновой петлёй

Цис-петлевые рецепторы названы в честь характерного цикла, который образован дисульфидной связью между двумя остатками молекул цистеина в N-концевом внеклеточном домене. Они являются частью большого семейства пентамерных лиганд-ионных каналов, которые обычно не имеют данной дисульфидной связи, поэтому их условное название «рецепторы Pro-loop»[4][5].
Структура
Цис-петлевые рецепторы имеют структурные элементы, которые высококонсервативны, причём большой внешнеклеточный домен (ECD) содержит альфу-спираль и 10 бета-тяжей. Следующие за ECD четыре трансмембранных сегмента (TMS) связаны внутриклеточными и внешнеклеточными структурами петли[6]. За исключением петли TMS 3-4, их длина составляет всего 7-14 остатков. Петля TMS 3-4 образует наибольшую часть внутриклеточного домена (ICD), при этом она является наиболее вариабельной (изменчивой) областью между всеми этими гомологичными рецепторами. ICD определяется петлёй TMS 3-4 вместе с петлей TMS 1-2, предшествующей поре ионного канала[6]. Кристаллизация рецепторов выявила структуры для некоторых членов семейства, но для обеспечения возможности кристаллизации внутриклеточную петлю обычно заменяли коротким линкером, присутствующим в прокариотических цис-петлевых рецепторах, поэтому их структуры не известны. Тем не менее, эта внутриклеточная петля, по-видимому, функционирует при десенсибилизации, модуляции физиологии канала лекарственными веществами и посттрансляционных модификациях. В нём присутствуют мотивы важные для движения, и ICD взаимодействует с белками каркаса, обеспечивая ингибирующее образование синапсов[6].
Прототипный лиганд-зависимый ионный канал представляет собой никотиновый ацетилхолиновый рецептор. Он состоит из пентамерных белковых субъединиц (обычно ααβγδ), включая два сайта связывания ацетилхолина (по одному на границе раздела каждой альфа-субъединицы). В нормальных физиологических условиях рецептору нужно ровно две молекулы ацетилхолина, чтобы открыть канал[7]. Открытие канала позволяет положительно заряженным ионам перемещаться по нему; в частности, ионы натрия (Na+) входят во внутрь клетки, а ионы калия выходят (К+).
Глициновые рецепторы
Глициновый рецептор (сокращенно GlyR или GLR) является рецептором аминокислоты-нейромедиатора — глицина. GlyR является цис-петлевым ионотропным рецептором, который оказывает своё действие посредством потока ионов хлора (Cl-). Он является одним из наиболее широко распространённых ингибиторных (тормозных) рецепторов в центральной нервной системе и играет важную роль в различных физиологических процессах, особенно в обеспечении торможения нейротрансмиссии в спинном мозге и стволе мозга[8].
Рецептор может активироваться рядом простых аминокислот, включая глицин, β-аланин и таурин, и может избирательно блокироваться конкурентным антагонистом с высоким сродством — стрихнином[9]. Кофеин является конкурентным антагонистом GlyR[10].
Рецепторы этого семейства расположены в виде пяти субъединиц (пентамеров), окружающих центральную пору, причём каждая субъединица состоит из четырёх α-спиральных трансмембранных сегментов[11]. В настоящее время известно четыре изоформы α-субъединицы (α1-4) GlyR, которые необходимы для связывания лигандов (GLRA1, GLRA2, GLRA3, GLRA4) и одной β-субъединицы (GLRB).
Типы катионных цис-петлевых рецепторов
| Тип | Класс | Название белков согласно рекомендации ИЮФАР[12] | Ген | Предыдущие названия |
|---|---|---|---|---|
| Серотониновые рецепторы (5-HT) |
5-HT3 | 5-HT3A 5-HT3B 5-HT3C 5-HT3D 5-HT3E |
HTR3A HTR3B HTR3C HTR3D HTR3E |
5-HT3A 5-HT3B 5-HT3C 5-HT3D 5-HT3E |
| Никотиновый ацетилхолиновый рецептор (nAChR) |
альфа | α1 α2 α3 α4 α5 α6 α7 α9 α10 |
CHRNA1 CHRNA2 CHRNA3 CHRNA4 CHRNA5 CHRNA6 CHRNA7 CHRNA9 CHRNA10 |
ACHRA, ACHRD, CHRNA, CMS2A, FCCMS, SCCMS |
| бета | β1 β2 β3 β4 |
CHRNB1 CHRNB2 CHRNB3 CHRNB4 |
CMS2A, SCCMS, ACHRB, CHRNB, CMS1D EFNL3, nAChRB2 | |
| гамма | γ | CHRNG | ACHRG | |
| дельта | δ | CHRND | ACHRD, CMS2A, FCCMS, SCCMS | |
| эпсилон | ε | CHRNE | ACHRE, CMS1D, CMS1E, CMS2A, FCCMS, SCCMS | |
| Цинк-активируемые ионные каналы (ZAC) |
ZAC | ZACN | ZAC1, L2m LICZ, LICZ1 |
Типы анионных цис-петлевых рецепторов
| Тип | Класс | Название белков согласно рекомендации ИЮФАР[12] | Ген | Предыдущие названия |
|---|---|---|---|---|
| ГАМКA | альфа | α1 α2 α3 α4 α5 α6 |
GABRA1 GABRA2 GABRA3 GABRA4 GABRA5 GABRA6 |
EJM, ECA4 |
| бета | β1 β2 β3 |
GABRB1 GABRB2 GABRB3 |
ECA5 | |
| гамма | γ1 γ2 γ3 |
GABRG1 GABRG2 GABRG3 |
CAE2, ECA2, GEFSP3 | |
| дельта | δ | GABRD | ||
| эпсилон | ε | GABRE | ||
| пи | π | GABRP | ||
| тета | θ | GABRQ | ||
| ро | ρ1 ρ2 ρ3 |
GABRR1 GABRR2 GABRR3 |
ГАМКC[13] | |
| Глициновый рецептор (GlyR) |
альфа | α1 α2 α3 α4 |
GLRA1 GLRA2 GLRA3 GLRA4 |
STHE |
| бета | β | GLRB |
Глутаматные ионотропные рецепторы
Ионотропные глутаматные рецепторы связывают молекулы нейромедиатора — глутамат. Они образуют тетрамеры с каждой субъединицей, состоящей из внешнеклеточного амино-концевого домена (ATD, в котором происходит тетрамерная сборка), внешнеклеточный лиганд-связывающий домен (LBD, который связывает глутамат) и трансмембранный домен (TMD, который образует ионный канал). Трансмембранный домен каждой субъединицы содержит три трансмембранные спирали, а также полумембранную спираль с реентерабельной петлёй. Структура белка начинается с ATD на N-конце, за которым следует первая половина LBD, которая прерывается спиралями 1,2 и 3 TMD перед продолжением второй половины LBD, а затем заканчивается спиралью 4 TMD на C-конце[14]. Это означает, что между TMD и внеклеточными доменами существует три связи. Каждая субъединица тетрамера имеет сайт связывания для глутамата, образованного двумя секциями LBD, образующими форму с раскладушкой. Только два из этих сайтов в тетрамере должны быть заняты, чтобы открыть ионный канал. Пора в основном образована половинной спиралью 2, которая по структуре напоминает перевернутый калиевый канал.
| Тип | Класс | Название белков согласно рекомендации ИЮФАР[12] | Ген | Предыдущее название |
|---|---|---|---|---|
| AMPA-рецептор | GluA | GluA1 GluA2 GluA3 GluA4 |
GRIA1 GRIA2 GRIA3 GRIA4 |
GLUA1, GluR1, GluRA, GluR-A, GluR-K1, HBGR1 GLUA2, GluR2, GluRB, GluR-B, GluR-K2, HBGR2 GLUA3, GluR3, GluRC, GluR-C, GluR-K3 GLUA4, GluR4, GluRD, GluR-D |
| Каинатный рецептор | GluK | GluK1 GluK2 GluK3 GluK4 GluK5 |
GRIK1 GRIK2 GRIK3 GRIK4 GRIK5 |
GLUK5, GluR5, GluR-5, EAA3 GLUK6, GluR6, GluR-6, EAA4 GLUK7, GluR7, GluR-7, EAA5 GLUK1, KA1, KA-1, EAA1 GLUK2, KA2, KA-2, EAA2 |
| NMDA-рецептор | GluN | GluN1 NRL1A NRL1B |
GRIN1 GRINL1A GRINL1B |
GLUN1, NMDA-R1, NR1, GluRξ1 |
| GluN2A GluN2B GluN2C GluN2D |
GRIN2A GRIN2B GRIN2C GRIN2D |
GLUN2A, NMDA-R2A, NR2A, GluRε1 GLUN2B, NMDA-R2B, NR2B, hNR3, GluRε2 GLUN2C, NMDA-R2C, NR2C, GluRε3 GLUN2D, NMDA-R2D, NR2D, GluRε4 | ||
| GluN3A GluN3B |
GRIN3A GRIN3B |
GLUN3A, NMDA-R3A, NMDAR-L, chi-1 GLU3B, NMDA-R3B | ||
| ‘Орфанный’ (рецептор-сирота) | (GluD) | GluD1 GluD2 |
GRID1 GRID2 |
GluRδ1 GluRδ2 |
АМРА-рецептор

Рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (также известный как рецептор AMPA или рецептор квисквалята) представляет собой ионотропный трансмембранный рецептор глутамата не-NMDA-типа, который опосредует быструю синаптическую передачу в центральной нервной системе (ЦНС). AMPA-рецепторы обнаружены во многих частях мозга и являются наиболее часто встречаемым рецепторами в нервной системе. Тетрамер AMPA-рецептора GluA2 (GluR-2) был первым из ионных каналов глутаматного рецептора, который удалось кристаллизовать[15].
Лиганды
- Агонисты: глутамат, AMPA, 5-фторвиллардин, домоевая кислота, квискваловая кислота и др.
- Антагонисты: CNQX, Кинуреновая кислота, NBQX, перампанель, пирацетам и др.
- Положительные аллостерические модуляторы: анирацетам, циклотиазид, CX-516, CX-614 и др.
- Отрицательные аллостерические модуляторы: этанол, перампанель, талампанель, GYKI-52,466 и др.
Рецепторы NMDA

1. Клеточная мембрана
2. Канал, который блокируется магнием Mg2+ (3)
3. Участок блокировки Mg2+
4. Участок связывания галлюциногенов
5. Участок связывания цинка Zn2+
6. Участок связывания агонистов (глутамат) и антагонистов (APV)
7. Участки гликозилирования
8. Участки связывания протонов
9. Участки связывания глицина
10. Участок связывания полиаминов
11. Внеклеточное пространство
12. Внутриклеточное пространство
13. Комплексная (сложная) субъединица
N-метил-D-аспартатный рецептор (NMDA-рецептор) — один из типов ионотропного глутаматного рецептора, является потенциал-зависимым лиганд-ионным каналом, который активируется одновременным связыванием глутамата и коагониста (им являются молекулы D-серина или глицина)[16]. Исследования показывают, что NMDA-рецептор участвует в регулировании синаптической пластичности и памяти[17][18].
Когда NMDA-рецептор активируется одновременным связыванием двух коагонистов, открывается катионный канал, позволяя ионам Na+ и Ca2+ проникать в клетку, в свою очередь происходит повышение трансмембранного потенциала клетки. Таким образом, NMDA-рецептор является возбуждающим рецептором. При потенциалах покоя связывание двухвалентных ионов Mg2+ или Zn2+ происходит на внеклеточных сайтах связывания рецептора, это приводит к блокированию потока ионов, который протекает через ионный канал NMDA-рецептора. Однако, когда нейроны деполяризуются, например, путём интенсивной активации колокализованных постсинаптических AMPA-рецепторов, потенциал-зависимый блок Mg2+ частично ослабляется, что позволяет увеличить приток ионов через активированные NMDA-рецепторы. Результирующий приток ионов Ca2+ может запускать различные внутриклеточные сигнальные каскады, которые могут в конечном итоге изменить функции нейронов посредством активации различных киназ и фосфатаз[19].
Лиганды
- Первичные эндогенные коагонисты: глутамат и D-серин или глицин
- Другие агонисты: аминоциклопропанкарбоновая кислота; Д-циклосерин; L-аспартат; хинолинат и др.
- Частичные агонисты: N-метил-D-аспарагиновая кислота (NMDA); NRX-1074; 3,5-дибром-L-фенилаланин, и др[20].
- Антагонисты: кетамин, фенциклидин, декстропропоксифен, кетобемидон, трамадол, кинуреновая кислота (эндогенная) и др.
Каинатные рецепторы
Каинатные рецепторы, или рецепторы каиновой кислоты (KAR), представляют собой ионотропные рецепторы, которые могут активироваться под действием молекул нейромедиатора глутамата. Изначально они были идентифицированы как особый тип рецептора посредством их селективной активации агонистом каината, лекарственного средства, выделенного из клеток красной водоросли Digenea simplex. Они традиционно классифицируются как рецептор не-NMDA-типа, наряду с рецептором AMPA. KAR недостаточно изучены, вследствие меньшего распространения в головном мозге, чем AMPA и NMDA-рецепторы, или другие ионотропные глутаматные рецепторы. Постсинаптические каинатные рецепторы участвуют в возбуждающей нейротрансмиссии. Пресинаптические каинатные рецепторы участвуют в ингибирующей нейротрансмиссии путём модулирования высвобождения тормозного нейромедиатора ГАМК посредством пресинаптического механизма (пресинаптическое торможение).
Каинатный рецептор состоит из четырёх субъединиц, сходных с субъединицами AMPA- и NMDA-рецепторов. Всего известно 5 типов этих субъединиц: GluR5, GluR6, GluR7, KA1 и KA2[21].
Ионный канал, образованный каинатными рецепторами, проницаем для ионов натрия и калия. Проводимость каналов каинатного рецептора по одному каналу аналогична проводимости каналов AMPA, около 20 пикосименс (2*10-11 См). Тем не менее, нарастание и спад постсинаптических потенциалов порожденных каинатным рецептором происходит медленнее, чем для АМРА-рецептора. Проницаемость для кальция обычно очень небольшая, но варьируеться в зависимости от особенностей сегмента М2[22].
Лиганды
Агонисты:
- 5-Йодовилардин
- Домоевая кислота
- Глутаминовая кислота (глутамат) — эндогенный агонист
- Каиновая кислота — синтетический агонист, в честь которого назван рецептор
- LY-339434
- SYM-2081
Антагонисты:
- CNQX
- DNQX
- Этанол — неселективный
- NS102
- Кинуреновая кислота — эндогенный лиганд
- Тезампанель — также антагонист AMPA-рецептора
- UBP-302
- Теанин
Рецепторы ГАМК
ГАМК-рецепторы — группа клеточных рецепторов, эндогенным агонистом которых является γ-аминомасляная кислота (ГАМК), основной тормозной нейромедиатор в нервной системе позвоночных, экспрессируются в интернейронах коры головного мозга животных и человека. Существует 3 типа ГАМК-рецепторов, два из которых являются ионотропными — ГАМКА и ГАМКС, а один метаботропный — ГАМКB. Быстро реагирующие ГАМК-рецепторы являются членами семейства лиганд-управляемых ионных каналов с цистеиновой петлёй[23][24][25].
ГАМКА-рецептор

ГАМКА-рецепторы представляют собой лиганд-управляемые анионные каналы. ГАМК (гамма-аминомасляная кислота), эндогенный лиганд для данного типа рецепторов, является основным ингибирующим нейромедиатором в центральной нервной системе. При активации он опосредует поступление ионов хлора Cl– в нейрон, при этом происходит гиперполяризация мембраны клетки. ГАМКА-рецепторы встречаются во всех организмах, имеющих нервную систему. Благодаря их широкому распространению в нервной системе млекопитающих, они играют роль практически во всех функциях, выполняемых головным мозгом[26].
Различные лиганды могут специфически связываться с ГАМКА-рецепторами, активируя или ингибируя хлоридный канал Cl–.
Лиганды:
- Агонисты: ГАМК, мускимол, прогабид, габоксадол
- Антагонисты: бикукулин, габазин
- Частичный агонист: пиперидин-4-сульфокислота.
ГАМКC-рецептор
Рецептор ГАМКA-ро (ранее известный как рецептор ГАМКC) представляет собой подкласс ГАМКА-рецепторов, состоящий полностью из субъединиц ро (ρ). Рецептор ГАМКA-ро, как и другие рецепторы ГАМКA, экспрессируется во многих областях мозга, но, в отличие от других рецепторов ГАМКА, данный рецептор обладает особенно высокой экспрессией в сетчатке глаза[27].
Серотониновые рецепторы
Среди большого числа суперсемейств серотониновых рецепторов только одно принадлежит к суперсемейству цис-петлевых лиганд-зависимых ионных каналов — 5-HT3 и поэтому структурно и функционально отличается от всех других рецепторов 5-HT-рецепторов (5-гидрокситриптамина или серотонина), которые являются рецепторами, сопряжённые с G-белком (GPCR)[28][29][30]. 5-HT3 представляет собой селективный катионный канал, он обеспечивает деполяризацию и возбуждение нейронов в центральной и периферической нервной системе[28]. Как и в случае других лиганд-управляемых ионных каналов, рецептор 5-HT3 состоит из пяти субъединиц, расположенных вокруг центральной ионопроводящей поры, которая проницаема для ионов натрия (Na+), калия (K+) и кальция (Ca2+). Связывание нейромедиатора 5-гидрокситриптамина (серотонина) с рецептором 5-HT3 открывает канал, что, в свою очередь, приводит к возбуждающему ответу в нейронах (потенциалу действия). 5-HT3-рецепторы имеют незначительную проницаемость для анионов[28]. По структуре они наиболее гомологичны с никотиновыми рецепторами ацетилхолина.
Проявляемые эффекты
При активации рецептора агонистами происходит открытие катионного канала, что приводит к следующим эффектам:
АТФ-зависимые ионные каналы

АТФ-зависимые ионные каналы открываются в ответ на связывание молекул нуклеотида АТФ[35]. Они образованы из тримеров с двумя трансмембранными спиралями на субъединицу и обоих терминалей (С и N-концов), расположенных на внутриклеточной стороне. К такому типу ионотропных рецепторов относится семейство P2X-пуринорецепторов. P2X-рецепторы присутствуют в разнообразных организмах, включая человека, позвоночных (млекопитающие, птицы, земноводные, рыбы итд.), беспозвоночных (трематоды) и простейших (амёбы)[36].
PIP2-лиганд зависимые ионные каналы
Фосфатидилинозитол-4,5-бисфосфат (PIP2) связывается и непосредственно активирует калиевые каналы внутреннего выпрямления (Kir или IRK)[37]. PIP2 является липидом клеточной мембраны, и его роль в качестве лиганда ионных каналов представляет новую роль для данной молекулы[38][39]. Калиевые каналы внутреннего выпрямления обнаружены также у растений[40] и бактерий[41].
Клиническое значение
Лиганд-управляемые ионные каналы, вероятно, являются основным местом действия анестетиков и этанола, хотя однозначные доказательства, данного воздействия ещё предстоит установить[42][43]. В частности, анестетики воздействуют на ГАМК- и NMDA-рецепторы в концентрациях, аналогичных тем, которые используются в клинической анестезии[44].
Мемантин одобрен USFDA и Европейским агентством лекарственных средств для лечения болезни Альцгеймера средней и тяжёлой степени[45], и в настоящее время получил ограниченную рекомендацию Национального института здравоохранения и медицинского обслуживания Великобритании для пациентов, не прошедших другие варианты лечения[46].
- Лечение антидепрессантами
Агомелатин, является типом лекарственного средства, действующего по двойному мелатонергическому-серотонинергическому пути, он показал свою эффективность в лечении тревожной депрессии во время клинических испытаний[47][48], исследование также предполагает эффективность в лечении атипичных и меланхоличных типов депрессии[49].
Примечания
Внешние ссылки
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.