Tabelul periodic al elementelor
tabelul periodic al lui Mendeleev From Wikipedia, the free encyclopedia
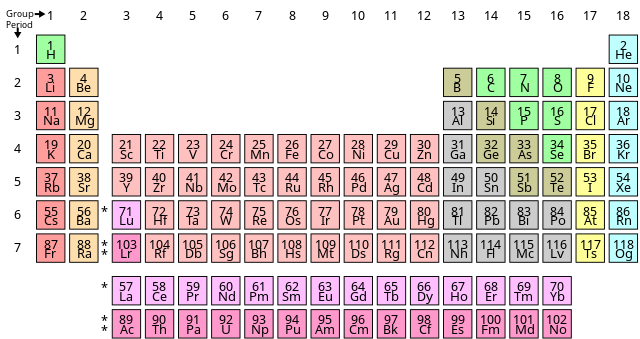
Tabelul periodic al elementelor, numit și tabelul periodic al lui Mendeleev, cuprinde într-o formă tabelară toate elementele chimice cunoscute până în prezent, aranjate în funcție de numărul lor atomic adică, după numărul de protoni dintr-un atom și, în funcție de configurația electronică și proprietăți chimice recurente. Acest aranjament conduce la identificarea anumitor „tendințe periodice”, astfel că elementele din aceeași grupă au proprietăți chimice asemănătoare. În general, în aceeași perioadă elementele din partea stângă sunt metale, iar cele din extremitatea dreaptă sunt nemetale.
Rândurile tabelului periodic se numesc perioade, iar coloanele se numesc grupe. Șase dintre grupe au și denumiri speciale, ca de exemplu grupa a 17-a mai poartă numele de grupa halogenilor, iar a 18-a grupă este cea a gazelor nobile. Tabelul periodic poate fi folosit pentru determinarea relațiilor dintre proprietățile elementelor, și de asemenea pentru a prezice proprietățile unor elemente noi, care urmează să fie descoperite sau sintetizate.
Dimitri Mendeleev a publicat în anul 1869 ceea ce avea să fie primul tabel periodic recunoscut la nivel mondial. Acesta și-a realizat tabelul astfel încât să ilustreze tendințele periodice pe care le prezentau proprietățile elementelor cunoscute la acea vreme. Folosindu-se de această teorie, Mendeleev a prezis unele proprietăți ale elementelor încă nedescoperite, care păreau să lipsească din tabel. Majoritatea predicțiilor s-au dovedit a fi adevărate pe măsură ce noi elemente au fost descoperite. De atunci, tabelul periodic al lui Mendeleev a fost dezvoltat și corectat, întrucât noi elemente au fost sintetizate sau descoperite.
Toate elementele, de la numărul atomic 1 (hidrogen) până la 118 (oganesson) au fost descoperite sau sintetizate, cele mai recent adăugate în tabel fiind nihoniul, moscoviul, tennessinul și oganessonul (au fost confirmate de către IUPAC pe 30 decembrie 2015), completând astfel toate cele șapte perioade.[1][2] Primele 94 de elemente există în natură, deși unele au fost observate în cantități infime și au fost sintetizate în laborator cu mult înaintea descoperirii lor.[n 1] Elementele cu numerele atomice cuprinse între 95 și 118 au fost doar sintetizate în laborator sau în reactoarele nucleare.[3] Sinteza elementelor cu un număr atomic peste 118 este planificată. De asemenea, numeroși radioizotopi sintetici ai unor elemente răspândite în natură au fost produși în laboratoare.
Generalități
| Grupă → | 1 I A |
2 II A |
3 III B |
4 IV B |
5 V B |
6 VI B |
7 VII B |
8 VIII B |
9 VIII B |
10 VIII B |
11 I B |
12 II B |
13 III A |
14 IV A |
15 V A |
16 VI A |
17 VII A |
18 VIII A | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Perioadă | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| * Lantanide | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** Actinide | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
| Metale alcaline2 | Metale alcalino-pământoase2 | Lantanide1,2 | Actinide2 | Metale de tranziție2 |
| Metale de post-tranziție | Metaloizi | Nemetale | Halogeni3 | Gaze nobile3 |
1Lantanidele, scandiul și ytriul se numesc împreună "pamânturi rare."
2Metalele alcaline, metalele alcalino-pământoase, metalele de tranziție și de post-tranziție, actinidele și lantanidele se numesc împreună "metale."
3Halogenii și gazele nobile sunt și ele nemetale.
Starea de agregare la condițiile normale de temperatură și presiune
- cele cu numărul atomic scris în roșu sunt gaze;
- cele cu numărul atomic scris în albastru sunt lichide;
- cele cu numărul atomic scris în negru sunt solide.
Răspândirea elementelor în natură
- cele cu chenar continuu au izotopi mai vechi decît Pământul;
- cele cu chenar întrerupt provin din dezintegrarea altor elemente și nu au izotopi mai vechi decât Pamântul;
- cele cu chenar punctat sunt obținute artificial (elemente sintetice);
- cele fără chenar au fost prezise teoretic, dar nu au fost descoperite încă.
Fiecare element chimic are asociat un unic număr atomic (Z), care reprezintă numărul de protoni din nucleu.[n 2] Majoritatea elementelor au un număr diferit de neutroni în atomi diferiți, aceste variante fiind numite izotopi. De exemplu, carbonul are trei izotopi naturali: toți atomii de carbon au șase protoni și majoritatea au șase neutroni, dar 1% au șapte neutroni și un procent foarte mic au opt neutroni. Izotopii nu sunt separați în tabelul periodic: ei sunt mereu grupați, reprezentați împreună, sub același nume. Elementele care nu au niciun izotop stabil, au trecute în tabel masele atomice ale celui mai stabil izotop, iar în acest caz ele sunt scrise între paranteze.[4]
Grupele
Articol principal: Grupă (tabelul periodic al elementelor)
O grupă sau o familie de elemente este o coloană verticală din tabelul periodic. De obicei, în grupe se regăsesc proprietățile similare cele mai evidente ale elementelor, proprietățile în coloană fiind mai asemănătoare decât cele în perioadă sau în blocuri. Teoriile moderne ale mecanicii cuantice referitoare la structurile atomice explică asemănarea elementelor în grupă pe baza faptului că aceste elemente posedă aceeași configurație electronică externă în stratul de valență.[5] În concluzie, cu creșterea numărului atomic și cu coborârea în grupă se observă a tendință evidentă, periodică a proprietăților elementelor.[6] Totuși, pentru unele categorii de elemente din tabelul periodic, precum blocurile d și f, se remarcă similitudini la fel de însemnate și pe orizontală, sau chiar mai pronunțată ca cele de pe verticală.[7][8][9]
Conform unei convenții internaționale de nomenclatură, grupele sunt numerotate de la 1 la 18, de la stânga la dreapta (de la metale alcaline la gaze nobile).[10] În trecut, erau utilizate cifrele romane pentru numerotarea grupelor și era menționat după număr „A” dacă grupele erau principale (aparțineau blocurilor s și p de elemente) sau „B” dacă grupele erau secundare (aparțineau blocului d de elemente). Această notație era de multe ori dificilă, în special pentru faptul că grupele 8, 9 și 10 erau tratate ca o singură grupă triplă de elemente, notată VIII. Noua metodă de nomenclatură propusă de IUPAC a intrat în uz în 1988, iar vechiul sistem de notare al grupelor a fost abandonat.[11]
Unele dintre aceste grupe au primit denumiri colective uzuale, deși unele sunt mai rar folosite. În ciuda acestui fapt, pentru grupele 3-10 nu există denumiri uzuale, și la aceste se face referire numai prin numărul lor sau prin numele primului element din grupa respectivă (de exemplu, „grupa scandiului” pentru grupa a 3-a de elemente). Lipsa denumirilor lor uzuale se datorează numărului mic de proprietăți similare pe verticală.[10]
| IUPAC (actual) | Numele grupei | Principală / Secundară | CAS | IUPAC (vechi) |
|---|---|---|---|---|
| Grupa 1 | Metale alcaline | 1. Principală | IA | IA |
| Grupa 2 | Metale alcalino-pământoase | 2. Principală | IIA | IIA |
| Grupa 3 | Grupa scandiului | 3. Secundară | IIIB | IIIA |
| Grupa 4 | Grupa titanului | 4. Secundară | IVB | IVA |
| Grupa 5 | Grupa vanadiului | 5. Secundară | VB | VA |
| Grupa 6 | Grupa cromului | 6. Secundară | VIB | VIA |
| Grupa 7 | Grupa manganului | 7. Secundară | VIIB | VIIA |
| Grupa 8 | Grupa fierului | 8. Secundară | VIIIB | VIIIA |
| Grupa 9 | Grupa cobaltului | 8. Secundară | VIIIB | VIIIA |
| Grupa 10 | Grupa nichelului | 8. Secundară | VIIIB | VIIIA |
| Grupa 11 | Grupa cuprului | 1. Secundară | IB | IB |
| Grupa 12 | Grupa zincului | 2. Secundară | IIB | IIB |
| Grupa 13 | Grupa borului | 3. Principală | IIIA | IIIB |
| Grupa 14 | Grupa carbonului | 4. Principală | IVA | IVB |
| Grupa 15 | Pnictogeni | 5. Principală | VA | VB |
| Grupa 16 | Calcogeni | 6. Principală | VIA | VIB |
| Grupa 17 | Halogeni | 7. Principală | VIIA | VIIB |
| Grupa 18 | Gaze nobile | 8. Principală | VIIIA | VIIIB |
Perioadele
O perioadă este un rând orizontal din tabelul periodic. Deși grupele sunt cel mai comun mod de a grupa elementele, există regiuni ale sistemului periodic unde similaritățile orizontale sunt mai semnificante decât cele verticale. De ex. metalele tranziționale, și în special lantanidele și actinidele. Numărul perioadei arată și numărul straturilor ocupate cu electroni.
Structurile atomice ale elementelor
Nucleul și electronii din jur

Cei mai mici constituenți din toată materia normală sunt cunoscuți sub numele de atomi. Atomii sunt extrem de mici, având un diametru de aproximativ o zecime miliarde de metri; astfel structura lor internă este guvernată de mecanica cuantică. Atomii constau dintr-un nucleu mic încărcat pozitiv, format din protoni încărcați pozitiv și neutroni neîncărcați, înconjurat de un nor de electroni încărcați negativ; încărcările se anulează, astfel încât atomii sunt neutri. Electronii participă la reacțiile chimice, dar nucleul nu. Când atomii participă la reacții chimice, ei fie câștigă, fie pierd electroni pentru a forma ioni încărcați pozitiv sau negativ; sau împărtășesc electroni unul cu celălalt.[12]
Atomii pot fi subdivizați în diferite tipuri în funcție de numărul de protoni (și, prin urmare, și de electroni) pe care îi au. Acesta se numește număr atomic, adesea simbolizat Z (pentru „Zahl” — din germană pentru „număr”). Prin urmare, fiecărui număr atomic distinct îi corespunde o clasă de atom: aceste clase sunt numite elemente chimice. Elementele chimice sunt ceea ce tabelul periodic clasifică și organizează. Hidrogenul este elementul cu număr atomic 1; Heliu, număr atomic 2; Litiu, număr atomic 3; și așa mai departe. Fiecare dintre aceste nume poate fi abreviat printr-un simbol chimic cu una sau două litere; cele pentru hidrogen, heliu și litiu sunt, respectiv, H, He și Li. Neutronii nu afectează identitatea chimică a atomului, dar afectează greutatea acestuia. Atomii cu același număr de protoni dar cu numere diferite de neutroni sunt numiți izotopi ai aceluiași element chimic. Elementele care apar în mod natural apar de obicei ca amestecuri de izotopi diferiți; deoarece fiecare izotop apare de obicei cu o abundență caracteristică, elementele naturale au greutăți atomice bine definite, definite ca masa medie a unui atom natural al acelui element. În zilele noastre, sunt cunoscute 118 elemente, dintre care primele 94 apar în mod natural pe Pământ. Din cele 94 de elemente naturale, 80 au un izotop stabil. Alți doi, Toriu și Uraniu, au izotopi în curs de descompunere radioactivă, cu un timp de înjumătățire comparabil cu vârsta Pământului. Elementele stabile plus bismut, toriu și uraniu alcătuiesc cele 83 de elemente primordiale care au supraviețuit din formarea Pământului. Cele unsprezece elemente naturale rămase se descompun destul de repede, încât apariția lor continuă să se bazeze în primul rând pe regenerarea constantă ca produse intermediare ale degradării toriului și uraniului. Toate cele 24 de elemente artificiale cunoscute sunt radioactive.[13]
Configurații electronice
| ℓ = | 0 | 1 | 2 | 3 | 4 | 5 | 6 | Capacitatea învelișului (2n2)[14] |
|---|---|---|---|---|---|---|---|---|
| Orbital | s | p | d | f | g | h | i | |
| n = 1 | 1s | 2 | ||||||
| n = 2 | 2s | 2p | 8 | |||||
| n = 3 | 3s | 3p | 3d | 18 | ||||
| n = 4 | 4s | 4p | 4d | 4f | 32 | |||
| n = 5 | 5s | 5p | 5d | 5f | 5g | 50 | ||
| n = 6 | 6s | 6p | 6d | 6f | 6g | 6h | 72 | |
| n = 7 | 7s | 7p | 7d | 7f | 7g | 7h | 7i | 98 |
| Capacitatea învelișului subchimic (4ℓ+2) | 2 | 6 | 10 | 14 | 18 | 22 | 26 | |
Tabelul periodic este o descriere grafică a legii periodice, care afirmă că proprietățile și structurile atomice ale elementelor chimice sunt o funcție periodică a numărului lor atomic. Elementele sunt plasate în tabelul periodic în funcție de configurațiile lor electronice, ale căror recurențe periodice explică tendințele proprietăților din tabelul periodic.[15]
Un electron poate fi considerat ca locuind într-un orbital atomic, ceea ce caracterizează probabilitatea ca acesta să poată fi găsit într-o anumită regiune din jurul atomului. Energiile lor sunt cuantificate, ceea ce înseamnă că pot lua doar valori discrete. În plus, electronii se supun principiului de excludere Pauli: electroni diferiți trebuie să fie întotdeauna în stări diferite. Acest lucru permite clasificarea stărilor posibile pe care le poate lua un electron în diferite niveluri de energie cunoscute sub numele de învelișuri. Fiecare orbital poate conține până la doi electroni: aceștia se disting printr-o cantitate cunoscută sub numele de spin, etichetată în mod convențional „sus” sau „jos”. Într-un atom rece (unul în starea sa fundamentală), electronii se aranjează astfel încât energia totală pe care o au este redusă la minimum prin ocuparea orbitalilor cu cea mai mică energie disponibilă. Numai electronii externi (așa-numiții electroni de valență) au suficientă energie pentru a se elibera de nucleu și a participa la reacțiile chimice cu alți atomi. Ceilalți se numesc electroni de bază.
Sunt cunoscute elemente cu până la primele șapte învelișuri chimice ocupate. Primul înveliș conține un singur orbital, un orbital sferic. Acesta poate conține până la doi electroni. Al doilea înveliș conține în mod similar un orbital 2s și, de asemenea, conține trei orbitali 2p în formă de gantere, putând astfel umple până la opt electroni (2×1 + 2×3 = 8). Al treilea înveliș conține un orbital 3s, trei orbitali 3p și cinci orbitali 3d și, prin urmare, are o capacitate de 2×1 + 2×3 + 2×5 = 18. Al patrulea înveliș conține un orbital 4s, trei orbitali 4p, cinci orbitali 4d și șapte orbitali 4f, conducând astfel la o capacitate de 2×1 + 2×3 + 2×5 + 2×7 = 32. Învelișurile mai înalte conțin mai multe tipuri de orbitali care continuă modelul.[16]
Ordinea umplerii învelișului subchimic

Secvența în care sunt umplute învelișurile subchimice este dată în majoritatea cazurilor de principiul Aufbau, cunoscut și sub numele de regula Madelung sau Klechkovsky. Această regulă a fost observată mai întâi de Madelung, iar Klechkovsky și autorii de mai târziu i-au dat o justificare teoretică.
Învelișurile se suprapun în energii, iar regula Madelung specifică succesiunea de umplere în funcție de:
1s ≪ 2s < 2p ≪ 3s < 3p ≪ 4s < 3d < 4p ≪ 5s < 4d < 5p ≪ 6s < 4f < 5d < 6p ≪ 7s < 5f < 6d < 7p ≪
Exprimați diferit, electronii intră în orbitali în ordinea creșterii n + ℓ, iar dacă sunt disponibili doi orbitali cu aceeași valoare de n + ℓ, cel cu n inferior este ocupat primul. În general, orbitalii cu aceeași valoare de n + ℓ sunt similari ca energie, dar în cazul orbitalilor s (cu ℓ = 0), efectele cuantice își ridică energia. Prin urmare, tabelul periodic este de obicei desenat pentru a începe fiecare rând (numit adesea perioadă) cu umplerea unui nou orbital s, care corespunde începutului unei noi învelișuri. Astfel, cu excepția primului rând, lungimea fiecărei perioade apare de două ori:
2, 8, 8, 18, 18, 32, 32, ...
Suprapunerile se apropie destul de mult în punctul în care orbitalii d intră în imagine, iar ordinea se poate schimba ușor cu numărul atomic și sarcina atomică. Pornind de la cel mai simplu atom, acest lucru ne permite să construim tabelul periodic unul câte unul în ordinea numărului atomic, luând în considerare cazurile atomilor unici. În hidrogen, există un singur electron, care trebuie să meargă în orbital 1s cu cea mai mică energie. Această configurație electronică este scrisă 1s1. Heliul adaugă un al doilea electron, care intră și el în 1s, umplând complet primul înveliș și dând configurația 1s2.[17]
| 1 H |
2 He |
2×1 = 2 elemente
1s | ||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8 elemente
2s 2p
|
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8 elemente
3s 3p
|
Variații
Perioada 1
Deși tabelul periodic modern este standard astăzi, plasarea elementelor din perioada 1, Hidrogenul și Heliul, unele variații pot fi găsite. Urmând configurațiile lor de electroni s1 și s2, hidrogenul ar fi plasat în grupa 1, iar heliul ar fi plasat în grupa 2. Plasarea hidrogenului în grupa 1 este obișnuită, dar heliul este aproape întotdeauna plasat în grupa 18 împreună cu celelalte gaze nobile. Dezbaterea are legătură cu înțelegerile contradictorii ale măsurii în care proprietățile chimice sau electronice ar trebui să decidă plasarea în tabelul periodic.[18]
Asemenea metalelor din grupa 1, hidrogenul are un electron în cel mai extern înveliș și, în mod tipic, își pierde singurul electron în reacțiile chimice. Hidrogenul are unele proprietăți chimice asemănătoare cu cele ale metalelor, putând să înlocuiască unele metale din sărurile lor. Cu toate acestea, formează un gaz nonmetallic diatomic în condiții standard, spre deosebire de metalele alcaline care sunt metale solide reactive. Acest lucru și formarea hidrizilor de către hidrogen, în care câștigă un electron, îl apropie de proprietățile halogenilor care fac același lucru. În plus, cele două halogene mai ușoare (fluorul și Clorul) sunt gazoase ca hidrogenul în condiții standard. Unele proprietăți ale hidrogenului nu se potrivesc bine cu niciuna dintre grupe: hidrogenul nu este nici puternic oxidant, nici puternic reducător și nu este reactiv cu apa. Astfel, hidrogenul are proprietăți care corespund atât celor ale metalelor alcaline, cât și celor ale halogenilor, dar nu se potrivește perfect niciunei grupe și, prin urmare, este dificil de plasat din punct de vedere chimic. Prin urmare, în timp ce plasarea electronică a hidrogenului în grupa 1 predomină, unele aranjamente mai rare arată fie hidrogenul în grupa 17, fie hidrogenul duplicat în ambele grupuri 1 și 17, sau plasat separat de toate grupurile. Această ultimă opțiune a fost totuși criticată de către chimistul și filosoful științei Eric Scerri pe motiv că pare să sugereze că hidrogenul este deasupra legii periodice în întregime, spre deosebire de toate celelalte elemente.[19]
Heliul este singurul element care ocupă în mod obișnuit o poziție în tabelul periodic care nu este consistentă cu structura sa electronică. Are doi electroni în cel mai extern înveliș, în timp ce celelalte gaze nobile au opt; și este un element de tip s, în timp ce toate celelalte gaze nobile sunt elemente de tip p. Cu toate acestea, este nereactiv în condiții standard și are un înveliș extern complet: aceste proprietăți sunt similare cu cele ale gazelor nobile din grupa 18, dar deloc asemănătoare cu metalele alcaline reactive din grupa 2. Din aceste motive, heliul este plasat aproape universal în grupa 18, la care proprietățile sale se potrivesc cel mai bine; o propunere de a muta heliul în grupa 2 a fost respinsă de către IUPAC în 1988 din aceste motive. Cu toate acestea, heliul este încă uneori plasat în grupa 2 astăzi, iar unele dintre proprietățile sale fizice și chimice sunt mai apropiate de elementele grupului 2 și susțin plasarea electronică. Heliul solid cristalizează într-o structură compactă hexagonală, care se potrivește cu beriliul și magneziul din grupa 2, dar nu cu celelalte gaze nobile din grupa 18. Dezvoltările teoretice recente în chimia gazelor nobile, în care se așteaptă ca heliul să arate o inerție ușor mai mică decât neonul și să formeze (HeO)(LiF)2 cu o structură similară compusului analog de beriliu (dar fără un analog neon așteptat), a dus la faptul că mai mulți chimiști susțin plasarea heliului în grupa 2. Acest lucru se referă la argumentul electronic, deoarece motivul pentru inerția mai mare a neonului este respingerea din învelișul său p complet pe care heliul nu-l are.[20]
Anomalia rândului întâi din tabelul periodic a fost de asemenea menționată pentru a susține mutarea heliului în grupa 2. Aceasta apare deoarece orbitalul de primă ordine al oricărui tip este neobișnuit de mic, deoarece, spre deosebire de analogii săi superiori, nu experimentează repulsie interelectronică de la un orbital mai mic de același tip. Aceasta face ca primul rând de elemente din fiecare bloc să fie neobișnuit de mic, iar astfel de elemente tind să prezinte tipuri caracteristice de anomalii pentru grupul lor. Unii chimiști care argumentează pentru repoziționarea heliului au remarcat că heliul prezintă aceste anomalii dacă este plasat în grupa 2, dar nu și dacă este plasat în grupa 18. Relația dintre heliu și beriliu este apoi argumentată să semene cu cea dintre hidrogen și litiu, o plasare mult mai acceptată în mod obișnuit. De exemplu, datorită acestei tendințe în dimensiunile orbitalilor, se observă o diferență mare în razele atomice între primii doi membri ai fiecărui grup principal în grupurile 1 și 13–17: există între Neon și Argon, și între heliu și Beriliu, dar nu între heliu și neon. Acest lucru afectează în mod similar punctele de fierbere ale gazelor nobile și solubilitățile în apă, unde heliul este prea aproape de neon, iar diferența mare caracteristică între primele două elemente ale unui grup apare doar între neon și argon. Mutarea heliului în grupa 2 face ca această tendință să fie consistentă și în grupurile 2 și 18, făcând din heliu primul element din grupa 2 și din neon primul element din grupa 18.[21]
Grupa 3
În multe tabele periodice, blocul f este deplasat cu un element spre dreapta, astfel încât lantanul și actiniul devin elemente ale blocului d în grupa 3, iar Ce–Lu și Th–Lr formează blocul f. Astfel, blocul d este împărțit în două părți foarte inegale. Acest lucru este rezultatul unor măsurători eronate anterioare ale configurațiilor electronice. În 1948, Lev Landau și Evgheni Lifșiț au considerat incorect să grupeze lutețiul ca un element al blocului f, deoarece învelișul 4f este complet la yiterbiu. Ei nu au mers încă până la eliminarea lantanului din blocul d, dar Jun Kondō a realizat în 1963 că supraconductivitatea la temperaturi joase a lantanului implică activitatea învelișului său 4f. În 1965, David C. Hamilton a legat această observație de poziția sa în tabelul periodic și a argumentat că blocul f ar trebui să fie compus din elementele La–Yb și Ac–No. De atunci, dovezi fizice, chimice și electronice au susținut această constatare. Această problemă a fost adusă la atenția largă de către William B. Jensen în 1982, iar reatribuirea lutețiului și a lawrenciului la grupa 3 a fost susținută de rapoartele IUPAC din 1988.[22]
O a treia formă poate fi uneori întâlnită în zonele în care spațiile de sub ytriu în grupa 3 sunt lăsate goale, cum ar fi tabela apărând pe site-ul web al IUPAC, dar aceasta creează o inconsistență cu mecanica cuantică prin faptul că blocul f devine lat de 15 elemente. În plus, există unele confuzii în literatura de specialitate cu privire la care elemente sunt implicate atunci în grupa 3. În timp ce raportul IUPAC din 2021 a remarcat că blocurile f late de 15 elemente sunt susținute de unii experți ai unei ramuri specializate de mecanică cuantică relativistă concentrată pe proprietățile elementelor supergrele, opinia cercetării a fost că astfel de preocupări dependente de interes nu ar trebui să aibă nicio relevanță în modul în care este prezentată tabela periodică. Alți autori concentrați pe elementele supergrele au clarificat ulterior că "al 15-lea element al blocului f reprezintă prima poziție a blocului d care este lăsată liberă pentru a indica locul inserturilor blocului f". Într-adevăr, atunci când publicațiile IUPAC extind tabela la 32 de coloane, acest lucru devine clar și plasează lutețiul și lawrenciul sub ytriu în grupa 3.
În literatură pot fi întâlnite mai multe argumente în favoarea formei Sc-Y-La-Ac, dar acestea au fost contestate ca fiind logic inconsistente. De exemplu, s-a argumentat că lantanul și actiniul nu pot fi elemente ale blocului f deoarece, ca atomi individuali în fază gazoasă, nu au început să umple subnivelurile f. Nu numai că astfel de configurații excepționale sunt în minoritate, și chiar nu au fost niciodată considerate relevante pentru poziționarea altor elemente în tabelul periodic: în atomii gazoși, subnivelurile d își completează umplerea la cupru, paladiu și aur. Faptul relevant pentru plasare este că lantanul și actiniul (la fel ca thoriul) au orbite f de valență care pot fi ocupate în medii chimice, în timp ce lutețiu și lawrenciul nu au. Astfel, relația dintre ytriu și lantan este doar o relație secundară între elemente cu același număr de electroni de valență, dar cu tipuri diferite de orbite de valență, precum cea dintre crom și uraniu.[23]
Tendințe periodice
Deoarece reacțiile chimice implică electronii de valență, se poate aștepta ca elementele cu configurații exterioare de electroni similare să reacționeze în mod similar și să formeze compuși cu proporții similare de elemente în ei. Astfel de elemente sunt plasate în același grup, și prin urmare există tendințe clare. Deoarece configurații analoge apar la intervale regulate, proprietățile elementelor prezintă recurențe periodice, de unde și numele de tabel periodic și legea periodică. Aceste recurențe periodice au fost observate cu mult înainte ca teoria de bază care le explică să fie dezvoltată.
Raza Atomică

În mod istoric, dimensiunea fizică a atomilor era necunoscută până în secolul al XX-lea. Prima estimare calculată a razei atomice a hidrogenului a fost publicată de fizicianul Arthur Haas în 1910, cu o precizie de ordin (un factor de 10) față de valoarea acceptată. În modelul său, Haas a folosit o configurație cu un singur electron bazată pe modelul atomic clasic propus de J. J. Thomson în 1904.
Razele atomice (mărimea atomilor) sunt dependente de dimensiunile orbitalelor lor exterioare. În general, acestea scad mergând de la stânga spre dreapta în rândurile elementelor din grupurile principale, deoarece încărcătura nucleară crește, dar electronii externi se află încă în aceeași înveliș. Cu toate acestea, mergând în jos pe o coloană, razele cresc în general, deoarece electronii cei mai externi se află în învelișuri superioare, care sunt astfel mai departe de nucleu. Primul rând al fiecărui bloc este anormal de mic, datorită unui efect numit kainosimetrie sau repulsie primogenă: subnivelurile 1s, 2p, 3d și 4f nu au analogi interiori. De exemplu, orbitalii 2p nu experimentează o repulsie puternică de la orbitalii 1s și 2s, care au distribuții de sarcină angulare destul de diferite. Astfel, subnivelurile s-, p-, d- și f-superioare experimentează o repulsie puternică de la analogii lor interiori, care au aproximativ aceeași distribuție angulară a sarcinii și trebuie să se extindă pentru a evita acest lucru. Acest lucru face să apară diferențe semnificative între elementele mici din 2p, care preferă legăturile multiple, și elementele mai mari din 3p și superioare, care nu o fac. Anomalii similare apar și pentru elementele 1s, 2p, 3d, 4f și elementele ipotetice 5g.[24]
În elementele de tranziție, un înveliș interior se umple, dar dimensiunea atomului este totuși determinată de electronii externi. Creșterea încărcăturii nucleare în serie și numărul crescut de electroni interiori pentru ecranizare compensează într-o oarecare măsură, astfel încât scăderea în raza atomului este mai mică. Atomii 4p și 5d, care vin imediat după introducerea noilor tipuri de serii de tranziție, sunt mai mici decât s-ar fi așteptat, deoarece subnivelurile 3d și 4f adăugate oferă doar o ecranizare incompletă a încărcăturii nucleare pentru electronii externi. Prin urmare, de exemplu, atomii de galiu sunt ușor mai mici decât atomii de aluminiu. Împreună cu kainosimetria, acest lucru rezultă într-o diferență pară-impară între perioade (cu excepția blocului s) care este uneori cunoscută sub numele de periodicitate secundară: elementele din perioadele pare au raze atomice mai mici și preferă să piardă mai puțini electroni, în timp ce elementele din perioadele impare (cu excepția primei) diferă în direcția opusă. Astfel, de exemplu, multe proprietăți din blocul p prezintă o tendință neregulată în loc de o tendință uniformă în grup. De exemplu, fosforul și stibiul din perioade impare ale grupului 15 ajung ușor la starea de oxidare +5, în timp ce azotul, arsenicul și bismutul din perioadele pare preferă să rămână la +3.
Atomii de taliu și plumb au aproximativ aceeași mărime ca atomii de indiu și staniu, respectiv, dar de la bismut la radon atomii 6p sunt mai mari decât atomii analogi 5p. Acest lucru se întâmplă pentru că atunci când nucleele atomice devin puternic încărcate, relativitatea specială devine necesară pentru a evalua efectul nucleului asupra norului de electroni. Aceste efecte relativiste determină ca elementele grele să aibă din ce în ce mai multe proprietăți diferite față de elementele lor mai ușoare din tabelul periodic. Efectele relativiste explică de asemenea de ce aurul este auriu și mercurul este lichid la temperatura camerei. Se așteaptă ca aceste efecte să devină foarte puternice în perioada a șaptea târzie, putând duce la o colapsare a periodicității.[25]
Energia de ionizare

Prima energie de ionizare a unui atom este energia necesară pentru a îndepărta un electron din acesta. Aceasta variază odată cu raza atomică: energia de ionizare crește de la stânga la dreapta și de sus în jos, deoarece electronii care sunt mai apropiați de nucleu sunt ținuți mai strâns și sunt mai dificil de îndepărtat. Astfel, energia de ionizare este minimizată la primul element din fiecare perioadă - hidrogenul și metalele alcaline - și apoi în general crește până când ajunge la gazul nobil de la marginea dreaptă a perioadei. Există unele excepții de la această tendință, cum ar fi oxigenul, unde electronul care este îndepărtat este cuplat și, astfel, repulsia interelectronică face mai ușor de îndepărtat decât se aștepta.[26]
În seriile de tranziție, electronii externi sunt pierduți preferențial chiar dacă orbitalii interni sunt umpluți. De exemplu, în seria 3d, electronii 4s sunt pierduți primii chiar dacă orbitalii 3d sunt umpluți. Efectul de ecranizare al adăugării unui electron 3d suplimentar compensează aproximativ creșterea încărcăturii nucleare, iar în consecință, energiile de ionizare rămân în mare parte constante, deși există o ușoară creștere, în special la sfârșitul fiecărei serii de tranziție.
Deoarece atomii de metal tind să piardă electroni în reacțiile chimice, energia de ionizare este în general corelată cu reactivitatea chimică, deși sunt implicate și alte factori.[27]
Afinitatea electronică

Proprietatea opusă energiei de ionizare este afinitatea electronică, care este energia eliberată atunci când se adaugă un electron la atom. Un electron trecător va fi mai ușor atras către un atom dacă simte atracția nucleului mai puternic, și în special dacă există un orbital extern parțial umplut disponibil care poate să-l acomodeze. Prin urmare, afinitatea electronică tinde să crească de sus în jos și de la stânga la dreapta. Excepția este ultima coloană, gazele nobile, care au un înveliș complet și nu au loc pentru un alt electron. Acest lucru conferă halogenilor din penultima coloană cele mai mari afinități electronice.[28]
Anumiți atomi, precum gazele nobile, nu au afinitate electronică: ei nu pot forma anioni stabili în fază gazoasă. Gazele nobile, având energii de ionizare ridicate și lipsindu-le afinitatea electronică, nu au o tendință pronunțată de a câștiga sau pierde electroni și sunt în general nereactive.
Există unele excepții de la tendințe: oxigenul și fluorul au afinități electronice mai mici decât omologii lor mai grei, sulf și clor, deoarece sunt atomi mici și, prin urmare, electronul nou adăugat ar întâlni o repulsie semnificativă din partea celor deja prezenți. Pentru elementele nemetalice, afinitatea electronică se corelează într-o anumită măsură cu reactivitatea, dar nu perfect, deoarece sunt implicați și alți factori. De exemplu, fluorul are o afinitate electronică mai mică decât clorul (din cauza repulsiei interelectronice extreme pentru atomul de fluor, foarte mic), dar este mai reactiv.[29]
Stări de valență și oxidare
Valența unui element poate fi definită fie ca numărul de atomi de hidrogen cu care poate forma un hidrid binar simplu, fie ca dublul numărului de atomi de oxigen cu care poate forma un oxid binar simplu (adică, nu un peroxid sau un superoxid). Valențele elementelor grupului principal sunt direct legate de numărul grupului: hidrizii din grupele principale 1–2 și 13–17 dau formulele MH, MH2, MH3, MH4, MH3, MH2 și în cele din urmă MH. Oxizii cei mai mari cresc în valență, urmând formulele M2O, MO, M2O3, MO2, M2O5, MO3, M2O7. Astăzi, conceptul de valență a fost extins de cel de stare de oxidare, care este sarcina formală rămasă pe un element când toate celelalte elemente dintr-un compus au fost eliminate ca ioni ai lor.[30]
Configurația electronică sugerează o explicație clară bazată pe numărul de electroni disponibili pentru legare; de fapt, numărul de electroni de valență începe de la 1 în grupul 1 și crește apoi către partea dreaptă a tabelului periodic, resetându-se doar de 3 ori când începe fiecare bloc nou. Astfel, în perioada 6, Cs–Ba au 1–2 electroni de valență; La–Yb au 3–16; Lu–Hg au 3–12; iar Tl–Rn au 3–8. Cu toate acestea, către partea dreaptă a blocurilor d- și f-, maximumul teoretic corespunzător utilizării tuturor electronilor de valență nu este realizabil deloc.

O explicație completă necesită să se ia în considerare energia care ar fi eliberată în formarea compușilor cu valențe diferite, în loc să se considere doar configurațiile electronice. De exemplu, Magneziul formează cationul Mg2+ în loc de Mg+ atunci când este dizolvat în apă, deoarece acesta din urmă s-ar desprinde spontan în cationi Mg0 și Mg2+. Acest lucru se datorează faptului că entalpia de hidratare (înconjurarea cationului cu molecule de apă) crește în magnitudine odată cu sarcina și raza ionului. În cazul lui Mg+, orbitalul extern (care determină raza ionică) este încă 3s, astfel încât entalpia de hidratare este mică și insuficientă pentru a compensa energia necesară pentru îndepărtarea electronului. Din motive similare, stările de oxidare comune ale elementelor mai grele din blocul p (unde electronii ns devin mai jos în energie decât np) tind să varieze în trepte de 2.
Pentru metalele de tranziție, stările de oxidare comune sunt aproape întotdeauna cel puțin +2 din motive similare (descoperirea suborbitalei următoare); acest lucru este valabil chiar și pentru metalele cu configurații anormale dx+1s1 sau dx+2s0 (cu excepția argintului), deoarece repulsia dintre electronii d înseamnă că mișcarea celui de-al doilea electron de la suborbitalele s la cele d nu schimbă în mod semnificativ energia sa de ionizare. Deoarece ionizarea metalelor de tranziție nu descoperă suborbitali interiori noi, stările lor de oxidare tind să varieze în trepte de 1. Lantanidele și actinidele târzii prezintă în general o stare de oxidare stabilă de +3, îndepărtând electronii s exteriori și apoi (de obicei) un electron din orbitalii (n−2)f, care sunt similari din punct de vedere energetic cu ns. Stările comune și maxime de oxidare ale elementelor din blocul d și f tind să depindă de energiile de ionizare. Pe măsură ce diferența de energie între orbitalii (n−1)d și ns crește de-a lungul fiecărei serii de tranziție, devine mai puțin favorabil din punct de vedere energetic să ionizezi mai multe electroni. Astfel, grupurile de metale de tranziție timpurii tind să prefere stările de oxidare mai mari, dar starea de oxidare +2 devine mai stabilă pentru grupurile târzii de metale de tranziție. Astfel, starea de oxidare formală maximă crește de la +3 la începutul fiecărei rânduri a blocului d, la +7 sau +8 în mijloc (de exemplu, OsO4), și apoi scade la +2 la sfârșit.
Deoarece elementele din aceeași grupă împărtășesc aceleași configurații de valență, ele de obicei prezintă comportamente chimice similare. De exemplu, metalele alcaline din prima grupă au toate un electron de valență și formează o clasă foarte omogenă de elemente: toate sunt metale moi și reactive. Cu toate acestea, sunt implicați mulți factori, iar grupurile pot fi adesea destul de eterogene. De exemplu, hidrogenul are și el un electron de valență și se află în aceeași grupă cu metalele alcaline, dar comportamentul său chimic este destul de diferit. Elementele stabile din grupa 14 includ un nemetal (carbon), doi semiconductori (siliciul și germaniul) și doi metale (staniul și plumbul); cu toate acestea, sunt unite de faptul că au patru electroni de valență. Acest lucru duce adesea la similitudini în stările de oxidare maxime și minime (de exemplu, sulfura și seleniul din grupa 16 au ambele starea de oxidare maximă +6, ca în SO3 și SeO3, și starea de oxidare minimă -2, ca în sulfuri și selenuri).[31]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H 1 |
He 2 | ||||||||||||||||||||||||||||||
| 2 | Li 1 |
Be 2 |
B 3 |
C 4 |
N 5 |
O 6 |
F 7 |
Ne 8 | ||||||||||||||||||||||||
| 3 | Na 1 |
Mg 2 |
Al 3 |
Si 4 |
P 5 |
S 6 |
Cl 7 |
Ar 8 | ||||||||||||||||||||||||
| 4 | K 1 |
Ca 2 |
Sc 3 |
Ti 4 |
V 5 |
Cr 6 |
Mn 7 |
Fe 8 |
Co 9 |
Ni 10 |
Cu 11 |
Zn 12 |
Ga 3 |
Ge 4 |
As 5 |
Se 6 |
Br 7 |
Kr 8 | ||||||||||||||
| 5 | Rb 1 |
Sr 2 |
Y 3 |
Zr 4 |
Nb 5 |
Mo 6 |
Tc 7 |
Ru 8 |
Rh 9 |
Pd 10 |
Ag 11 |
Cd 12 |
In 3 |
Sn 4 |
Sb 5 |
Te 6 |
I 7 |
Xe 8 | ||||||||||||||
| 6 | Cs 1 |
Ba 2 |
La 3 |
Ce 4 |
Pr 5 |
Nd 6 |
Pm 7 |
Sm 8 |
Eu 9 |
Gd 10 |
Tb 11 |
Dy 12 |
Ho 13 |
Er 14 |
Tm 15 |
Yb 16 |
Lu 3 |
Hf 4 |
Ta 5 |
W 6 |
Re 7 |
Os 8 |
Ir 9 |
Pt 10 |
Au 11 |
Hg 12 |
Tl 3 |
Pb 4 |
Bi 5 |
Po 6 |
At 7 |
Rn 8 |
| 7 | Fr 1 |
Ra 2 |
Ac 3 |
Th 4 |
Pa 5 |
U 6 |
Np 7 |
Pu 8 |
Am 9 |
Cm 10 |
Bk 11 |
Cf 12 |
Es 13 |
Fm 14 |
Md 15 |
No 16 |
Lr 3 |
Rf 4 |
Db 5 |
Sg 6 |
Bh 7 |
Hs 8 |
Mt 9 |
Ds 10 |
Rg 11 |
Cn 12 |
Nh 3 |
Fl 4 |
Mc 5 |
Lv 6 |
Ts 7 |
Og 8 |
Electronegativitatea

O altă proprietate importantă a elementelor este electronegativitatea lor. Atomii pot forma legături covalente între ei prin partajarea electronilor în perechi, creând o suprapunere a orbitalilor de valență. Măsura în care fiecare Atom atrage perechea de electroni partajată depinde de electronegativitatea atomului. Atomul mai electronegativ va avea tendința de a atrage perechea de electroni mai mult, în timp ce cel mai puțin electronegativ (sau mai electropozitiv) va atrage mai puțin. În cazuri extreme, electronul poate fi considerat că a fost transferat complet de la atomul mai electropozitiv la cel mai electronegativ, deși acesta este o simplificare. Legătura va lega astfel doi ioni, unul pozitiv (care a cedat electronul) și unul negativ (care l-a acceptat), și este numită o legătură ionică.[32]
Electronegativitatea depinde de cât de puternic poate atrage nucleul o pereche de electroni, astfel prezintă o variație similară cu celelalte proprietăți deja discutate: electronegativitatea tinde să scadă de sus în jos și să crească de la stânga la dreapta. Metalele alcaline și cele alcalino-pământoase se numără printre cele mai electropozitive elemente, în timp ce chalcogenii, halogenii și gazele nobile se numără printre cele mai electronegative.
Electronegativitatea este în general măsurată pe scara lui Pauling, pe care atomul reactiv cel mai electronegativ (fluorul) primește electronegativitatea 4.0, iar atomul cel mai puțin electronegativ (cesiu) primește electronegativitatea 0.79. De fapt, neonul este cel mai electronegativ element, dar scara lui Pauling nu poate măsura electronegativitatea sa deoarece nu formează legături covalente cu majoritatea elementelor.
Electronegativitatea unui element variază în funcție de identitatea și numărul atomilor cu care este legat, precum și de câți electroni a pierdut deja: un atom devine mai electronegativ atunci când a pierdut mai mulți electroni. Acest lucru face uneori o diferență semnificativă: plumbul în starea de oxidare +2 are electronegativitatea 1.87 pe scara lui Pauling, în timp ce plumbul în starea de oxidare +4 are electronegativitatea 2.33.[33]
Metalicitatea


Un simplu element este o substanță formată din atomi ai unui singur element chimic. Substanțele simple ale atomilor mai electronegativi tind să împărtășească electroni (să formeze legături covalente) unul cu celălalt. Ele formează fie molecule mici (precum hidrogenul sau oxigenul, ale căror atomi se leagă în perechi) sau structuri mari care se întind la infinit (precum carbonul sau siliciul). Gazele nobile rămân pur și simplu ca atomi singuri, deoarece acestea au deja un inel complet. Substanțele compuse din molecule discrete sau atomi singuri sunt menținute împreună de forțe de atracție mai slabe între molecule, precum forța de dispersie London: pe măsură ce electronii se mișcă în cadrul moleculelor, ei creează dezechilibre momentane de sarcină electrică, care induc dezechilibre similare în moleculele vecine și creează mișcări sincronizate ale electronilor în mai multe molecule învecinate.
Atomii mai electropozitivi, totuși, tind să piardă electroni, creând o „mare” de electroni care învăluie cationii. Orbitalele exterioare ale unui atom se suprapun pentru a împărți electronii cu toți vecinii săi, creând o structură gigant de orbitale moleculare care se întinde peste toți atomii. Această „mare” încărcată negativ atrage toți ionii și îi menține împreună într-o legătură metalică. Elementele care formează astfel de legături sunt adesea numite metale; cele care nu o fac sunt adesea numite nemetale.[34]

Metalicitatea unui element poate fi prezisă din proprietățile electronice. Atunci când orbitalii atomici se suprapun în timpul legăturilor metalice sau covalente, ei creează atât orbitale moleculare de legătură, cât și antibonding de aceeași capacitate, cu orbitalele antibonding de energie mai mare. Caracterul net de legare apare atunci când există mai mulți electroni în orbitalele de legătură decât în orbitalele antibonding. Legarea metalică este astfel posibilă atunci când numărul de electroni delocalizați de fiecare atom este mai mic decât de două ori numărul de orbitale care contribuie la suprapunere. Aceasta este situația pentru elementele din grupele 1 până la 13; ele au, de asemenea, prea puțini electroni de valență pentru a forma structuri covalente gigantice în care toți atomii ocupă poziții echivalente, și astfel aproape toate se metalizează. Excepțiile sunt hidrogenul și borul, care au o energie de ionizare prea mare.
În grupa 14, sunt posibile atât legături metalice, cât și covalente. Într-un cristal de diamant, legăturile covalente între atomii de carbon sunt puternice, deoarece aceștia au un rază atomică mică și, astfel, nucleul exercită o influență mai mare asupra electronilor. Prin urmare, orbitalii de legare rezultați sunt mult mai jos în energie decât orbitalii antibonding, și nu există suprapunere, astfel încât conducerea electrică devine imposibilă: carbonul este un nemetal. Cu toate acestea, legăturile covalente devin mai slabe pentru atomi mai mari și deci decalajul de energie între orbitalii de legare și antibonding scade.[35]
Elementele din grupurile 15 până la 17 au prea mulți electroni pentru a forma molecule mari covalente care se întind în toate cele trei dimensiuni. Pentru elementele mai ușoare, legăturile din moleculele diatomice mici sunt atât de puternice încât o fază condensată este dezavantajată: astfel, azotul (N2), oxigenul (O2), fosforul alb și arsenicul galben (P4 și As4), sulfura și seleniul roșu (S8 și Se8), și halogenii stabili (F2, Cl2, Br2 și I2) formează cu ușurință molecule covalente cu câteva atomi. Cele mai grele au tendința de a forma lanțuri lungi (de exemplu, fosforul roșu, seleniul gri, telurul) sau structuri stratificate (de exemplu, carbonul sub formă de grafit, fosforul negru, arsenicul gri, antimoniul, bismutul) care se extind doar în una sau două, nu în trei dimensiuni. Ambele tipuri de structuri pot fi găsite ca alotropi ai fosforului, arsenicului și seleniului, deși alotropii cu lanțuri lungi sunt mai stabili în toate cele trei. Deoarece aceste structuri nu folosesc toate orbitalele lor pentru legare, acestea sfârșesc cu benzi de legătură, neligatură și antibondare în ordinea creșterii energiei. Similar cu grupul 14, golurile de bandă se micșorează pentru elementele mai grele, iar mișcarea liberă a electronilor între lanțuri sau straturi devine posibilă. Astfel, de exemplu, fosforul negru, arsenicul negru, seleniul gri, telurul și iodul sunt semiconductori; arsenicul gri, antimoniul și bismutul sunt semimetale. În cele din urmă, elementele naturale din grupul 18 rămân toate ca atomi individuali.[36]
Linia care desparte metalele și nemetalele este aproximativ diagonală de la stânga sus în jos spre dreapta jos, cu seria de tranziție apărând la stânga acestei diagonale (deoarece au multe orbitale disponibile pentru suprapunere). Aceasta este o așteptare, deoarece metalicitatea tinde să fie corelată cu electropozitivitatea și dorința de a pierde electroni, care crește de la dreapta la stânga și de sus în jos. Astfel, metalele sunt mult mai numeroase decât nemetalele. Elementele aproape de linia de demarcație sunt dificil de clasificat: ele tind să aibă proprietăți intermediare între cele ale metalelor și nemetalelor și pot avea unele proprietăți caracteristice atât ale metalelor, cât și ale nemetalelor. Ele sunt adesea numite semimetale sau metaloide. Termenul "semimetal" folosit în acest sens nu trebuie confundat cu sensul său strict fizic referitor la structura benzilor: bismutul este fizic un semimetal, dar este în general considerat un metal de către chimiști.[37]
În general, metalele sunt strălucitoare și dense. Ele au de obicei puncte mari de topire și fierbere datorită rezistenței legăturii metalice și sunt adesea maleabile și ductile (ușor întinse și modelate) deoarece atomii pot să se deplaseze unul în raport cu celălalt fără a rupe legătura metalică. Ele conduc electricitatea deoarece electronii lor sunt liberi să se miște în toate cele trei dimensiuni. Similar, ele conduc căldura, care este transferată de electroni ca energie cinetică suplimentară: se mișcă mai repede. Aceste proprietăți persistă în starea lichidă, deoarece, deși structura cristalină este distrusă la topire, atomii încă se ating și legătura metalică persistă, deși este slăbită. Metalele au tendința să fie reactive față de nemetale. Pot fi găsite unele excepții la aceste generalizări: de exemplu, beriliul, cromul, manganul, antimoniul, bismutul și uraniul sunt casante; cromul este extrem de dur; galiul, rubidiul, cesiul și mercurul sunt lichide la sau aproape de temperatura camerei; iar metalele nobile precum aurul sunt chimic foarte inerte.[38]
Nemetalele prezintă diferite proprietăți. Cele care formează cristale gigante covalente au puncte mari de topire și fierbere, deoarece este necesară o cantitate considerabilă de energie pentru a depăși legăturile covalente puternice. Cele care formează molecule discrete sunt ținute împreună în mare parte de forțe de dispersie, care sunt mai ușor de depășit; astfel, ele au tendința să aibă puncte mai mici de topire și fierbere, și multe sunt lichide sau gaze la temperatura camerei. Nemetalele sunt adesea de aspect tern. Ele tind să fie reactive față de metale, cu excepția gazelor nobile, care sunt inerte față de cele mai multe substanțe. Ele sunt casante când sunt solide, deoarece atomii lor sunt ținuți strâns în loc. Ele sunt mai puțin dense și conduc electricitatea slab, deoarece nu există electroni mobili. În apropierea liniei de separare, benzile de energie sunt mici și astfel multe elemente din acea regiune sunt semiconductoare, precum siliciul, germaniul și telurul.[39]
Este obișnuit să se aleagă o clasă de metaloizi care sunt considerate a fi între metale și nemetale, deoarece elementele din acea regiune sunt intermediare atât în proprietățile fizice, cât și chimice. Cu toate acestea, nu există un consens în literatură cu privire la elementele care ar trebui desemnate în acest fel. Atunci când se folosește o astfel de categorie, siliciul, germaniul, arsenicul și telurul sunt aproape întotdeauna incluse, iar borul și antimoniu sunt de obicei incluse; dar majoritatea surselor includ și alte elemente, fără a fi de acord cu privire la ce elemente suplimentare ar trebui adăugate, iar unele altele le exclud în schimb de pe această listă.[40] De exemplu, spre deosebire de toate celelalte elemente considerate în general metaloizi sau nemetale, singura formă stabilă a antimonului are conductivitate metalică. Mai mult, elementul seamănă cu bismutul și, în mod mai general, cu celelalte metale din blocul p în comportamentul său fizic și chimic. Pe această bază, unii autori au argumentat că este mai bine clasificat ca metal decât ca metaloid. Pe de altă parte, seleniul are unele proprietăți semiconductoare în cea mai stabilă formă a sa (deși are și alotropi izolatori) și s-a argumentat că ar trebui considerat un metaloid - deși această situație este valabilă și pentru fosfor, care este o includere mult mai rară printre metaloizi.[41]
Clasificarea elementelor
Este adevărat că există diverse denumiri utilizate pentru a descrie seturi de elemente care se comportă similar în chimie. IUPAC (Uniunea Internațională de Chimie Pure și Aplicată) recunoaște anumite denumiri pentru aceste grupuri, cum ar fi: metale alcaline, metale alcalino-pământoase, trieli, tetreli, pnictogeni, calcogeni, halogeni și gaze nobile. Alte grupuri pot fi denumite după numărul lor, sau după primul element al lor (de exemplu, grupul 6 este grupul cromului). În ceea ce privește elementele din blocul p, grupurile 13 până la 16, există unele variante în privința modului în care sunt împărțite. Unii împart aceste elemente în funcție de metalicitate, deși nu există o definiție IUPAC sau un consens precis cu privire la elementele care ar trebui considerate metale, nemetale sau semimetale (uneori denumite metaloizi). De asemenea, nu există un consens cu privire la cum ar trebui să fie numiți metalele care urmează metalele de tranziție, existând posibilități precum "metal post-tranziție" și "metal slab" care au fost utilizate. Anumite monografii avansate exclud elementele din grupul 12 din metalele de tranziție pe baza unor proprietăți chimice uneori foarte diferite, dar aceasta nu este o practică universală și IUPAC nu o menționează în prezent ca fiind permisă în Principiile Nomenclaturii Chimice.[42]
Lantanidele sunt considerate a fi elementele de la La la Lu, care sunt foarte similare între ele: istoric, ele includeau doar Ce–Lu, dar lantanul a devenit inclus prin utilizarea comună. Elementele de pământuri rare (sau metalele de pământuri rare) adaugă scandiu și ytriu la lantanide. Analog, actinidele sunt considerate a fi elementele de la Ac la Lr (istoric Th–Lr), deși variația proprietăților în acest set este mult mai mare decât în cadrul lantanidelor. IUPAC recomandă denumirile „lantanoid” și „actinoid” pentru a evita ambiguitatea, deoarece sufixul "-ide" denotă în mod tipic un ion negativ; totuși, „lantanide” și „actinide” rămân comune. Cu recunoașterea tot mai mare a lutețiului și a lawrenciului ca elemente din blocul d, unii autori au început să definească lantanidele ca fiind de la La la Yb și actinidele ca fiind de la Ac la No, conformându-se blocului f. Transactinidele sau elementele supergrele sunt elementele cu viață scurtă dincolo de actinide, începând de la lawrenciu sau rutherfordiu (în funcție de unde sunt considerate a se termina actinidele).
Există multe alte categorizări care sunt utilizate în funcție de anumite discipline. În astrofizică, un metal este definit ca orice element cu număr atomic mai mare decât 2, adică orice altceva în afară de hidrogen și heliu. Termenul "semimetal" are o definiție diferită în fizică față de cea din chimie: bismutul este considerat un semimetal conform definițiilor fizice, dar în general, chimiștii îl consideră un metal. Există câțiva termeni care sunt folosiți pe scară largă, dar fără o definiție foarte formală, cum ar fi "metal greu", care a primit o gamă atât de largă de definiții încât a fost criticat ca "efectiv lipsit de înțeles".
Amplitudinea termenilor variază semnificativ între autori. De exemplu, conform IUPAC, gazele nobile se extind pentru a include întregul grup, inclusiv elementul supergreu foarte radioactiv oganesson. Totuși, printre cei care se specializează în elementele supergrele, acest lucru nu se întâmplă adesea: în acest caz, „gaz nobil” este în mod tipic luat să indice comportamentul nereactiv al elementelor mai ușoare din grup.[43]
Istoric
Elemente

În Grecia Antică și în China antică, acum mai bine de 2000 de ani, se specula că multitudinea fenomenelor din natură ar putea fi redusă la un număr mic de "elemente". În Grecia, Empedocles a reprezentat teoria celor patru elemente cu elementele Foc, Apă, Pământ și Aer. În China, teoria celor cinci elemente includea elementele lemn, foc, pământ, metal și apă.
Conceptul actual al unui element ca substanță care nu poate fi descompusă mai departe datează de la experții Joachim Jungius și Robert Boyle, în mijlocul secolului al XVII-lea. În 1789, Antoine Laurent de Lavoisier a prezentat prima tabelă sistematică conținând 33 de intrări cu "substanțe simple" suspectate, dintre care 21 erau deja elemente în sensul modern. Cu toate acestea, exista încă o incertitudine completă cu privire la structura internă a elementelor și, astfel, a întregii materii în general. Conform ipotezei atomice a lui John Dalton (1808), toate substanțele sunt compuse din „atomii” minusculi, indivizibili, atomii unui element chimic fiind identici între ei, dar diferiți de atomii altui element în formă și greutate. Conform acestei ipoteze, reacțiile chimice urmau să fie privite ca regrupări ale atomilor indestructibili, iar legile proporțiilor constante și a proporțiilor multiple au fost de asemenea explicate ușor. Deși atomii erau acceptați ca o ipoteză de lucru de mulți chimiști, nu exista nicio dovadă a existenței lor.[44]
Masele atomice
Deși densitățile diferitelor elemente erau cunoscute de mult timp, nu era posibil să se determine masele absolute ale acestora din cauza lipsei de cunoștințe despre numărul și dimensiunea atomilor. Dalton elaborase deja o listă a rapoartelor de masă atomică bazate pe proporțiile constante, cuprinzând 14 elemente și încă destul de imprecisă.
William Prout a observat că multe mase atomice erau aproximativ multiple întregi ale masei atomice a hidrogenului și în 1815 el a făcut ipoteza că toate elementele erau compuse din cantități corespunzătoare de hidrogen ca „substanță primordială”. Masele atomice care anterior erau listate ca nefiind întregi s-ar dovedi totuși a fi numere întregi în urma măsurătorilor mai precise. Ipoteza lui Prout a determinat măsurători mai precise ale maselor, în principal de către Jöns Jakob Berzelius și Jean Servais Stas, care au confirmat că multe mase atomice nu sunt întregi, astfel, au infirmat ipoteza lui Prout, dar au servit ca bază pentru investigații mai fiabile datorită preciziei lor semnificativ îmbunătățite. [45]
În anii 1850, Stanislao Cannizzaro a preluat ipoteza anterior ignorată formulată de Amedeo Avogadro în 1811, conform căreia volumele egale ale diferitelor gaze la aceeași temperatură și presiune conțin același număr de particule. Această ipoteză a permis compararea sistematică a maselor unor cantități egale (deși necunoscute) de atomi în compușii gazoși, iar astfel determinarea maselor atomice relative ale elementelor față de un element de referință. Cu ajutorul lor, numeroase rapoarte cantitative anterior considerate incorecte în compușii chimici au putut fi corectate.[46]
Primele semne de periodicitate

În 1817, fizicianul german Johann Wolfgang Döbereiner a început să formuleze una dintre primele încercări de clasificare a elementelor. În 1829, a descoperit că poate forma unele dintre elemente în grupuri de trei, cu membrii fiecărui grup având proprietăți înrudite. A numit aceste grupuri triade. Clorul, bromul și iodul au format o triadă; la fel au făcut calciul, stronțiul și bariul; litiul, sodiul și potasiul; și sulf, seleniu și telur. Astăzi, toate aceste triade fac parte din grupurile moderne: halogenii, metalele alcalino-pământoase, metalele alcaline și calcogenii. Diferiți chimiști au continuat munca sa și au reușit să identifice tot mai multe relații între mici grupuri de elemente. Cu toate acestea, nu au putut construi o singură schemă care să le cuprindă pe toate.[47]
În februarie 1863, John Newlands a publicat o scrisoare în revista Chemical News despre periodicitatea dintre elementele chimice. În 1864, Newlands a publicat un articol în Chemical News arătând că, dacă elementele sunt aranjate în ordinea maselor atomice, cele care au numere consecutive aparțin adesea aceleiași grupe sau ocupă poziții similare în diferite grupe, și a remarcat că fiecare al optulea element începând de la unul dat este, în acest aranjament, o repetiție a primului, ca a opta notă a unei octave în muzică (Legea octavelor). Cu toate acestea, formularea lui Newlands a funcționat bine doar pentru elementele din grupurile principale și a întâmpinat probleme serioase cu celelalte.
Chimistul german Lothar Meyer a observat secvențele de proprietăți chimice și fizice similare care se repetă la intervale periodice. Conform lui, dacă greutățile atomice erau reprezentate pe axa ordonatelor (vertical) și volumele atomice pe axa absciselor (orizontal) — curba obținută ar prezenta o serie de maxime și minime — elementele cele mai electropozitive ar apărea la vârfurile curbei în ordinea greutăților lor atomice. În 1864, a fost publicată o carte a sa care conținea o versiune timpurie a tabelului periodic cuprinzând 28 de elemente și clasifica elementele în șase familii în funcție de valența lor.[48]
Mendeleev

Punctul de cotitură definitiv a venit de la chimistul rus Dimitri Mendeleev. Deși alți chimiști (inclusiv Meyer) găsiseră alte versiuni ale sistemului periodic aproximativ în același timp, Mendeleev a fost cel mai dedicat în dezvoltarea și apărarea sistemului său, iar sistemul său a fost cel care a avut cel mai mare impact asupra comunității științifice. În 17 februarie 1869 (1 martie 1869 în calendarul gregorian), Mendeleev a început să aranjeze elementele și să le compare după greutatea lor atomică. A început cu câteva elemente, iar pe parcursul zilei sistemul său a crescut până când a cuprins majoritatea elementelor cunoscute. După ce a găsit un aranjament consistent, tabelul său tipărit a apărut în luna mai a anului 1869 în jurnalul Societății Ruse de Chimie. Atunci când elementele nu păreau să se potrivească în sistem, el a prezis îndrăzneț că fie valențele sau greutățile atomice fuseseră măsurate incorect, fie că exista un element lipsă încă neidentificat. În 1871, Mendeleev a publicat un articol lung, care includea o formă actualizată a tabelului său, în care a făcut predicțiile pentru elementele necunoscute explicite. Mendeleev a prezis detaliat proprietățile a trei dintre aceste elemente necunoscute.[49] În 1875, chimistul francez Paul Emile Lecoq de Boisbaudran, lucrând fără cunoștință despre predicția lui Mendeleev, a descoperit un element nou într-o probă din mineralul sfalerit și l-a numit galiu. A izolat elementul și a început să îi determine proprietățile. Mendeleev, citind publicația lui de Boisbaudran, i-a trimis o scrisoare pretinzând că galiul era eka-aluminiul său prezis. Deși Lecoq de Boisbaudran a fost inițial sceptic și a suspectat că Mendeleev încerca să își atribuie meritul pentru descoperirea sa, mai târziu a recunoscut că Mendeleev avea dreptate. În 1879, chimistul suedez Lars Fredrik Nilson a descoperit un element nou, pe care l-a numit scandiu: s-a dovedit a fi eka-borul. Eka-siliciul a fost descoperit în 1886 de chimistul german Clemens Winkler, care l-a numit germaniu. Proprietățile galiului, scandiului și germaniului corespundeau a ceea ce Mendeleev prezisese. În 1889, Mendeleev a observat la Conferința Faraday la Royal Institution din Londra că nu se așteptase să trăiască suficient de mult „pentru a menționa descoperirea lor la Societatea de Chimie a Marii Britanii ca o confirmare a exactității și generalității legii periodice”. Chiar și descoperirea gazelor nobile la sfârșitul secolului al XIX-lea, pe care Mendeleev nu o prezisese, s-a potrivit perfect în schema sa ca un al optulea grup principal.[50]
Cu toate acestea, Mendeleev a întâmpinat unele dificultăți în încadrarea lantanidelor cunoscute în schema sa, deoarece acestea nu prezentau schimbarea periodică a valențelor ca celelalte elemente. După multe cercetări, chimistul ceh Bohuslav Brauner a sugerat în 1902 că lantanidele ar putea fi plasate împreună într-un singur grup pe tabelul periodic.[51]
Număr Atomic

După ce structura internă a atomului a fost investigată, fizicianul amator olandez Antonius van den Broek a propus în 1913 că sarcina nucleară determina plasarea elementelor în tabelul periodic. Fizicianul neozeelandez Ernest Rutherford a inventat termenul "număr atomic" pentru această sarcină nucleară. În articolul său publicat, van der Broek a ilustrat primul tabel periodic electronic, arătând elementele aranjate în funcție de numărul electronilor lor. Rutherford a confirmat în lucrarea sa din 1914 că Bohr a acceptat punctul de vedere al lui van der Broek.[52]

În același an, fizicianul englez Henry Moseley a confirmat experimental propunerea lui van den Broek folosind spectroscopia cu raze X. Moseley a determinat valoarea sarcinii nucleare a fiecărui element, de la aluminiu la aur, și a arătat că ordonarea lui Mendeleev plasează de fapt elementele în ordine secvențială după sarcina nucleară. Sarcina nucleară este identică cu numărul de protoni și determină valoarea numărului atomic (Z) al fiecărui element. Utilizarea numărului atomic oferă o secvență definitivă, bazată pe întregi, pentru elemente. Cercetările lui Moseley au rezolvat imediat discrepanțele dintre masa atomică și proprietățile chimice; acestea erau cazuri precum telurul și iodul, unde numărul atomic crește, dar masa atomică scade. Deși Moseley a fost ucis curând în Primul Război Mondial, fizicianul suedez Manne Siegbahn a continuat munca sa până la uraniu și a stabilit că acesta era elementul cu cel mai mare număr atomic cunoscut atunci (92). Bazându-se pe cercetările lui Moseley și Siegbahn, era cunoscut și la ce numere atomice corespundeau elementele lipsă încă de găsit: 43, 61, 72, 75, 85 și 87. (Elementul 75 fusese de fapt deja descoperit de chimistul japonez Masataka Ogawa în 1908 și numit nipponium, dar el l-a atribuit greșit ca element 43 în loc de 75 și astfel descoperirea sa nu a fost recunoscută în general până mai târziu.[53]
Apariția fizicii atomice a clarificat, de asemenea, situația izotopilor. În lanțurile de dezintegrare a elementelor radioactive primordiale, thoriu și uraniu, a devenit curând evident că existau multe elemente aparent noi care aveau greutăți atomice diferite, dar exact aceleași proprietăți chimice. În 1913, Frederick Soddy a inventat termenul „izotop” pentru a descrie această situație și a considerat izotopii ca fiind pur și simplu forme diferite ale aceluiași element chimic. Acest lucru a clarificat în continuare discrepanțele precum cele dintre telur și iod: compoziția izotopică naturală a telurului este orientată către izotopii mai grei decât cea a iodului, dar telurul are un număr atomic mai mic.[54]
Învelișuri de electroni
| Element | Electroni per înveliș |
|---|---|
| 4 | 2,2 |
| 6 | 2,4 |
| 7 | 4,3 |
| 8 | 4,2,2 |
| 9 | 4,4,1 |
| 10 | 8,2 |
| 11 | 8,2,1 |
| 16 | 8,4,2,2 |
| 18 | 8,8,2 |
Fizicianul danez Niels Bohr a aplicat ideea de cuantizare a lui Max Planck asupra atomului. A ajuns la concluzia că nivelele de energie ale electronilor erau cuantificate: doar un set discret de stări de energie stabilă erau permise. Bohr a încercat apoi să înțeleagă periodicitatea prin configurațiile electronice, presupunând în 1913 că electronii interni ar trebui să fie responsabili pentru proprietățile chimice ale elementului. În 1913, a creat primul tabel periodic electronic bazat pe un atom cuantic.
În 1913, Bohr și-a numit cojile electronice „inele”: orbitalii atomici în interiorul acestora nu existau în momentul modelului său planetar. Bohr explică în Partea 3 a faimosului său articol din 1913 că numărul maxim de electroni într-un strat este opt, scriind: „În plus, vedem că un inel de n electroni nu se poate roti într-un singur inel în jurul unui nucleu cu sarcină ne[gativă] decât dacă n < 8”. Pentru atomii mai mici, straturile electronice ar fi fost umplute astfel: „inelele de electroni se vor uni doar dacă conțin număr egal de electroni; și, prin urmare, numărul de electroni pe inelele interioare va fi doar 2, 4, 8". Totuși, în atomii mai mari, cel mai interior strat ar fi conținut opt electroni: "pe de altă parte, sistemul periodic al elementelor sugerează puternic că deja în neon N = 10 va apărea un inel interior de opt electroni."[55]
Primul care a extins și corectat sistematic potențialele chimice ale teoriei atomice a lui Bohr a fost Walther Kossel în 1914 și în 1916. Kossel a explicat că în tabelul periodic noi elemente ar fi create pe măsură ce electronii erau adăugați la stratul exterior. În articolul lui Kossel, el scrie: "Acest lucru duce la concluzia că electronii, care sunt adăugați ulterior, ar trebui să fie plasați în inele sau coji concentrice, pe fiecare dintre ele ... doar un anumit număr de electroni - în cazul nostru, opt - ar trebui să fie aranjați. În momentul în care un inel sau strat este completat, trebuie să înceapă unul nou pentru următorul element.[56]
Într-un articol din 1919, Irving Langmuir a vorbit despre existența „celulelor”, pe care acum le numim orbitali, care ar putea conține fiecare doar doi electroni, iar acestea erau aranjate în "straturi echidistante", pe care acum le numim coji. A făcut o excepție pentru primul strat, care ar conține doar doi electroni. Chimistul Charles Rugeley Bury a sugerat în 1921 că configurațiile stabile ale electronilor într-un strat sunt de opt și optsprezece electroni. Bury a propus că configurațiile electronilor în elementele de tranziție depind de electronii de valență din stratul lor exterior. A introdus termenul de tranziție pentru a descrie elementele acum cunoscute sub numele de metale de tranziție sau elemente de tranziție. Teoria lui Bohr a fost confirmată de descoperirea elementului 72: Georges Urbain a pretins că l-a descoperit sub forma elementului tera-terțiar celtium, dar Bury și Bohr au prezis că elementul 72 nu putea fi un element terțiar și trebuia să fie un omolog al zirconiului.[57]

În 1923, la îndemnul lui Bohr, Wolfgang Pauli a preluat problema configurațiilor electronice. Pauli a extins schema lui Bohr pentru a folosi patru numere cuantice și a formulat principiul său de excludere, care stabilea că nici doi electroni nu puteau avea aceleași patru numere cuantice. Acest lucru a explicat lungimile perioadelor din tabelul periodic (2, 8, 18 și 32), care corespundeau numărului de electroni pe care fiecare strat îi putea ocupa. În 1925, Friedrich Gundolf a ajuns la configurații apropiate de cele moderne. Ca rezultat al acestor progrese, periodicitatea s-a bazat pe numărul de electroni chimic activi sau de valență în loc de valențele elementelor. Principiul Aufbau care descrie configurațiile electronice ale elementelor a fost observat pentru prima dată empiric de Erwin Madelung în 1926, deși primul care l-a publicat a fost Vladimir Karapetoff în 1930.
Teoria cuantică a clarificat metalele de tranziție și lantanidele ca formând propriile lor grupuri separate, intermediare între grupurile principale, deși unii chimiști propuseseră deja tabele care le arătau în acest fel înainte de aceasta: chimistul englez Henry Bassett a făcut acest lucru în 1892, chimistul danez Julius Thomsen în 1895 și chimistul elvețian Alfred Werner în 1905.
Poziția exactă a lantanidelor, și astfel compoziția grupului 3, a rămas sub dispută timp de zeci de ani în plus, deoarece configurațiile lor electronice au fost măsurate inițial în mod incorect. Din motive chimice, Bassett, Werner și Bury au grupat scandiul și ytriul cu lutețiul în loc de lantan (primii doi au lăsat un spațiu gol sub ytriu deoarece lutețiul nu fusese încă descoperit). În 1988, IUPAC a publicat un raport susținând această compoziție a grupului 3, o decizie care a fost reafirmată în 2021. Varierea poate fi încă găsită în manualele școlare cu privire la compoziția grupului 3, iar unele argumente împotriva acestei formate sunt încă publicate și astăzi, dar chimiștii și fizicienii care au luat în considerare această problemă sunt în mare parte de acord că grupul 3 conține scandiu, itriu, lutetiu și laurenciu și contestă contraargumentele ca fiind inconsistente.[58]
Elemente sintetice

Până în 1936, numărul elementelor lipsă de la hidrogen la uraniu se micșorase la patru: elementele 43, 61, 85 și 87 au rămas lipsă. Elementul 43 a devenit în cele din urmă primul element sintetizat artificial prin reacții nucleare în loc de descoperire în natură. A fost descoperit în 1937 de chimiștii italieni Emilio Segrè și Carlo Perrier, care au numit descoperirea lor tehnețiu, după cuvântul grecesc pentru "artificial". Elementele 61 (promethiu) și 85 (astatin) au fost de asemenea produse artificial în 1945, respectiv 1940; elementul 87 (franciu) a devenit ultimul element descoperit în natură, de către chimista franceză Marguerite Perey în 1939.[59] Elementele dincolo de uraniu au fost, de asemenea, descoperite artificial, începând cu descoperirea neptuniului de către Edwin McMillan și Philip Abelson în 1940 (prin bombardarea uraniului cu neutroni). Glenn T. Seaborg și echipa sa de la Laboratorul Național Lawrence Berkeley (LBNL) au continuat să descopere elemente transuraniene, începând cu plutoniul în 1941, și au descoperit că, contrar gândirii anterioare, elementele începând cu actiniul erau congeneri ai lantanidelor și nu metale de tranziție. Bassett (1892), Werner (1905) și inginerul francez Charles Janet(1928) sugeraseră anterior acest lucru, dar ideile lor nu au fost atunci acceptate în mod general. Seaborg le-a numit astfel actinide. Elementele până la 101 (numite mendeleviu în onoarea lui Mendeleev) au fost sintetizate până în 1955, fie prin iradiere neutroni sau particule alfa, fie în explozii nucleare în cazurile a 99 (einsteiniu) și 100 (fermiu).[60]
În anii 1960 și 1970, a apărut o controversă semnificativă cu elementele 102 până la 106, deoarece a apărut o competiție între echipa LBNL (condusă acum de Albert Ghiorso) și o echipă de oameni de știință sovietici de la Institutul Comun pentru Cercetare Nucleară (JINR) condusă de Georgy Flyorov. Fiecare echipă a pretins descoperirea, iar în unele cazuri fiecare a propus propriul său nume pentru element, creând o controversă privind denumirea elementului care a durat decenii. Aceste elemente au fost obținute prin bombardarea actinidelor cu ioni ușori. La început, IUPAC a adoptat o abordare de așteptare, preferând să vadă dacă va apărea un consens. Dar, deoarece era și perioada Războiul Rece, a devenit clar că acest lucru nu se va întâmpla. Astfel, IUPAC și Uniunea Internațională de Fizică Pură și Aplicată (IUPAP) au creat un Grup de Lucru pentru Transfermiu (TWG, fermiul fiind elementul 100) în 1985 pentru a stabili criterii pentru descoperire, care au fost publicate în 1991.[61]
Tabele periodice alternative

Legea periodică poate fi reprezentată în mai multe moduri, dintre care tabelul periodic standard este doar unul. În decursul a 100 de ani de la apariția tabelului lui Mendeleev în 1869, Edward G. Mazurs a colectat aproximativ 700 de versiuni diferite publicate ale tabelului periodic. Multe forme păstrează structura rectangulară, inclusiv tabelul periodic cu trepte stânga a lui Charles Janet (ilustrat mai jos), și forma modernizată a aranjamentului original cu 8 coloane al lui Mendeleev care este încă comun în Rusia. Alte formate ale tabelului periodic au fost modelate mult mai excentric, cum ar fi spiralele (precum cel ilustrat în dreapta lui Otto Theodor Benfey), cercuri și triunghiuri.[62]
Tabelele periodice alternative sunt adesea dezvoltate pentru a evidenția sau accentua proprietățile chimice sau fizice ale elementelor care nu sunt la fel de evidente în tabelele periodice tradiționale, fiecare fiind orientată mai mult către chimie sau fizică la un capăt sau altul. Forma standard, care rămâne de departe cea mai comună, se situează undeva în mijloc.[63]
Formele variate ale tabelului periodic au stârnit întrebări cu privire la existența unei forme optime sau definitive a acestuia și, în caz afirmativ, cum ar putea arăta aceasta. În prezent, nu există răspunsuri consensuale la niciuna dintre aceste întrebări. Tabelul în trepte stânga al lui Janet este tot mai mult discutat ca fiind candidatul pentru forma optimă sau cea mai fundamentală; Scerri a scris în sprijinul său, deoarece clarifică natura heliului ca element s-block, crește regularitatea prin repetarea tuturor lungimilor de perioade, urmează fidel regula lui Madelung făcând ca fiecare perioadă să corespundă unei valori de n + ℓ și reglează triadele de numere atomice și tendința de anomalie a primului rând.[64]
Extensie viitoare în a șaptea periodă

Cele mai recent denumite elemente - nihoniu (113), moscoviu (115), tennessin (117) și oganesson (118) - au completat al șaptelea rând a tabelului periodic. Elementele viitoare ar trebui să înceapă un al optulea rând. Aceste elemente pot fi denumite fie după numerele atomice (de exemplu, "elementul 119"), fie după numele sistemice ale elementelor adoptate de IUPAC în 1978, care se referă direct la numerele atomice. Toate încercările de a sintetiza astfel de elemente au eșuat până acum. O încercare de a produce elementul 119 este în desfășurare încă din 2018 la institutul de cercetare Riken din Japonia.[65]
Dacă al optulea rând ar urma modelul stabilit de perioadele anterioare, ar conține cincizeci de elemente, umplând suborbitalii 8s, 5g, 6f, 7d și în cele din urmă 8p în această ordine. Dar, până la acest punct, efectele relativiste ar trebui să ducă la devieri semnificative de la regula Madelung. Au fost sugerate diverse modele diferite pentru configurațiile elementelor din al optulea rând, precum și modul de prezentare a rezultatelor într-un tabel periodic. Toate sunt de acord că al optulea rând ar trebui să înceapă ca cele anterioare, cu două elemente 8s, 119 și 120. Cu toate acestea, după aceea, suprapunerile energetice masive între suborbitalii 5g, 6f, 7d și 8p înseamnă că toți încep să se umple împreună, și nu este clar cum să se separe serii specifice 5g și 6f. Elementele 121 până la 156 nu se potrivesc bine ca analogi chimici cu niciun grup anterior din părțile anterioare ale tabelului, deși uneori au fost plasate ca serii 5g, 6f și altele pentru a reflecta formal configurațiile lor electronice.[66]
Situația de la elementele 157 până la 172 ar trebui să revină la normalitate și să amintească mai mult de rândurile anterioare. Orbitalii p grei sunt divizați de interacțiunea spin-orbită: un orbital p (p1/2) este mai stabilizat, iar ceilalți doi (p3/2) sunt destabilizați. (Asemenea schimbări în numerele cuantice se întâmplă pentru toate tipurile de orbitali, dar fac cea mai mare diferență în ordinea pentru orbitalii p.) Este probabil ca, până la elementul 157, orbitalii 8s și 8p1/2 umpluți cu patru electroni în total să fi coborât în nucleu. Prin urmare, sunt necesare cincizeci și patru de elemente, nu cincizeci, pentru a ajunge la următorul element nobil după 118. Cu toate acestea, în timp ce aceste concluzii despre chimia elementelor 157 până la 172 sunt în general acceptate de modele, există dezacord cu privire la modul în care ar trebui trasat tabelul periodic pentru a reflecta analogiile chimice sau dacă ar trebui să reflecte configurațiile electronice formale probabil, care ar trebui să fie destul de diferite față de perioadele anterioare și nu sunt acceptate între surse.[67]
După elementul 172, calculul este complicat de nivelul de energie al electronului 1s devenind imaginar. O astfel de situație are o interpretare fizică, și nu reprezintă în sine o limită electronică a tabelului periodic, dar modul corect de a incorpora astfel de stări în calculele multi-electronice rămâne o problemă deschisă. Aceasta ar trebui rezolvată pentru a continua calcularea structurii tabelului periodic dincolo de acest punct.[68]
Stabilitatea nucleară va fi probabil un factor decisiv care să limiteze numărul de elemente posibile. Aceasta depinde de echilibrul dintre respingerea electrică între protoni și forța puternică care îi leagă pe protoni și neutroni împreună. Protonii și neutronii sunt aranjați în straturi, la fel ca electronii, astfel încât un strat complet poate crește semnificativ stabilitatea: nucleii supraponderali cunoscuți există datorită unei astfel de completări a straturilor, probabil în jurul a 114–126 de protoni și 184 de neutroni.[69]
Pe măsură ce straturile complete sunt depășite, efectul de stabilizare ar trebui să dispară: astfel, nucleidele supergrele cu mai mult de 184 de neutroni sunt de așteptat să aibă durate de viață mult mai scurte, fisionând spontan în decurs de 10–15 secunde. Dacă acest lucru este adevărat, atunci nu ar avea sens să fie considerate elemente chimice: IUPAC definește existența unui element doar dacă nucleul trăiește mai mult de 10–14 secunde, timpul necesar pentru a-și aduna un nor de electroni. Cu toate acestea, estimările teoretice ale semiperioadelor de descompunere depind foarte mult de model și variază pe mai multe ordine de mărime. Repulsia extremă dintre protoni este prevăzută să ducă la topologii nucleare exotice, cu bule, inele și toruri așteptate: acest lucru complică și mai mult extrapolarea. Nu este clar dacă există închideri ulterioare ale învelișurilor, din cauza unei întinderi așteptată a învelișurilor nucleare distincte (așa cum este deja de așteptat pentru straturile electronice la oganesson). Mai mult, chiar dacă există completări ulterioare ale învelișurilor, nu este clar dacă ar permite existența unor elemente atât de grele.
Chiar dacă elementele din rândul opt pot exista, producerea lor probabil va fi dificilă, și ar trebui să devină chiar mai dificilă pe măsură ce numărul atomic crește. Deși se anticipează că elementele 119 și 120 din seria 8s sunt realizabile cu mijloacele actuale, elementele dincolo de acestea ar necesita tehnologii noi, dacă pot fi produse în general. Caracterizarea experimentală a acestor elemente din punct de vedere chimic ar constitui de asemenea o provocare imensă.[70]
Proprietăți periodice
Halogenii
În grupa a 17-a, cunoscută drept grupa de halogeni, elementelor nu le lipsește decât un electron pentru a avea toate straturile ocupate. Din acestă cauză, în reacțiile chimice ele tind să împrumute un electron (tendința de a împrumuta electroni se numește electronegativitate). Această proprietate este cea mai evidentă la Fluor (cel mai electronegativ element din tot tabelul). Ca rezultat, halogenii formează acizi cu hidrogenul, de ex. acidul fluorhidric, acidul clorhidric, acidul bromhidric, acidul iodhidric, toate în forma HX. Aciditatea lor crește cu numărul perioadei.
Știind grupa și perioada unui element, îi putem stabili configurația electronică și numărul atomic. De exemplu să luăm elementul situat în perioada a 3-a, grupa VII A (a 17-a). Știm că elementul are 3 straturi ocupate cu electroni și că pe ultimul strat are 7 electroni, deci configurația va fi: K:2e- L:8e- M:7e-. Având configurația electronică , putem afla numărul atomic adunând toți electronii, deci numărul atomic va fi 17. Având numărul atomic putem afla numele elementului, în acest exemplu: Clor. Din configurația electronică putem afla ce ioni formează elementul. Acceptând un electron, elementul formează 1 ion negativ, deci este un halogen. Pe baza ionului format îi putem stabili valența (1) și electrovalența (−1).
Elementele din grupa VIII A, cea de-a 18-a, mai sunt numite și gaze inerte.
Tipuri de tabele
Tabelul periodic extins conține adițional și blocul g.
Note
Referințe
Vezi și
Legături externe
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
