Loading AI tools
Da Wikipédia, a enciclopédia livre
Tubo polínico é uma estrutura tubular produzida pelo crescimento celular do grão de pólen em direcção ao óvulo, possibilitando a fecundação directa nas plantas espermatófitas (as plantas com semente) sem recurso à zooidogamia, isto é sem dependência de água livre através da qual o esperma móvel pudesse nadar até atingir o óvulo. O tubo polínico resulta da germinação do gametófito masculino (o grão de pólen) e o seu alongamento é uma etapa do ciclo de vida da planta, na qual actua como um conduto para transportar as células do gâmeta masculino (o grão de pólen) até ao óvulo, num processo de fecundação por esperma não móvel designado por sifonogamia.




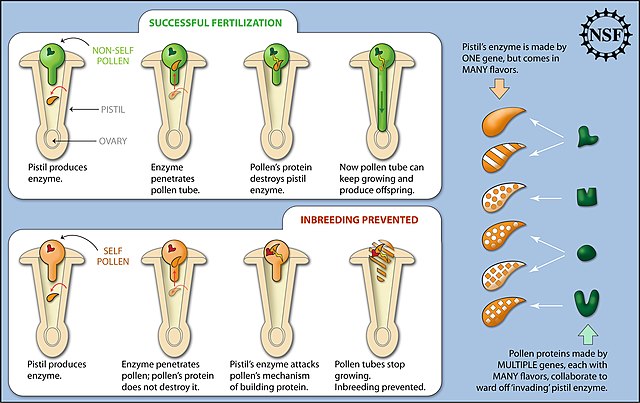

O tubo polínico pode ligar o estigma (em plantas com flor) ao óvulo situado no base do pistilo, penetrando ao longo do estilete, ou directamente crescendo através do tecido que rodeia o óvulo, como ocorre em alguns gimnospermas. O tubo polínico pode ser muito longo, como é o caso do milho, onde esta célula pode crescer mais 30 cm para atravessar o comprimento do longo pistilo.
O grão de pólen possui duas ou mais células no seu interior, uma delas destinada à fecundação do óvulo. No entanto, como os grãos são revestidos por uma cobertura resistente, a única maneira do núcleo espermático atingir o óvulo é através do tubo polínico.
Ao entrar em contacto com a superfície do óvulo (em gimnospermas) ou do estigma (em angiospermas), as células do pólen saem de um estágio de dormência e começam a crescer pelos poros ou fendas do grão de pólen em direcção ao óvulo. As células germinativas do pólen secretam enzimas que rompem os tecidos circundantes e possibilitam o crescimento do tubo polínico, que carrega consigo o núcleo espermático. Os tubos polínicos são usados como modelo para entender o comportamento das células vegetais, estando a ser investigados os processos que levam o tubo polínico responde aos sinais de orientação extracelular para obter a fertilização.[1]
Co uma estrutura que evoluiu ao longo da história evolutiva das plantas, os tubos polínicos são exclusivos das plantas com semente. A formação do tubo polínico é complexa e o mecanismo não é totalmente compreendido, mas é de grande interesse para os cientistas.[1]
A formação do tubo polínico é importante para a reprodução sexuada em plantas com sementes. Vento, água ou polinizadores transportam os grãos de pólen para o gametófito feminino. Contudo, qualquer que seja o método de dispersão, a fertilização depende sempre do transporte do material genético através do estilete (ou directamente através dos tecidos, no caso de algumas gimnospermas, desde o estigma até ao óvulo. Uma vez que um grão de pólen esteja implantado num estigma compatível, ultrapassados os mecanismos de auto-incompatibilidade, o processo de germinação é iniciado.[2] Durante este processo, o grão de pólen sofre uma mudança conformacional, após a qual uma determinada secção começa a projectar-se e forma uma estrutura tubular, que por progressivo alongamento dá origem ao tubo polínico.[3] Essa estrutura desce rapidamente ao longo do comprimento do estilete via crescimento direccionado pela ponta, atingindo taxas de 1 cm/h, carregando duas células de esperma não móveis.[2] Ao atingir o óvulo, o tubo polínico rompe-se, entregando as células espermáticas ao gametófito feminino, resultando num evento de dupla fertilização.[4] O primeiro evento de fertilização produz um zigoto diplóide e o segundo evento de fertilização produz um endosperma triploide.
Os tubos polínicos são produzidos pelos gametófitos masculinos das plantas com semente. Os tubos polínicos agem como condutos para transportar as células do gâmeta masculino do grão de pólen, seja do estigma (em planta com flor) para os óvulos na base do pistilo ou diretamente através do tecido do óvulo em alguns gimnospermas. Os grãos de pólen têm estruturas separadas, como microsporócitos e megasporócitos.
A existência de tubos polínicos foi descoberta por Giovanni Battista Amici no século XIX.
O órgão reprodutor masculino da flor, o estame, produz pólen. A abertura das anteras torna o pólen disponível para polinização com a subsequente transferência dos grãos de pólen para o pistilo, o órgão reprodutor feminino. Cada grão de pólen contém uma célula vegetativa e uma célula geradora que se divide para formar duas células espermáticas. Vectores abióticos, como vento ou a água, ou vetores bióticos, como os animais, realizam a distribuição do pólen.
Uma vez que um grão de pólen se estabeleça num pistilo compatível, germina em resposta a um fluido açucarado secretado pelo estigma maduro. Os lípidos na superfície do estigma também podem estimular o crescimento do tubo polínico de pólen compatível que nele se instale. As plantas que são autoestéreis geralmente inibem os grãos de pólen das suas próprias flores de desenvolverem tubos polínicos. A presença de múltiplos grãos de pólen foi observada como capaz para estimular o crescimento mais rápido do tubo polínico em algumas plantas.[5] A célula vegetativa então produz o tubo polínico, uma protrusão tubular do grão de pólen, que carrega as células espermáticas dentro de seu citoplasma. As células espermáticas são os gâmeta masculinos que se unem ao óvulo e à célula central na fertilização dupla. O primeiro evento de fertilização produz um zigoto diplóide e o segundo evento de fertilização produz um endosperma triploide.
O tubo polínico germinado deve perfurar seu caminho através do estilete rico em nutrientes e curvar-se até atingir a parte inferior do ovário para alcançar um óvulo. Quando o tubo polínico atinge um óvulo, abre-se para liberar os dois espermatozóides. Uma das células espermáticas fertiliza o óvulo, que se desenvolve num embrião, que se torna a futura planta. O outro funde-se com os dois núcleos polares da célula central para formar o endosperma, que serve como suprimento alimentar do embrião. Finalmente, o ovário desenvolve-se num fruto e os óvulos desenvolvem-se em sementes.
O pólen das gimnospermas é produzido em microsporângios localizados nas escamas do cone masculino (o microstróbilo). Na maioria das espécies, as plantas são polinizadas pelo vento e os grãos de pólen das coníferas têm bolsas de ar que reduzem a sua densidade aparente e fornecem flutuabilidade nas correntes de ar. Os grãos são depositados no micrópilo do óvulo do cone feminino (o megastróbilo), onde amadurece por até um ano. Nas coníferas e nas gnetófitas, o pólen germina para produzir um tubo polínico que penetra no megasporângio ou na nucela, carregando núcleos de esperma que são transferidos para a célula do ovo durante o desenvolvimento do arquegónio da planta feminina.[6][7]
Para que o processo de polinização prossiga e a germinação do grão de pólen ocorra, o pistilo do esporófito necessita de mecanismos de reconhecimento do pólen preso no estigma. Esse mescanismo de reconhecimento leva a que, com raras excepções, apenas o pólen da mesma espécie possa germinar com sucesso sobre o estigma. O pólen cruzado, isto é originário de outros indivíduos da mesma espécie, cresce com mais sucesso.[8][9] A acção dos sistemas de auto-incompatibilidade permite que o pólen cruzado cresça e supere o pólen próprio, evitando assim a auto-polinização, ou pelo m,enos fazendo com que ela seja bem menos provável.
A interacção com o estilo e o pólen detecta compatibilidade e influencia a taxa de crescimento do tubo polínico.[10] Este processo de selecção depende da regulação do nível do gene em que os loci do gene do gineceu forçam o próprio pólen a crescer lentamente, ou mesmo pare de crescer ou sofra lise celular enquanto ocorre o crescimento mais rápido do pólen cruzado. Os sistemas de auto-incompatibilidade contribuem assim para a manutenção da diversidade genética.[11][12]
Entre as gimnospermas, que não têm pistilo com estigma, o pólen deve penetrar através da gota de polinização, afundando-se nela, mecanismo que leva o gametófito masculino até ao ovo do óvulo exposto. No entanto, o pólen de espécies diferentes não submerge na gota, sendo deixado a flutuar no topo, enquanto a gota se retrai de volta para o interior do micrópilo.[13]
Quando o grão de pólen é reconhecido e hidratado, germina e inicia-se o crescimento de um tubo polínico.[14] Há competição nesta etapa, pois muitos grãos de pólen podem competir para chegar ao ovo. O estigma desempenha um papel central na orientação do esperma para um óvulo receptivo, no caso da existência simultânea de mais do que um óvulo.[14] Apenas grãos de pólen compatíveis podem crescer conforme determinado pela sinalização bioquímica emitida pelo estigma.
No grão de pólen, a célula geradora dá origem ao esperma, enquanto as células vegetativas dão origem a uma célula tubular que faz crescer o tubo polínico. Algumas plantas têm mecanismos para prevenir a autofecundação, entre os quais a existência de estigmas e anteras que amadurecem em momentos diferentes ou com comprimentos diferentes, o que contribui significativamente para aumentar a diversidade genética da próxima geração.[15][16]
Há uma grande variação na taxa de crescimento dos tubos polínicos e muitos estudos se concentraram nos mecanismos de sinalização bioquímica.[15] A expressão do gene no grão pólen foi identificada como a do gametófito e não do esporófito parental, pois expressa seu próprio mRNA único e as suas próprias enzimas.[15] No pêssego, as condições ambientais no estilete ao longo qual o tubo polínico cresce, fornecem nutrição para o crescimento do tubo até o óvulo.[14] Os tubos polínicos são tolerantes e até mesmo pólen danificado por raios X e raios gama ainda pode crescer tubos polínicos.[15]
O crescimento do tubo polínico é influenciado pela interacção entre o estilete, o estigma e o grão de pólen. O alongamento do tubo é obtido com o alongamento do citoesqueleto, que ocorre iniciando-se pela extremidade, sendo aí regulado por altos níveis de cálcio no citosol.[12] Os níveis de cálcio ajudam as vesículas sinápticas das membranas a crescerem e a se estenderem na extremidade.[9] Os polipeptídeos presentes no estilete também regulam o crescimento do tubo, tendo já sido identificados peptídeos específicos, designados LURE, que desempenham um papel na sinalização para o crescimento.
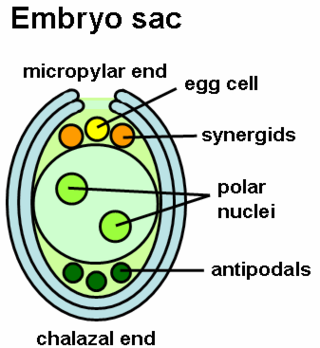
Os peptídeos LURE que são secretados nas células sinérgides, que ocupam o espaço adjacente à oosfera, podem funcionar como sinomonas atractantes. Em embriões de plantas mutantes do género Arabidopsis, especificamente naqueles sem sinérgides, os tubos polínicos não conseguiram crescer. O crescimento do tubo polínico é em direcção a oosferas da mesma espécie, já que a sinalização intraespecífica ajuda a que no processo de fertilização os óvulos e espermatozóides sejam da mesma espécie, reduzindo a probabilidade de hibridação. A sinalização no estilete é importante, já que foi demonstrado que os tubos polínicos podem crescer sem a presença de um saco embrionário, dependendo apenas da apenas interacção com o estilete.[12][8] Outras partes do ovário incluem factores citoplasmáticos como miRNA e gradientes químicos que atraem o tubo polínico para crescer em direcção às sinérgides.[8][17]
Em Arabidopsis thaliana as concentrações de cálcio e etileno estavam envolvidos na terminação do tubo polínico quando ele cresce próximo do ovário. O aumento do cálcio permitiu a libertação dos dois espermatozóides do tubo, bem como a degeneração de uma célula sinérgide.[8] O gradiente químico do cálcio também pode contribuir para o início do crescimento do tubo ou para o seu término no momento apropriado.[17]
O comprimento do tubo polínico varia de acordo com a espécie. Controlado pelos mecanismos de regulação bioquímica, cresce de forma oscilante até que esteja pronto para libertar o esperma próximo ao óvulo para que a fertilização ocorra.[18][19] Alguns tubos polínicos de crescimento rápido foram observados em lírios, tabaco e de Impatiens walleriana.[19][20] A taxa de crescimento confere vantagem ao organismo, mas não está claro se a variação na taxa de crescimento existe na população ou foi seleccionada ao longo de gerações devido ao aumento da aptidão.[15]
Muitas características transicionais foram identificadas que mostram a correlação entre a evolução do tubo polínico com a de um espermatozóide não móvel.[16] As plantas com sementes pertencentes a grupos mais basais, como os pteridófitos, têm esporos e espermatozóides móveis que nadam num meio aquático, num processo de fecundação designado por zooidogamia.[21] O tubo polínico das angiospermas é simples, não ramificado e de crescimento rápido, mas no entanto, este não é o caso das plantas ancestrais.
Em gimnospermas, como Ginkgo biloba, e cicadófitas, forma-se um tubo polínico haustorial. O tubo simplesmente absorve nutrientes do nucelo feminino e cresce em dois estágios. O tubo polínico é altamente ramificado e cresce nos tecidos esporófitos femininos. Primeiro, cresce o tubo principal seguido por uma ponta mais esférica na extremidade para permitir que o esperma seja libertado perto do arquegónio.[21] As células binucleadas são espermatozóides multiflagelados que podem então nadar para o ovo.[16] As cicadas têm uma estrutura menos ramificada e a extremidade da ponta incha da mesma forma que em Ginkgo biloba. Em cicadáceas, entretanto, várias enzimas foram identificadas no tubo polínico que direccionam o crescimento e os tecidos do nucelo são mais danificados com o crescimento do tubo.[16]
Em outros filos de gimnospermas, nomeadamente nas Coniferophyta e Gnetophyta, o esperma não tem mobilidade, pelo que a fecundação corre por sifonogamia, com o tubo polínico a crescer através do arquegónio para ajudar o espermatozóide a chegar ao óvulo mais directamente. O tubo polínico das coníferas pode ser ramificada ou não, e o seu crescimento causa degeneração do tecido feminino à medida que o tubo se alonga através do tecido.[21] Entre os pinheiros, por exemplo, ocorre descarga do citoplasma do esperma e a união de um único espermatozóide com o óvulo, enquanto o restante esperma degenera. No entanto, em Gnetophyta, existem características mais semelhantes aos tubos polínicos das angiospermas, onde o tubo atinge o ovo com uma modalidade inicial de dupla fertilização, mas na qual o endosperma não se forma e a segunda fertilização é abortada.[16]
Nas angiospermas, o mecanismo tem sido estudado mais extensivamente, pois os tubos polínicos em plantas com flor crescem muito rápido por meio de longos estilos para chegar ao ovo bem protegido. Há uma grande variação nos tubos polínicos em angiospermas e muitas plantas modelo como as petúnias, Arabidopsis thaliana, lírios e plantas de tabaco foram estudadas quanto à variação intraespecífica e mecanismos de sinalização.[15] Na plantas com flor, um fenómeno designado por poliembrionia pode ocorrer, resultando em múltiplos óvulos fertilizados. Neste caso, a aptidão geral do organismo ainda está para ser estudada em relação à taxa de crescimento do tubo polínico.[16][15]
Os tubos polínicos são um modelo excelente para a compreensão do comportamento das células vegetais,[22] pois são facilmente cultivados in vitro e apresentam um citoesqueleto muito dinâmico que polimeriza a taxas muito elevadas, fornecendo ao tubo polínico propriedades mecânicas interessantes.[23]
O tubo polínico tem um tipo incomum de crescimento, pois alonga-se exclusivamente no ápice. Alongar a parede celular apenas no extremo da estrutura minimiza o atrito entre o tubo e o tecido invadido. Este crescimento da ponta é realizado de maneira pulsante, em vez de constante.[12] O percurso do tubo polínico através do estilete geralmente resulta em proporções de profundidade para diâmetro acima de 100:1, ou até 1000:1 em certas espécies. Em milho, esta célula pode crescer mais do que 30 cm, comprimento necessário para atravessar o longo pistilo que caracteriza o género Zea. O mecanismo interno e as interacções externas que governam a dinâmica do crescimento do tubo polínico estão longe de ser totalmente compreendidos.
A presença de um citoesqueleto de actina é comprovadamente fundamental para auxiliar no crescimento do tubo polínico.[24] Em termos de distribuição espacial, os filamentos de actina são organizados em três estruturas diferentes dentro do tubo polínico.[24] Cada arranjo único, ou padrão, contribui para a manutenção das características de crescimento celular polarizado do tubo polínico.
Na região apical, zona onde se concentra o crescimento dirigido pela ponta, os filamentos de actina são menos abundantes, porém são altamente dinâmicos. Além disso, ocorre a acumulação de pequenas vesículas no ápice, indicando que esta região é o local crítico de direccionamento da formação de vesículas e da ocorrência de eventos de fusão entre elas. Tais eventos são essenciais para regular a velocidade e direcção do crescimento do tubo polínico.[25]
Na região sub-apical, os filamentos de actina são organizados numa estrutura semelhante a um colar. Nessa região, ocorre fluxo citoplasmático de fonte reversa, processo em que a direcção do fluxo citoplasmático é invertida e continua ao longo dos cordões axiais de actina que constituem a haste.
A região da haste compreende a parte central do tubo polínico. Nesta região, os filamentos de actina são dispostos em feixes axiais de polaridade uniforme, permitindo assim o transporte de várias organelos e vesículas da base do tubo polínico até à ponta (na região apical), impulsionando o crescimento geral do tubo.[25]
Tanto a distribuição espacial quanto a dinâmica do citoesqueleto de actina são reguladas por proteínas actino-ligantes (em inglês actin-binding proteins ou ABPs), um conjunto de proteínas que actuam como proteínas periféricas ou ligantes junto das actinas.
Com o objectivo de observar experimentalmente as mudanças de distribuição de materiais celulares que ocorrem no citoesqueleto de actina durante o crescimento do tubo polínico, foram utilizadas como marcadores proteínas verde-fluorescentes (GFPs),[24] seleccionadas principalmente para fins de visualização dinâmica por fornecerem um meio eficiente para a obtenção de imagens não invasivas dos filamentos de actina nas plantas vivas. Entre as vários proteínas fluorescentes utilizadas durante a experimentação estavam GFP-mTalin, LIM-GFP e GFP-fimbrina/ABD2-GFP.[26] No entanto, cada um desses marcadores ou perturbou a estrutura natural dos filamentos de actina ou rotulou desfavoravelmente tais filamentos. Por exemplo, GFP-mTalin resultou no agrupamento excessivo de filamentos e GFP-fimbrina/ABD2-GFP não rotulou os filamentos de actina localizados nas regiões apicais ou sub-apicais do tubo polínico.[26] À luz dessas desvantagens, o marcador Lifeact-mEGFP foi identificado como o marcador de escolha para filamentos de actina no tubo polínico. O marcador Lifeact-mEGFP é capaz de detectar todos os três arranjos de filamentos de actina e tem efeitos mínimos na estrutura natural desses filamentos.[26] Lifeact-mEGFP foi usado como marcador para estudar a dinâmica de filamentos de actina nos tubos polínicos em crescimento de tabaco, lírios e Arabidopsis.[26]
Por meio de estudos realizados com GFP, foi confirmado que o estado dinâmico dos filamentos de actina localizados na região apical são essenciais para o crescimento do tubo polínico. A experimentação de filamentos de actina corados com GFP-mTalin produziu resultados que confirmam que os filamentos de actina localizados na ponta são altamente dinâmicos.[27] Tal experimentação permitiu estabelecer uma conexão entre a dinâmica dos filamentos de actina localizados na ponta e seu papel na formação de estruturas de actina na região subapical.[27]
Além disso, a experimentação com filamentos de actina localizados na cúpula apical de Arabidopsis indica que os filamentos de actina são continuamente produzidos a partir da membrana apical do tubo polínico; a produção desses filamentos de actina é mediada por forminas. Essas descobertas forneceram evidências que sustentam a teoria de que os filamentos de actina localizados na região apical são altamente dinâmicos e são o local de direccionamento de vesículas e eventos de fusão.
A experimentação com células estioladas do hipocótilo, bem como com culturas de células em suspensão da linhagem BY-2 (da planta do tabaco), mostram que os filamentos de actina altamente dinâmicos produzidos a partir da membrana apical podem ser invertidos por corte do filamento e por eventos de despolarização, ou podem mover-se do ápice para o flanco apical, resultando em diminuição da acumulação de filamentos de actina na região apical do tubo polínico.[2]
A experimentação da dinâmica do filamento de actina na região da haste também foi realizada com o uso de GFP's. Os resultados indicam que o comprimento máximo do filamento nesta região aumenta significativamente e a frequência de corte diminuiu significativamente. Tais constatações indicam que os filamentos de actina localizados na região da haste são relativamente estáveis em comparação com os filamentos de actina localizados nas regiões apicais e sub-apicais.[2]
As proteínas de ligação à actina, conhecidas por ABPs, regulam a organização e dinâmica do citoesqueleto de actina.[2] Como afirmado anteriormente, os filamentos de actina são sintetizados continuamente a partir da membrana apical. Isso indica a presença de factores de nucleação de actina ancorados na membrana. Através da experimentação, foi teorizado que as forminas são representativas de tais factores de nucleação de actina. Por exemplo, a formina AtFH5 foi identificada como um importante regulador da nucleação do filamento de actina, especificamente para os filamentos de actina sintetizados a partir da membrana apical do tubo polínico.
O silenciamento dos genes de AtFH5 resultaram numa diminuição da abundância de filamentos de actina nas regiões apicais e sub-apicais do tubo polínico, fornecendo assim mais evidências para apoiar a teoria de que AtFH5 leva à nucleação o conjunto de filamentos de actina nas regiões apicais e subapicais do tubo polínico.[2]
A formina da classe I designada por AtFH3 é outro factor de nucleação da actina. A formina AtFH3 promove a nucleação do conjunto de filamento de actina dos cordões de actina longitudinais localizados na região da haste do tubo polínico. Mais especificamente, AtFH3 usa o complexo actina/profilina para interagir com o troço final dos filamentos de actina, iniciando assim a nucleação do filamento de actina.[2]
Numerosos trabalhos têm sido dedicados a melhorar a compreensão dos mecanismos que regulam a forma como o tubo polínico responde aos sinais de orientação extracelular para atingir o óvulo e compretar o processo de fertilização.[28][22][29][30]
Ao logo do processo de alongamento, os tubos polínicos reagem a uma combinação de estímulos químicos, eléctricos e mecânicos que vão sendo encontrados durante a sua jornada através do pistilo[31][32][33] No entanto, não está ainda claro como essas indicações externas funcionam ou como são processadas internamente. Além disso, os receptores sensoriais para todos estes estímulos externos ainda não foram bem identificados. No entanto, vários aspectos já foram identificados como centrais no processo de crescimento do tubo polínico. Os filamentos de actina no citoesqueleto, a dinâmica peculiar de parede celular, secretora de vesículas e o fluxo iónico, para citar alguns, são algumas das características fundamentais prontamente identificadas como cruciais, mas cujo papel ainda não foi completamente elucidado.
Durante o crescimento do tubo polínico, os danos no DNA que naturalmente surgem precisam ser reparados para que a informação genómica masculina seja transmitida intacta para a próxima geração. Nas plantas da espécie Cyrtanthus mackenii, o pólen bicelular maduro contém uma célula geradora e uma célula vegetativa.[34] Células de esperma são derivadas por mitose da célula geradora durante o alongamento do tubo polínico. A célula vegetativa é responsável pelo desenvolvimento do tubo polínico. Quebras da cadeia dupla no DNA que surjam no processo parecem ser reparadas de forma eficiente na célula geradora, mas não na célula vegetativa, durante o processo de transporte para o gametófito feminino.[34]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.