Leucemia mieloide aguda
Câncer que Afeta as Células Brancas do Sangue Da Wikipédia, a enciclopédia livre
Leucemia mieloide aguda (LMA), também conhecida como leucemia mielogênica aguda, é um câncer/cancro da linha mieloide dos glóbulos brancos que se caracteriza pela rápida proliferação de células anormais e malignas - os blastos - que não amadurecem, não desempenham sua função e ainda se acumulam na medula óssea, interferindo na produção normal de outras células sanguíneas. É o tipo mais comum de leucemia aguda que afeta adultos, e sua incidência aumenta com o envelhecimento. Embora a LMA seja uma doença relativamente rara, representando cerca de 1,2% dos óbitos causados por doenças oncológicas nos Estados Unidos,[1] espera-se um aumento da sua incidência devido ao envelhecimento da população.
| Leucemia mieloide aguda | |
|---|---|
| Lâmina histológica da medula óssea. As setas indicam os bastões de Auer | |
| Especialidade | oncologia, hematologia |
| Classificação e recursos externos | |
| CID-11 | 2A60.3Z |
| CID-10 | C92.0 |
| CID-9 | 205.0 |
| CID-CID-O | 9861/3 |
| OMIM | 601626 |
| DiseasesDB | 6791 |
| MedlinePlus | 000542 |
| eMedicine | med/34 |
| MeSH | D015470 |
| Leia o aviso médico | |
Os sintomas são causados pela substituição das células normais da medula óssea, resultando em uma queda na contagem de glóbulos vermelhos, plaquetas e de leucócitos normais. Estes sintomas incluem fadiga, falta de ar, hemorragia e aumento do risco de infecções. Embora vários fatores de risco para a LMA sejam conhecidos, a causa específica permanece incerta. Uma característica da doença é sua rápida progressão, podendo ser fatal em um curto espaço de tempo (semanas ou meses) se deixada sem tratamento adequado.
A leucemia mieloide aguda é uma doença potencialmente curável, mas apenas uma pequena parcela dos doentes são curados com a terapia utilizada atualmente. Usualmente o tratamento inicia com quimioterapia, visando a induzir à remissão, embora grande parte dos doentes necessitem de um transplante de medula óssea para alcançar a cura.
É também chamada de leucemia não linfocítica aguda (em inglês Acute nonlymphocytic l, abreviada como ANLL).[2]
História
Resumir
Perspectiva
A primeira descrição de um caso de leucemia na literatura médica data de 1827, quando o médico francês Alfred-Armand-Louis-Marie Velpeau descreveu o caso de uma senhora de 63 anos, que desenvolveu uma doença caracterizada por febre, fraqueza, cálculos renais, hepatomegalia (aumento do volume do fígado) e esplenomegalia (aumento do volume do baço). Velpeau notou também que o sangue da paciente tinha uma consistência diferente do "normal", especulando que a causa seria o que chamou de aparecimento de "corpúsculos brancos".[3] Em 1845, uma série de pacientes que morreram com aumento do baço e mudanças nas "cores e consistência do sangue" foi relatado pelo patologista JH Bennett, que usou o termo "leucocythemia" para descrever esta condição patológica.[4]
A criação do termo "leucemia" data de 1856, e é de autoria de Rudolf Virchow, renomado patologista alemão. Como um pioneiro no uso do microscópio ótico em patologia, Virchow foi o primeiro a descrever o excesso de glóbulos brancos nos doentes com a síndrome clínica descrita por Velpeau e Bennett. Como Virchow não tinha certeza sobre a causa dos glóbulos brancos no sangue estarem elevados, usou então o termo meramente descritivo "leucemia" (do grego: "glóbulos brancos") para referir-se à condição.[5]
Outros avanços que levaram a uma melhor compreensão da leucemia mieloide aguda ocorreram rapidamente com o desenvolvimento de novas tecnologias. Em 1877, Paul Ehrlich desenvolveu uma técnica de coloração que lhe permitiu descrever em detalhes leucócitos normais e anormais. Wilhelm Ebstein introduziu o termo "leucemia aguda" em 1889 para diferenciar os tipos de progressão rápida dos da leucemia crônica.[6] O termo "mieloide" foi criado por Neumann em 1869, o primeiro a reconhecer que os glóbulos brancos eram produzidos na medula óssea. O exame da medula óssea com a finalidade de diagnosticar leucemia foi primeiramente descrito em 1879 por Mosler.[7] Finalmente, em 1900, o mieloblasto, que é uma célula com potencial carcinogênico, foi caracterizado por Naegeli, que divide a leucemia em: mieloide e linfocitária (ou linfocítica).[8][9]
Sinais e sintomas
Resumir
Perspectiva
A maioria dos sinais e sintomas da LMA devem-se a um aumento do número de glóbulos brancos malignos desalojando ou interferindo de alguma forma com a produção normal de glóbulos na medula óssea. A falta de glóbulos brancos normais torna o paciente suscetível a infecções. Já a falta de glóbulos vermelhos (anemia) pode causar fadiga, palidez e falta de ar. A falta de plaquetas pode levar à ocorrência de grandes hematomas ou hemorragias ao mínimo trauma.[carece de fontes]
Os primeiros sintomas da LMA são, na maioria das vezes, inespecíficos e podem ser semelhantes aos da gripe ou de outras doenças comuns. Alguns possíveis sintomas generalizados, incluem febre, fadiga, perda de peso corporal ou perda de apetite, falta de ar, anemia, hematomas, hemorragias, petéquias, dor óssea, dor nas articulações e infecções frequentes e/ou persistentes. Pode ocorrer esplenomegalia, mas geralmente é transitória e assintomática. A linfadenopatia é rara na LMA, em contraste com a leucemia linfoblástica aguda.[carece de fontes]
Alguns doentes podem apresentar edema gengival devido à infiltração de leucócitos no tecido. Em alguns casos raros, o primeiro sinal clínico da doença é o desenvolvimento de uma massa tumoral fora da medula óssea, chamada de sarcoma granulocítico ou cloroma. Muitas vezes o paciente pode não apresentar sintoma algum, bem como a leucemia pode ser descoberta durante exames sanguíneos de rotina.[10]
Causas
Resumir
Perspectiva
Principais fatores de risco:
- Alterações sanguíneas pré-leucêmicas, tais como síndrome mielodisplásica ou síndrome mieloproliferativa podem evoluir para LMA; o risco exato depende do tipo de MDS/MPS.[11]
- Exposição à quimioterapia, especialmente quando utilizados agentes antineoplásicos anquilantes, podem aumentar o risco para o desenvolvimento futuro da LMA. Outros citostáticos, especialmente podophyllotoxin e antraciclina também foram associados com a leucemia. Estas substâncias são freqüentemente associadas a anomalias cromossômicas específicas em leucócitos.[12]
- A exposição à radiações ionizantes pode aumentar o risco de LMA. Sobreviventes do ataque nuclear norte-americano às cidades japonesas de Hiroshima e Nagasaki tiveram um aumento na incidência deste tipo de leucemia,[13] assim como profissionais de radiologia expostos a níveis elevados de raios-x, antes da adoção de práticas modernas de segurança radiológica.[14]
- Exposição a produtos químicos como o benzeno e outros solventes orgânicos podem estar relacionados ao desenvolvimento da doença, embora ainda haja muita controvérsia a este respeito. O benzeno e muitos dos seus derivados são conhecidos por serem substâncias carcinogênicas in vitro. Enquanto alguns estudos sugerem uma relação entre a exposição ao benzeno e aumento do risco de LMA,[15] outros têm sugerido que o risco é muito pequeno.[16]
- Inúmeras síndromes congênitas podem contribuir para aumentar o risco de leucemia; a mais comum é provavelmente a Síndrome de Down, que está associada a um aumento de 10 a 18 vezes do risco de desenvolvimento da LMA.[17]
Epidemiologia
A leucemia mieloide aguda é um câncer relativamente raro. Há cerca de 10 500 novos casos por ano nos Estados Unidos, e a incidência manteve-se estável de 1995 até 2005. A doença representa 1,2% de todas as mortes por câncer neste país.[1] A idade média de diagnóstico é de 63 anos. A LMA representa cerca de 90% de todas as leucemias agudas em adultos, mas é rara em crianças.[1] É ligeiramente mais comum em indivíduos do sexo masculino (proporção de 1,3: 1).[18]
Há variações na incidência da doença entre regiões geográficas diferentes. Nos adultos, as taxas mais elevadas são vistas na América do Norte, Europa, e Oceania, enquanto que na Ásia e América Latina é rara.[19] Entretanto, a incidência de casos em crianças é menos comum na América do Norte e na Índia do que em outras partes do mundo.[20] Essas diferenças podem ser devidas à característica genética da população, fatores ambientais, ou uma combinação destas.[carece de fontes]
Fisiopatologia
Resumir
Perspectiva
A célula maligna, no caso da LMA, é o mieloblasto. Na hematopoiese normal, o mieloblasto é um precursor dos glóbulos brancos imaturos. Um mieloblasto normal irá gradualmente induzir a maturação dos glóbulos brancos. No entanto, na LMA, um único mieloblasto acumula modificações genéticas que "congelam" as células em seu estado imaturo, impedindo assim a diferenciação celular.[21] Essa mutação isoladamente não causa a leucemia; no entanto, quando esta "diferenciação" está associada a outras mutações que perturbem o controle de proliferação celular, o resultado é o crescimento descontrolado de células imaturas, resultando então na leucemia mieloide aguda.[22]
Grande parte da diversidade e heterogeneidade da LMA decorre do fato de que as alterações dos glóbulos brancos podem ocorrer em uma série de diferentes etapas ao longo do percurso de diferenciação.[23] Recentes estudos de classificação para a LMA reconhecem que as características e o comportamento de leucócitos (e da leucemia) dependem da fase em que foram interrompidas na diferenciação celular.[carece de fontes]
Os sintomas e sinais clínicos da LMA resultam do fato de que, como a duplicação de leucócitos cresce, tende a deslocar ou interferir com o desenvolvimento normal de células sanguíneas na medula óssea.[24] Isto leva à neutropenia, anemia, e trombocitopenia. Os sintomas são, muitas vezes, devido ao baixo número destes elementos normais no sangue. Em casos raros, os doentes podem desenvolver sarcomas granulocíticos (ou cloroma) fora da medula óssea, o que pode causar sintomas diferentes dependendo de sua localização.[carece de fontes]
Diagnóstico
Resumir
Perspectiva
O primeiro indício, importante para o estabelecimento do diagnóstico da LMA, é geralmente um resultado anormal em um hemograma. Já o diagnóstico definitivo geralmente requer uma biópsia por aspiração da medula óssea. O exame da medula óssea é frequentemente realizado com a finalidade de identificar o tipo de células sanguíneas anormais. Porém, caso existam muitos glóbulos brancos na circulação sanguínea, a biopsia de medula óssea pode não ser necessária. A medula ou o sangue é analisado através de microscopia ótica, assim como citometria de fluxo, para diagnosticar a presença de leucemia e diferenciar entre seus subtipos.[carece de fontes]
O diagnóstico e classificação da LMA pode ser complexo, e deve ser executado por um médico com experiência na área de hematologia ou patologia. Em casos simples, a presença de certas características morfológicas (como Auer varas) ou resultados específicos de fluxo citométrico podem distinguir esta, de outros tipos de leucemias. No entanto, na ausência de tais características, o diagnóstico pode ser mais difícil.[25]
Segundo os critérios adotados pela Organização Mundial da Saúde, o diagnóstico da LMA é estabelecido pela demonstração do comprometimento de mais de 20% do sangue e/ou medula óssea por mieloblastos.[26] A doença deve ser cuidadosamente diferenciada de condições "pré-leucêmicas" como a síndrome mielodisplásica ou síndrome mieloproliferativa, que são tratados de forma diferente.[carece de fontes]
Devido ao melhor prognóstico (e maior facilidade de tratamento) da leucemia promielocítica aguda (LPA), é importante estabelecer rapidamente o diagnóstico definitivo. O método de hibridização por fluorescência in loco é freqüentemente utilizado para este fim, identificando facilmente a translocação cromossômica que caracteriza a LPA.[27]
Classificação
Resumir
Perspectiva
Os dois esquemas de classificação mais comumente utilizados para a LMA, são o antigo sistema (França, Estados Unidos e Inglaterra) e o mais recente, da Organização Mundial de Saúde.[carece de fontes]
Classificação: FAB (antigo sistema francês, norte americano e britânico)
Este esquema de classificação divide a LMA em 8 subtipos, de M0 a M7, com base no tipo de célula de que a leucemia se originou e também o seu grau de maturidade. Isto é feito através da análise do aspecto das células malignas com o uso da microscopia ótica e/ou usando os recursos da citogenética para caracterizar qualquer anomalia cromossômica que possa ser descoberta. Os subtipos têm diferentes prognósticos e respostas à terapia. Embora a classificação da OMS possa ser mais útil, este sistema ainda é largamente utilizado.[carece de fontes]
Os 8 sub-tipos desta classificação são:[28]
- M0 Leucemia mieloblástica aguda indiferenciada
- M1 Leucemia mieloblástica aguda sem maturação
- M2 Leucemia mieloblástica aguda com maturação
- M3 Leucemia promielocítica aguda ou promielocítica
- M4 Leucemia mielomonocítica aguda
- M5 Leucemia monoblástica aguda (5a) ou Leucemia monocítica aguda (5b)
- M6 Leucemia eritroide aguda ou Eritroleucemia
- M7 Leucemia megacarioblástica aguda
Classificação da Organização Mundial da Saúde
A classificação da OMS para a leucemia mieloide aguda tenta ser mais útil, com significado clínico levando em consideração o prognóstico para produzir mais informações do que a antiga classificação. Cada uma das categorias desta classificação contém numerosos sub-categorias descritivas de interesse para médicos com experiência na área de hematologia e oncologia.[carece de fontes] No entanto, a maior parte das informações clinicamente significativas da classificação da OMS é comunicada através de categorização em um dos cinco subtipos listado abaixo:
Sub-tipos:[29]
- LMA com características de anormalidades genéticas, que inclui LMA com translocação entre o cromossoma 8 e 21, com inversão no cromossoma 16, ou translocações entre os cromossomas 15 e 17. Doentes com LMA nesta categoria geralmente têm uma alta taxa de remissão e um melhor prognóstico, em comparação com outros tipos.
- LMA com displasia multilinear. Esta categoria inclui os doentes que tiveram uma prévia síndrome mielodisplásica (MDS) ou doença mieloproliferativa, que evoluiu para a LMA. Esta categoria é mais freqüentemente em pacientes idosos e muitas vezes tem um pior prognóstico.
- Relacionado à terapia da LMA e SMD. Esta categoria inclui os doentes que realizaram quimioterapia e/ou radioterapia e posteriormente desenvolveram a LMA ou SMD (síndrome mielodisplásica). Esta leucemia pode ser caracterizada por anormalidades cromossômicas específicas e, muitas vezes, leva a um pior prognóstico.
- LMA não categorizadas. Inclui subtipos da LMA que não se inserem nas categorias acima.
- Leucemias agudas de origem ambígua. Leucemias agudas de origem ambígua (também conhecida como fenótipo misto ou leucemia aguda biofenotípica) ocorrem quando as células leucêmicas podem ser classificadas como células mieloides ou linfoides, ou se ambos os tipos de células estão presentes.
Prognóstico
Resumir
Perspectiva

A leucemia mieloide aguda é uma doença potencialmente curável; a chance de cura de um paciente depende diretamente da quantidade de fatores de prognóstico acumulados por este.[30]
Genética celular e prognóstico
A genética celular é um dos fatores mais importantes para a obtenção de um prognóstico fiável da enfermidade, já que existem certas anomalias cromossômicas estritamente relacionadas com subtipos de leucemia (por exemplo a translocação t(15;17) com a leucemia promielocítica aguda). Cerca de metade dos pacientes com LMA apresentam análises de genética celular "normais", sendo então incluídos dentro do grupo de risco incerto. Por outro lado, existem certas anomalias conhecidas e associadas a um prognóstico desfavorável, apresentando um elevado risco de reincidência após o tratamento.[31][32][33]
O primeiro estudo que relacionou as provas genéticas com o prognóstico foi realizado pelo Medical Research Council, analisando amostras de 1 612 pacientes. O trabalho foi publicado em 1998 e resume-se na seguinte tabela:[34]
| Grupo de risco | Anomalia | Sobrevivência por 5 anos | Taxa de recidiva |
|---|---|---|---|
| Favorável | t(8;21), t(15;17), inv(16) | 70% | 33% |
| Incerto | Normal, +8, +21, +22, del(7q), del(9q), Anormal 11q23, qualquer outra mudança estrutural ou numérica | 48% | 50% |
| Desfavorável | -5, -7, del(5q), Anormal 3q, Citogenética complexa | 15% | 78% |
Outros marcadores de prognóstico
Como em todos os tipos de câncer, a condição física e o nível de atividade do paciente tem um importante papel no prognóstico da LMA. Em alguns estudos, os pacientes com idade superior a 60 anos e com níveis elevados de lactato desidrogenase apresentaram pior prognóstico.[35]
Outro tema que tem concentrado boa parte dos esforços de investigação tem sido a busca do significado clínico das mutações do gene c-KIT, que codifica a proteína tirosina-cinase envolvida em processos de regulação da multiplicação celular na LMA.[36] Estas mutações são freqüentes e clinicamente relevantes devido a disponibilidade de certos inibidores da enzima tirosina-cinase, como sunitinib e imatinib, cuja ação pode bloquear farmacologicamente a atividade do gene c-KIT.[carece de fontes]
Outros genes que estão sendo estudados como possíveis fatores de prognóstico ou como alternativas terapêuticas são: CEBPA, BAALC, ERG e NPM1.[carece de fontes]
Expectativa de cura
As taxas de cura em ensaios clínicos variam entre 20% e 45%.[37][38] No entanto, é necessário enfatizar que estes ensaios clínicos somente incluíram pacientes jovens, que são capazes de tolerar terapias mais agressivas. Devido a isto, é muito provável que a taxa global de cura de todos os pacientes com LMA (incluindo os idosos e também pacientes incapazes de tolerar uma terapia agressiva) seja muito inferior. Entretanto, a taxa de cura para a leucemia promielocítica aguda é próxima de 98%.[39]
Tratamento
Resumir
Perspectiva
O tratamento consiste essencialmente na quimioterapia, e está dividido em duas fases: indução e pós-remissão (ou consolidação terapêutica). O objetivo da fase de indução é conseguir uma remissão completa, reduzindo a quantidade de células leucêmicas a um nível indetectável. Já o objetivo da fase de consolidação é eliminar qualquer resíduo da doença que não tenha sido detectado com a finalidade de se obter a cura.[carece de fontes]
Terapia de indução
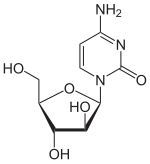

Desde 2006, todos os subtipos FAB da LMA, salvo o M3, recebem usualmente o mesmo tratamento quimioterápico com citorabina (Ara-C) e antraciclina (daunorubicina ou idarubicina).[40] Outras alternativas incluem unicamente altas doses de Ara-C.[41][42] No entanto, estas drogas produzem também efeitos secundários tóxicos, como a mielosupressão e o incremento do risco de infecção, não sendo recomendado seu uso em pessoas com idade avançada. Esta primeira fase de indução requer apenas um mês de hospitalização, do início do tratamento quimioterápico até a recuperação do paciente.[carece de fontes]
A quimioterapia de indução apresenta um esquema de administração denominado "7 + 3", sendo a citorabina administrada de forma continuada durante os 7 primeiros dias e a antraciclina durante os 3 dias seguintes. Em torno de 70% dos pacientes obtém uma remissão com este protocolo de administração.[43]
Quanto ao tipo M3 (FAB) de LMA, também conhecido como leucemia promielocítica aguda, é quase que universalmente tratado com a droga ATRA (em inglês all-trans-retinoic acid) de forma adicional à quimioterapia de indução[44][45][46] Estes casos requerem muita atenção para a prevenção da coagulação intravascular disseminada (CID), uma complicação associada a este tratamento.[carece de fontes]
O objetivo da fase de indução é alcançar uma remissão completa, mas isto não significa que a doença seja curada, mas sim que os métodos de diagnóstico disponíveis não são capazes de detectar indícios de LMA (por exemplo, <5% de células leucêmicas na medula óssea). A remissão completa somente é possível em 50-75% dos pacientes adultos diagnosticados, mas estes valores podem modificar-se devido a alguns fatores relacionados com o prognóstico descritos anteriormente.[47]
A durabilidade do período de remissão depende, em grande parte, do prognóstico da leucemia original. Geralmente, todas as remissões falham se não são seguidas de uma quimioterapia de consolidação (pós-remissão). Isto faz que a consolidação seja uma fase tão importante como a indução para alcançar a cura da leucemia.[48]
Em certas ocasiões o processo de indução deve ser feito mais de uma vez. Nestes casos, alcançar a remissão após uma segunda indução não altera as possibilidades de sobrevivência do paciente, mas o fracasso da remissão após a segunda indução reduz consideravelmente a chance de remissões posteriores.[49]
Terapia de consolidação

Até que se consiga uma remissão completa da leucemia, pode parecer que a enfermidade tenha desaparecido, quando na realidade há uma queda do número de células leucêmicas, deixando-as indetectáveis com os métodos atuais de diagnóstico (embora ainda persistam no organismo). A partir deste ponto aplica-se a terapia de consolidação (ou pós-remissão). Antes da aplicação desta, praticamente 100% dos pacientes sofriam com a volta da doença.[50] Devido a este fato torna-se imprescindível a administração desta segunda terapia para eliminar qualquer resíduo da doença e prevenir sua reincidência.[carece de fontes]
O tipo de terapia de consolidação utilizado em cada caso é específico e individualizado, de acordo com o prognóstico, estado de saúde, idade, etc. Para aquelas leucemias que apresentam um bom prognóstico (por exemplo, inv(16) e t(15;17)) os pacientes são submetidos a uma quimioterapia intensiva adicional de 3-5 ciclos, conhecida como quimioterapia de consolidação.[51][52] No entanto, para pacientes com um elevado risco de reincidência, recomenda-se somente o transplante de medula óssea, se o paciente é capaz de tolerar o procedimento e existe um doador compatível.[carece de fontes]
Recidivas da LMA

Apesar da agressividade das terapias de indução e consolidação, somente 20-30% dos pacientes conseguem curar-se da doença totalmente. Para os pacientes que sofrem uma recidiva, a única terapia potencialmente curativa com comprovação até o momento é o trasplante de medula óssea (para os pacientes que não haviam efetuado o transplante anteriormente).[53][54][55] Em 2000, um fármaco chamado gentuzumab ozogamicina foi aprovado nos Estados Unidos para pacientes com mais de 60 anos com reincidência de LMA e incapazes de suportar altas doses de quimioterapia.[56]
Para aqueles pacientes que apresentam uma reincidência de LMA e não são candidatos a um transplante de medula óssea, ou que sofram uma reincidência da doença após haver recebido o transplante, existe a possibilidade de se oferecer como voluntário para pesquisas científicas de novas drogas (como a clofarabina). Outra opção é a administração de cuidados paliativos para minimizar o sofrimento.[carece de fontes]
Referências
- Jemal A, Thomas A, Murray T, Thun M. Cancer estatístics 2002. CA Cancer J Clin 52:23, 2002. PMID 11814064
- Definition of Acute nonlymphocytic leukemia - MedicineNet.com - www.medterms.com
- Hoffman, Ronald; et al. (2005). Hematology: Basic Principles and Practice 4ª ed. St Louis, Missouri: Elsevier Churchill Livingstone. 1071 páginas. ISBN 0-443-06629-9
- Bennett JH. Two cases of hypertrophy of the spleen and liver, in which death took place from suppuration of blood. Edinburgh Med Surg J. (1845)64:413.
- Virchow R: Die Leukämie. In Virchow R (ed): Gesammelte Abhandlungen zur Wissenschaftlichen Medizin. Frankfurt, Meidinger, 1856, p 190.
- Ebstein W. Ueber die acute Leukämie und Pseudoleukämie. Deutsch Arch Klin Med. (1889)44:343.
- Mosler F. Klinische Symptome und Therapie der medullären Leukämie. Berl Klin Wochenschr. (1876)13:702.
- Naegeli O. Über rothes Knochenmark und Myeloblasten. Deutsch Med Wochenschr. (1900) 26:287.
- Abeloff, Martin; et al. (2004). Clinical Oncology 3ª ed. St Louis, Missouri: Churchill Livingstone. 2834 páginas. ISBN 0-443-06629-9
- Sanz G, Sanz M, Vallespí T, Cañizo M, Torrabadella M, García S, Irriguible D, San Miguel J (1989). «Two regression models and a scoring system for predicting survival and planning treatment in myelodysplastic syndromes: a multivariate analysis of prognostic factors in 370 patients.». Blood. 74 (1): 395–408. PMID 2752119
- Linet, MS. The Leukemias: Epidemiologic Aspects. Oxford University Press, New York 1985.
- Greenlee RT, Hill-Harmon MB, Murray T, et al: Cancer statistics, 2001. CA Cancer J Clin 2001;51:15–36. PMID 11577478
- Linet MS: The leukemias: Epidemiologic aspects. In Lilienfeld AM (ed): Monographs in Epidemiology and Biostatistics. New York, Oxford University Press, 1985, p I.
- Bhatia S, Neglia JP: Epidemiology of childhood acute myelogenous leukemia. J Pediatr Hematol Oncol 17:94, 1995. PMID 7749772
- Fialkow PJ: Clonal origin of human tumors. Biochim Biophys Acta 1976;458:283–321. PMID 1067873
- Fialkow PJ, Janssen JW, Bartram CR: Clonal remissions in acute nonlymphocytic leukemia: Evidence for a multistep pathogenesis of the malignancy. Blood 1991;77:1415–1517. PMID 2009365
- Bonnet D, Dick JE: Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med 1997;3:730–737. PMID 9212098
- Abeloff, Martin et al. (2004), p. 2828.
- Abeloff, Martin et al. (2004), p. 2835.
- Harris N, Jaffe E, Diebold J, Flandrin G, Muller-Hermelink H, Vardiman J, Lister T, Bloomfield C (1999). «The World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues. Report of the Clinical Advisory Committee meeting, Airlie House, Virginia, Novembro de 1997». Ann Oncol. 10 (12): 1419–32. PMID 10643532
- Grimwade D, Howe K, Langabeer S, Davies L, Oliver F, Walker H, Swirsky D, Wheatley K, Goldstone A, Burnett A, Solomon E (1996). «Establishing the presence of the t(15;17) in suspected acute promyelocytic leukaemia: cytogenetic, molecular and PML immunofluorescence assessment of patients entered into the M. R.C. ATRA trial. M. R.C. Adult Leukaemia Working Party.». Br J Haematol. 94 (3): 557-73. PMID 8790159
- Vardiman J, Harris N, Brunning R (2002). «The World Health Organization (WHO) classification of the myeloid neoplasms». Blood. 100 (7): 2292-302. PMID 12239137 Texto completo.
- Wheatley K, Burnett A, Goldstone A, Gray R, Hann I, Harrison C, Rees J, Stevens R, Walker H (1999). «A simple, robust, validated and highly predictive index for the determination of risk-directed therapy in acute myeloid leukaemia derived from the MRC AML 10 trial. United Kingdom Medical Research Council's Adult and Childhood Leukaemia Working Parties.». Br J Haematol. 107 (1): 69-79. PMID 10520026
- Slovak M, Kopecky K, Cassileth P, Harrington D, Theil K, Mohamed A, Paietta E, Willman C, Head D, Rowe J, Forman S, Appelbaum F (2000). «Karyotypic analysis predicts outcome of preremission and postremission therapy in adult acute myeloid leukemia: a Southwest Oncology Group/Eastern Cooperative Oncology Group Study.». Blood. 96 (13): 4075-83. PMID 11110676
- Byrd J, Mrózek K, Dodge R, Carroll A, Edwards C, Arthur D, Pettenati M, Patil S, Rao K, Watson M, Koduru P, Moore J, Stone R, Mayer R, Feldman E, Davey F, Schiffer C, Larson R, Bloomfield C (2002). «Pretreatment cytogenetic abnormalities are predictive of induction success, cumulative incidence of relapse, and overall survival in adult patients with de novo acute myeloid leukemia: results from Cancer and Leukemia Group B (CALGB 8461).». Blood. 100 (13): 4325-36. PMID 12393746
- Grimwade D, Walker H, Oliver F, Wheatley K, Harrison C, Harrison G, Rees J, Hann I, Stevens R, Burnett A, Goldstone A. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. The Medical Research Council Adult and Children's Leukaemia Working Parties. Blood. 1998 Oct 1;92(7):2322-33.
- Haferlach T, Schoch C, Löffler H, Gassmann W, Kern W, Schnittger S, Fonatsch C, Ludwig W, Wuchter C, Schlegelberger B, Staib P, Reichle A, Kubica U, Eimermacher H, Balleisen L, Grüneisen A, Haase D, Aul C, Karow J, Lengfelder E, Wörmann B, Heinecke A, Sauerland M, Büchner T, Hiddemann W (2003). «Morphologic dysplasia in de novo acute myeloid leukemia (AML) is related to unfavorable cytogenetics but has no independent prognostic relevance under the conditions of intensive induction therapy: results of a multiparameter analysis from the German AML Cooperative Group studies.». J Clin Oncol. 21 (2): 256-65. PMID 12525517
- Paschka P, Marcucci G, Ruppert A, Mrózek K, Chen H, Kittles R, Vukosavljevic T, Perrotti D, Vardiman J, Carroll A, Kolitz J, Larson R, Bloomfield C (2006). «Adverse prognostic significance of KIT mutations in adult acute myeloid leukemia with inv(16) and t(8;21): a Cancer and Leukemia Group B Study». J Clin Oncol. 24 (24): 3904-11. PMID 16921041
- Cassileth P, Harrington D, Appelbaum F, Lazarus H, Rowe J, Paietta E, Willman C, Hurd D, Bennett J, Blume K, Head D, Wiernik P (1998). «Chemotherapy compared with autologous or allogeneic bone marrow transplantation in the management of acute myeloid leukemia in first remission.». N Engl J Med. 339 (23): 1649-56. PMID 9834301
- Matthews J, Bishop J, Young G, Juneja S, Lowenthal R, Garson O, Cobcroft R, Dodds A, Enno A, Gillett E, Hermann R, Joshua D, Ma D, Szer J, Taylor K, Wolf M, Bradstock K (2001). «Patterns of failure with increasing intensification of induction chemotherapy for acute myeloid leukaemia.». Br J Haematol. 113 (3): 727-36. PMID 11380464
- Sanz M, Lo Coco F, Martín G, Avvisati G, Rayón C, Barbui T, Díaz-Mediavilla J, Fioritoni G, González J, Liso V, Esteve J, Ferrara F, Bolufer P, Bernasconi C, Gonzalez M, Rodeghiero F, Colomer D, Petti M, Ribera J, Mandelli F (2000). «Definition of relapse risk and role of nonanthracycline drugs for consolidation in patients with acute promyelocytic leukemia: a joint study of the PETHEMA and GIMEMA cooperative groups». Blood. 96 (4): 1247-53. PMID 10942364
- Abeloff, Martin et al. (2004), pp. 2835–39.
- Weick JK, Kopecky KJ, Appelbaum FR, et al: A randomized investigation of high-dose versus standard-dose cytosine arabinoside with daunorubicin in patients with previously untreated acute myeloid leukemia: A Southwest Oncology Group Study. Blood 1996;88:2841–2851. PMID 8874180
- Bishop JF, Matthews JP, Young GA, et al: A randomized study of high-dose cytarabine in induction in acute myeloid leukemia. Blood 1996;87:1710–1717. PMID 8634416
- Bishop J (1997). «The treatment of adult acute myeloid leukemia». Semin Oncol. 24 (1): 57-69. PMID 9045305
- Huang ME, Ye YC, Chen SR, et al: Use of all-trans retinoic acid in the treatment of acute promyelocytic leukemia. Blood 1988;72:567–572. PMID 3165295
- Tallman MS, Anderson JW, Schiffer CA, et al: All-trans-retinoic acid in acute promyelocytic leukemia. N Engl J Med 1997;337:1021–1028. PMID 9321529
- Fenaux P, Chastang C, Chevret S, et al: A randomized comparison of all transretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. The European APL Group. Blood 1999;94:1192–1200. PMID 10438706
- Estey E (2002). «Treatment of acute myelogenous leukemia». Oncology (Williston Park). 16 (3): 343-52, 355-6; discussion 357, 362, 365-6. PMID 15046392
- Cassileth P, Harrington D, Hines J, Oken M, Mazza J, McGlave P, Bennett J, O'Connell M (1988). «Maintenance chemotherapy prolongs remission duration in adult acute nonlymphocytic leukemia». J Clin Oncol. 6 (4): 583-7. PMID 3282032
- Cashen AF, Devine H, DiPersio J (2006). «Second complete remission in an elderly patient with acute myeloid leukemia retreated with decitabine». Am J Hematol. 81 (7): 543-5. PMID 16755561
- Cassileth PA, Hines JD, Oken MM, et al: Maintenance chemotherapy prolongs remission duration in adult acute nonlymphocytic leukemia. J Clin Oncol 1988;6(4):583–587. PMID 3282032
- Mayer RJ, Davis RB, Schiffer CA, et al: Intensive post-remission chemotherapy in adults with acute myeloid leukemia. N Engl J Med 1994;331:896–903. PMID 8078551
- O'Donnell MR, Appelbaum FR, Baer MR, et al: NCCN practice guidelines for acute myelogenous leukemia. Oncology NCCN Proc 2000;14:53–61. PMID 11195419
- Abeloff, Martin et al. (2004), pp. 2840–41.
- Appelbaum FR: Who should be transplanted for AML? [editorial]. Leukemia 2001;15:680–682. PMID 11368380
- Appelbaum FR: Hematopoietic cell transplantation beyond first remission [keynote Address]. Leukemia 2002;16:157–159. PMID 11840278
- Sievers EL, Larson RA, Stadmauer EA, et al: Efficacy and safety of gemtuzumab ozogamicin in patients with CD33-positive acute myeloid leukemia in first relapse. J Clin Oncol 2001;19:3244–3254. PMID 11432892
Ligações externas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

