Hélio
elemento químico com número atómico 2 Da Wikipédia, a enciclopédia livre
O hélio (em grego: Ήλιος; romaniz.: Helios; lit. ""Sol"") é um elemento químico de símbolo He e que possui massa atómica igual a 4 u, apresentando número atômico 2 (2 prótons e 2 elétrons). Em temperatura ambiente o hélio encontra-se no estado gasoso. Apesar da sua configuração eletrônica ser 1s2, o hélio não figura na tabela periódica dos elementos junto com o hidrogênio no bloco s, está colocado no grupo 18 (anteriormente denominado VIIIA ou 0) do bloco p, já que apresenta nível de energia completo, apresentando as propriedades de um gás nobre. Originalmente um gás nobre era considerado incapaz de formar quaisquer compostos químicos, ou seja, inerte (não reage) como os demais elementos. Mas se for submetido a grande pressão (por volta de 300 GPa), juntamente com o sódio, ele formará um novo composto químico.[1] O composto, chamado helida de sódio ou Na2He, é estável em alta pressão e com ligações relativamente fortes.[2]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gás incolor, exibindo brilho roxo quando colocado num campo elétrico de alta voltagem. Linhas espectrais do hélio. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informações gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | Hélio, He, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série química | gases nobres | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 18 (VIIIA), 1, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade, dureza | 0,1785 kg/m3, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CAS | 7440-59-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedade atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa atómica | 4,002602(2) u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 32 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio de Van der Waals | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração electrónica | 1s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elétrons (por nível de energia) | 2 (ver imagem) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estrutura cristalina | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado da matéria | gasoso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 0,95 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 4,22 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusão | 5,23 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporização | 0,0845 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molar | 21,0×10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | 100 Pa a 1,23 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | 972 m/s a 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diversos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 5193 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 0,152 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.º Potencial de ionização | 2372,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.º Potencial de ionização | 5250,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos mais estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades do SI & CNTP, salvo indicação contrária. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
É um gás monoatômico, incolor e inodoro. O hélio tem o menor ponto de evaporação de todos os elementos químicos, e só pode ser solidificado sob pressões muito grandes. É o segundo elemento químico em abundância no universo, atrás do hidrogênio,[3] mas na atmosfera terrestre encontram-se apenas traços, provenientes da desintegração de alguns elementos. Em alguns depósitos naturais de gás é encontrado em quantidade suficiente para a sua exploração. O hélio é usado para o enchimento de balões e dirigíveis; como líquido refrigerante de materiais supercondutores criogênicos e como gás engarrafado utilizado em mergulhos de grande profundidade.
Características principais
Nas condições normais de temperatura e pressão o hélio é um gás monoatômico, tornando-se líquido somente em condições extremas (de alta pressão e baixa temperatura).
Tem o ponto de solidificação mais baixo de todos os elementos químicos, sendo o único líquido que não pode solidificar-se baixando a temperatura, já que permanece no estado líquido no zero absoluto à pressão normal. De resto, sua temperatura crítica é de apenas 5,19 K. Os isótopos 3He e 4He são os únicos em que é possível, aumentando a pressão, reduzir o volume mais de 30%. O calor específico do gás hélio é muito elevado, de vapor muito denso, expandindo-se rapidamente quando é aquecido a temperatura ambiente.
O hélio sólido só existe a pressões da ordem de 100 MPa a 0,90 K (-272,25 °C). Aproximadamente a essa temperatura, o hélio sofre uma transformação cristalina, de estrutura cúbica a estrutura hexagonal compacta. Em condições mais extremas ocorre uma nova mudança, empacotando os átomos numa estrutura cúbica centrada. Todos estes empacotamentos tem energias e densidades semelhantes, debitando-se as mudanças à maneira como os átomos interagem.
Aplicações
Resumir
Perspectiva

O hélio é mais leve que o ar, isto é, a densidade do hélio é menor que a densidade do ar, diferenciando-se do hidrogênio por não ser inflamável, entretanto, apresenta poder ascensional 8% menor. Por este motivo, e por ser um gás inerte, é utilizado em dirigíveis e balões com fins recreativos, publicitários, reconhecimento de terrenos, filmagens aéreas e para investigações das condições atmosféricas. As maiores reservas de Hélio encontram-se nos Estados Unidos. Estas reservas são estratégicas e controladas pelo governo norteamericano. Não estão disponíveis para venda em grande quantidades.
Além das citadas o hélio tem outras aplicações, como:
- A mistura hélio-oxigênio é usada para mergulhos a grande profundidade, já que é inerte e menos solúvel no sangue que o nitrogênio e se difunde 2,5 vezes mais depressa, reduzindo o tempo necessário para a descompressão, apesar de iniciar-se em maior profundidade elimina o risco de narcose por nitrogênio (embriaguez de profundidades);
- A mistura hélio-oxigênio (Heliox) também é usada no tratamento de Asma Grave, Bronquiolite e Laringotraqueite em crianças e DPOC em adultos nas proporções 70% Helio e 30% Oxigênio ou 80% Helio e 20% Oxigênio. Devido a sua baixa densidade e alta viscosidade em comparação ao ar ambiente e oxigênio, o hélio promove uma alteração do fluxo turbulento em laminar nas vias aéreas inferiores, reduzindo o trabalho respiratório do paciente. Além disso, promove melhor transporte de drogas inalatórias usadas no tratamento dessas doenças;[4]
- Devido ao seu baixo ponto de liquefação e evaporação pode ser usado como refrigerante a temperaturas extremadamente baixas em imãs supercondutores e na investigação criogênica a temperaturas próximas do zero absoluto;
- Em cromatografia de gases é usado como gás transportador inerte;
- A atmosfera inerte de hélio é empregada na soldadura por arco e na fabricação de cristais de silício e germânio, assim como para pressurizar combustíveis líquidos de foguetes;
- Em túneis de vento supersônicos;
- Como agente refrigerante em reatores nucleares;
- O hélio líquido encontra cada vez maior uso em aplicações médicas de imagem por ressonância magnética (RMI);
- Em circuitos frigoríficos e ou tubulações em geral normalmente a uma pressão de 6 bar, se emprega como um gás para revelar micros vazamentos que possam ocorrer na montagem de um circuito ou tubulações em geral;
- Em balões flutuantes infantis.
Com o auxilio de espectrômetro de massa, aproxima-se no pontos de solda ou conexões, revelando assim vazamentos de até a equivalência de 2 gramas/ano, assegurando uma vida util maior para os produtos a serem testados.
História
O hélio foi descoberto de forma independente pelo francês Pierre Janssen e pelo inglês Norman Lockyer, em 18 de agosto de 1868, ao analisarem o cromosfera solar durante um eclipse solar ocorrido naquele ano, encontrando uma linha de emissão de um elemento desconhecido. Edward Frankland confirmou os resultados de Janssen e propôs o nome helium para o novo elemento, em honra ao deus grego do sol (Hélio) com o sufixo -ium.[5] Nenhuma análise química foi possível na época, porém posteriormente constatou-se que o Hélio era um gás nobre.[6]
Em 1895 Sir William Ramsay isolou o hélio a partir do aquecimento da cleveíta,[7] descobrindo que não era metálico, entretanto o nome original foi conservado. Os químicos suecos Abraham Langlet e Per Teodor Cleve conseguiram também, na mesma época, isolar o elemento.
Em 1907 Ernest Rutherford e Thomas Royds demonstraram que as partículas alfa são núcleos de hélio.
Em 1908 o físico holandês Heike Kamerlingh Onnes produziu hélio líquido esfriando o gás até 0,9 K, o que lhe rendeu o prêmio Nobel. Em 1926 seu discípulo Willem Hendrik Keesom conseguiu pela primeira vez solidificar o hélio.
Abundância e obtenção
O hélio é o segundo elemento mais abundante do universo, atrás apenas do hidrogênio, constituindo em torno de 20% da matéria das estrelas, em cujo processo de fusão nuclear desempenha um importante papel. A abundância do hélio não pode ser explicada pela formação das estrelas. Ainda que seja consistente com o modelo do Big bang, acredita-se que a maior parte do hélio existente se formou nos três primeiros minutos do universo.
Na atmosfera terrestre existe na ordem de 5 ppm e é originado principalmente pelo decaimento de minerais radioativos de urânio e tório.[8] Além disso, está presente em algumas águas minerais, em gases vulcânicos, principalmente nos vulcões de lama e em certas acumulações comerciais de gás natural e como nos Estados Unidos, Rússia, Argélia, Qatar, Canadá e China de onde provém a maioria do hélio comercial, associado ao gás metano. Devido a sua baixa densidade, o hélio é um importante gás que conduz hidrocarbonetos no processo de migração. Áreas sismogênicas podem apresentar emanações de hélio e radônio.
Pode-se sintetizar o hélio bombardeando núcleos de lítio ou boro com prótons a alta velocidade.
Compostos
Dado que o hélio é um gás nobre, praticamente não participa de reações químicas, ainda que sob a influência de descargas elétricas ou bombardeado com elétrons forme compostos com o tungstênio.
Isótopos
Resumir
Perspectiva
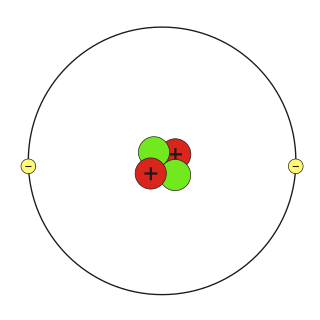
O isótopo mais comum do hélio é o 4He, cujo núcleo está constituído por dois prótons e dois nêutrons. Sua excepcional estabilidade nuclear se deve ao fato de que tem um número mágico de núcleons, isto é , uma quantidade que se distribui em níveis completos ( de modo análogo como se distribuem os elétrons nos orbitais). Numerosos núcleos pesados se desintegram emitindo um núcleo de 4He; este processo, que se denomina desintegração alfa - por isso o núcleo emitido se chama partícula alfa - é a origem da maioria do hélio terrestre.
O hélio tem um segundo isótopo, o 3He, além de outros mais pesados que são radioativos. O hélio-3 é praticamente inexistente na terra, dado que a desintegração alfa produz exclusivamente núcleos de hélio-4 e tanto estes como o hélio atmosférico escapam ao espaço em períodos geológicos relativamente curtos. O hélio-3 pode ocorrer associado com depósitos de hidrocarbonetos (gás natural, petróleo) cuja origem é oriunda do manto da terra.
Ambos isótopos foram produzidos durante o Big bang em quantidades significativas, e continuam sendo produzidos mediante a fusão do hidrogênio nas estrelas.
- Hélio 3
É um isótopo de hélio pouco comum na Terra. Ele é muito abundante na Lua, devido aos ventos solares que acumularam hélio 3 por milhares de anos.
- Hélio 4
É o isótopo mais encontrado na Terra, sendo o mais estável entre todos os isótopos de hélio.
Formas
O hélio líquido (hélio-4) se encontra em duas formas distintas: hélio-4 I e hélio-4 II, entre os quais ocorre uma brusca transição a 2,1768 K (ponto lambda). O He-I, acima dessa temperatura é um líquido normal, porém o He-II abaixo dessa temperatura, não se parece a nenhuma outra substância, converte-se num superfluido cujas características incomuns se devem a efeitos quânticos, um dos primeiros casos que se tem observado em escala macroscópica.
O hélio-II tem uma viscosidade nula, fluindo com facilidade através de finíssimos capilares através dos quais o hélio-I não consegue fluir, e tem, além disso, uma condutibilidade térmica muito maior que qualquer outra substância.
Precauções
Os estoques de gás hélio de 5 a 10 K devem ser armazenados como líquido devido ao grande incremento de pressão que se produz ao aquecer o gás a temperatura ambiente.
Quando aspirado, o hélio distorce a voz (velocidade do som no Hélio é 972 m/s a 20 °C). Deve-se tomar cuidado ao fazer isso, o gás hélio pode provocar sufocamento por supressão de oxigênio.
Referências
- Helium’s inertness defied by high-pressure compound Crushing elements together with diamonds creates a rare mash-up por Emily Conover, publicado por "Science News" (2017)
- A stable compound of helium and sodium at high pressure por Xiao Dong, et al, publicado em Nature Chemistry doi:10.1038/nchem.2716 (2017)
- Georgia State University, Department of Physics and Astronomy, Hyperphysics, Hydrogen-Helium Abundance [em linha]
- Rosanek, M., Roubik, K. Use of Heliox during Spontaneous Ventilation: Model Study. World Academy of Science, Engineering and Technology 20 2008
- Oxford English Dictionary (1989), s.v. "helium". Retrieved December 16, 2006, from Oxford English Dictionary Online. Also, from quotation there: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- Ojima 2002, p. 1
- Mendeleev 1903, p. 497
Ligações externas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
