Dióxido de nitrogénio
composto químico Da Wikipédia, a enciclopédia livre
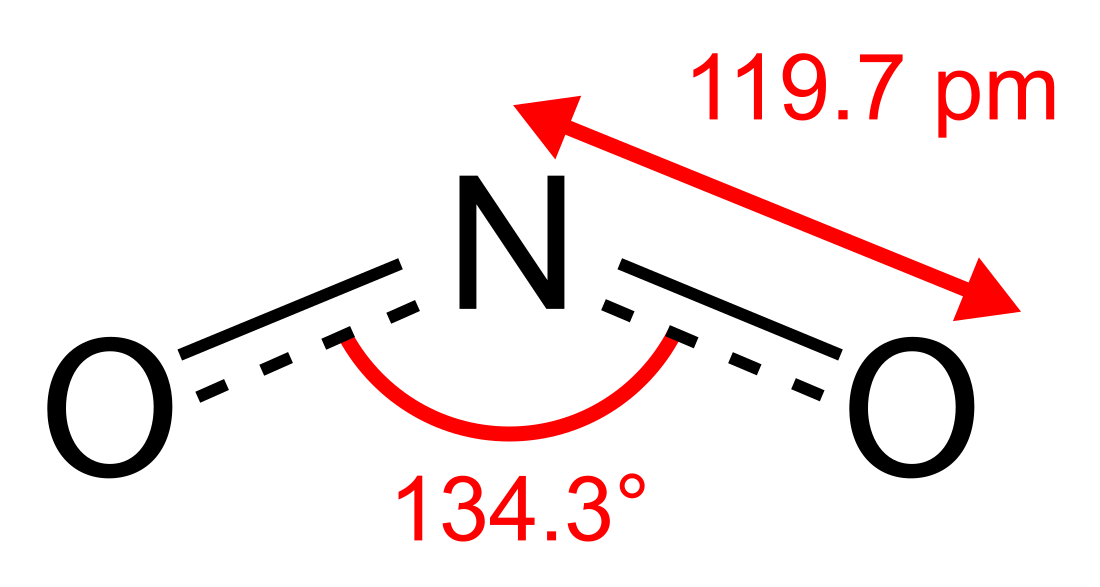
O dióxido de azoto ou dióxido de nitrogénio é um composto químico constituído por dois átomos de oxigénio e um de azoto; a sua fórmula química é NO2. É um dos diversos óxidos de nitrogênio. NO2 é um intermediário na produção industrial do ácido nítrico (HNO3), cuja produção chega a milhões de toneladas anualmente; sendo seu uso primário na produção de fertilizantes. Em temperaturas mais elevadas é um gás vermelho-marrom, Pode ser fatal se inalado em grandes quantidades. Dióxido de nitrogênio é uma molécula paramagnética, de geometria angular, que pertence ao grupo pontual C2v.
| Dióxido de Nitrogênio | |
|---|---|
 | |
 | |
 | |
| Outros nomes | Óxido de nitrogênio/nitrogénio/azoto(IV) |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | NO2 |
| Massa molar | 46.0055 |
| Aparência | gás castanho |
| Densidade | 3,66 g·l−1 (gás a 0 °C) [1] 1,439 g·cm−3 (líquido, no ponto de ebulição)[1] |
| Ponto de fusão |
-11.2 °C[1] (261.95 K) |
| Ponto de ebulição |
21.1 °C[1] (293.25 K) |
| Solubilidade em água | Hidrólise[1] |
| Pressão de vapor | 963 hPa[1] (20 °C) |
| Riscos associados | |
| Classificação UE | Altamente tóxico (T+) |
| NFPA 704 | |
| Frases R | R26, R34 |
| Frases S | S1/2, S9, S26, S28,S36/37/39, S45 |
| Compostos relacionados | |
| Óxidos de nitrogênio (chamados, pela indústria, como NOx) relacionados | Óxido nítrico (NO) Óxido nitroso (N2O) Trióxido de dinitrogênio (N2O3) Tetróxido de nitrogênio (N2O4, dímero) Pentóxido de dinitrogênio (N2O5) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
NO2 possui um cheiro forte e irritante, é muito tóxico, é um poderoso oxidante que, nas reacções na atmosfera pode dar origem a ácido nítrico, bem como a nitratos orgânicos que contribuem para fenómenos com elevado impacto ambiental, como as chuvas ácidas e a eutrofização de lagos e rios. Desempenha um papel fundamental no ciclo químico do ozono.
Ele pode ser formado nas reações de combustão dos motores a explosão, na queima de querosene, a partir da reação de ácido nítrico (em excesso) com alguns metais (como a prata), ou a partir da reação de óxido nítrico (NO) com oxigénio (O2).
O dióxido de azoto existe em equilíbrio com o tetróxido de nitrogênio N2O4.
Preparação e reações
Resumir
Perspectiva
Dióxido de nitrogênio normalmente é liberado pela oxidação de óxido nítrico no ar:[2]
2 NO + O2 → 2 NO2
Dióxido de nitrogênio é formado na maioria dos processos de combustão que utilizam ar como oxidante. Em temperaturas elevadas, o nitrogênio se combina com oxígênio para formar óxido nítrico:
O2 + N2 → 2 NO
No laboratório, NO2 pode ser preparado em um procedimento de duas etapas, onde a desidratação de ácido nítrico produz pentóxido de dinitrogênio (N2O5), que subsequentemente sofre decomposição térmica:
2 HNO3 → N2O5 + H2O
2 N2O5 → 4 NO2 + O2
A decomposição térmica de alguns nitratos metálicos também libera NO2:
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2
Outra alternativa é a redução de ácido nítrico concentrado por metais (como o cobre).
4 HNO3 + Cu → Cu(NO3)2 + 2 NO2 + 2 H2O
Ou finalmente pela adição de ácido nítrico concentrado em estanho. O ácido estânico é produzido como subproduto.
4 HNO3 + Sn → H2O + H2SnO3 + 4 NO2
Reações principais
Propriedades térmicas básicas
NO2 existe em equilíbrio com o gás incolor tetróxido de dinitrogênio (N2O4):
2 NO2 ⇌ N2O4
O equilíbrio é caracterizado por ter ΔH = −57.23 kJ/mol, que é exotérmico. A formação de NO2 é favorecida em temperaturas mais elevadas, e a forma N2O4 é predominante em temperaturas mais baixas.
N2O4 pode ser obtido como um sólido branco com um ponto de fusão de -11,2 °C.[2] NO2 é paramagnético devido a um elétron desemparelhado, enquanto que N2O4 é diamagnético.
A química do dióxido de nitrogênio foi investigada extensivamente. A 150 °C, NO2 se decompõe liberando oxigênio por um processo endotérmico (ΔH = 14 kJ/mol):
2 NO2 → 2 NO + O2
Como um oxidante
Como sugerido pela fraca ligação N–O, NO2 é um bom oxidante. Consequentemente, irá sofrer combustão, às vezes de forma explosiva, com muitos compostos, como por exemplo os hidrocarbonetos.
Hidrólise
NO2 hidrolisa para formar ácido nitroso (HNO2) e ácido nítrico:
2 NO2 (N2O4) + H2O → HNO2 + HNO3
Essa reação é uma etapa do processo de Ostwald para produção industrial do ácido nítrico a partir da amônia.[3] A reação é bastante lenta em baixas concentrações de NO2, o que é característico da atmosfera ambiente, porém ocorre em NO2 absorvido em superfícies. Presume-se que a reação na superfície produz HNO2 gasoso (às vezes escrito como HONO) em ambientes externos e internos.[4]
Formação pela decomposição do ácido nítrico
Ácido nítrico decompõe-se lentamente em dióxido de nitrogênio pela reação geral:
4 HNO3 → 4 NO2 + 2 H2O + O2
O dióxido de nitrogênio formado confere uma cor amarela característica normalmente exibida por este ácido.
Conversão para nitratos
NO2 é usado para gerar nitratos de metal anidros a partir de óxidos:[2]
MO + 3 NO2 → M(NO3)2 + NO
Conversão para nitritos
Iodetos de alquila e de metais formam os nitritos correspondentes:.
2 CH3I + 2 NO2 → 2 CH3NO2 + I2
TiI4 + 4 NO2 → Ti(NO2)4 + 2 I2
Riscos à saúde
O NO2 é um gás irritante para os pulmões e diminui a resistência às infecções respiratórias. Os efeitos às exposições de curto prazo ainda não são bem conhecidos, mas a exposição continuada ou frequente a níveis relativamente elevados pode provocar tendência para problemas respiratórios em crianças e grupos de risco como os asmáticos.
Impactos ambientais
O dióxido de nitrogênio, assim como os outros óxidos de nitrogênio (NOx), é considerado um poluente atmosférico primário. Ele pode ser formado naturalmente, pela ação de microrganismos presentes no solo e por descargas elétricas na atmosfera (raios). Quanto as emissões antropogênicas, a maior parte ocorre pela combustão de combustíveis fósseis em altas temperaturas nas indústrias e veículos automotores.[5]
NO2 pode reagir com radicais hidróxido, provenientes principalmente da água, formando ácido nítrico; sendo assim responsável pelo fenômeno da chuva ácida, juntamente com o dióxido de enxofre (SO2) que forma ácido sulfúrico.
Referências
- Registo de CAS RN 10102-44-0 na Base de Dados de Substâncias GESTIS do IFA
- Wiberg, Egon (2001). Inorganic chemistry. Nils Wiberg, A. F. Holleman 1st English ed. ed. San Diego: Academic Press. OCLC 48056955
- Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm (15 de junho de 2000). Wiley-VCH Verlag GmbH & Co. KGaA, ed. «Nitric Acid, Nitrous Acid, and Nitrogen Oxides». Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA (em inglês): a17_293. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a17_293. Consultado em 9 de agosto de 2021
- Finlayson-Pitts, B. J.; Wingen, L. M.; Sumner, A. L.; Syomin, D.; Ramazan, K. A. (2 de janeiro de 2003). «The heterogeneous hydrolysis of NO2 in laboratory systems and in outdoor and indoor atmospheres: An integrated mechanism». Physical Chemistry Chemical Physics (2): 223–242. doi:10.1039/b208564j. Consultado em 9 de agosto de 2021
- Díaz Cónsul, Julia María; Thiele, Daniel; Cataluña Veses, Renato; Baibich, Ione Maluf; Dallago, Rogério Marcos (junho de 2004). «Decomposição catalítica de óxidos de nitrogênio». Química Nova (3): 432–440. ISSN 0100-4042. doi:10.1590/s0100-40422004000300013. Consultado em 24 de setembro de 2021
Ligações externas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.