Top Qs
Linha do tempo
Chat
Contexto
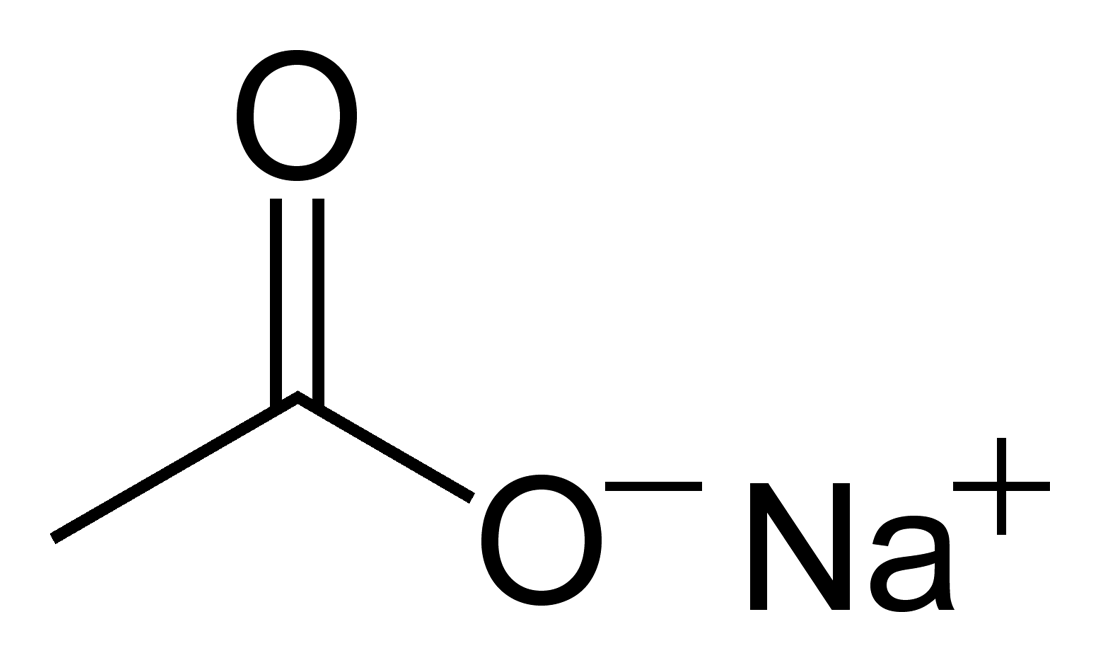
Acetato de sódio
composto químico Da Wikipédia, a enciclopédia livre
Remove ads
Acetato de sódio, também chamado etanoato de sódio, é um composto cristalino incolor, de fórmula ( NaO2CCH3 ), possuindo massa molar de 82,03378928. Apresenta-se normalmente na forma de sal anidro ou trihidratado. Ambas as formas são solúveis em água e em etoxietano e ligeiramente solúveis em etanol.
Remove ads
Remove ads
Aplicações
Resumir
Perspectiva
Indústria
Acetato de sódio é usado na indústria têxtil para neutralizar correntes de rejeitos contendo ácido sulfúrico, e como um fotorresistente quando usa-se corantes à anilina. Também é um agente de decapagem em curtimento ao cromo, e auxilia a retardar vulcanização de cloropreno em produção de borracha sintética.
Soluções tampão
Como o acetato de sódio é um sal de uma base forte e de um ácido fraco, como uma base conjugada de um ácido fraco, uma solução de acetato de sódio e ácido acético podem atuar como um tampão para manter um pH relativamente constante, sendo usado na formulação de tampões para controle de pH em muitas aplicações de laboratório.[2] Isto é especialmente útil em aplicações bioquímicas onde as reações são dependentes do pH.
A equação de Henderson-Hasselbalch pode ser utilizada para se calcular a concentração de ácido acético e acetato de sódio necessárias para o preparo da solução tampão para diferentes pH[3].
Uma tabela de pH em função das formulações de soluções tampão acetato de sódio e ácido acético:
[4]
Alimentos
Pode ser adicionado como um amortecedor no controle do pH dos alimentos durante as várias etapas de seu processamento, bem como para o item de consumo final, onde é adicionado como um conservante, regulador de acidez e reforçador de sabor.[5] Pode ser usado na forma de diacetato de sódio — um complexo 1:1 de acetato de sódio e ácido acético,[6] com o número E E262.
Um frequente uso desta forma é em batatas chips sal e vinagre nos EUA. Muitas marcas estadunidenses, incluindo o fabricante nacional Frito-Lay, dizem batatas chips flavorizadas com "sal e vinagre" quando usam esta substância química, com lactose e menores porcentagens de outras substâncias, em vez de verdadeiros sal e vinagre na preparação.[7]
Outros usos
É também em eletrogalvanização. É usado também na tinturaria, sabões, farmacêutica, na fórmula de diuréticos e expectorantes, e em fotografia.
Na produção de plásticos, acetato de sódio é usado como um retardador de elastômeros. A indústria do petróleo o aplica como um agente tamponador na produção de petróleo, lama de perfuração e fluidos de conclusão de poços.
O acetato de sódio é adicionado na avicultura à água potável para as galinhas para ajudar a evitar doenças associadas com o superaquecimento e desidratação.
Além disso, por ser um processo altamente exotérmico, a cristalização do acetato de sódio encontrou aplicação em compressas quentes, na forma de uma bolsa plástica selada, contendo uma solução supersaturada de acetato de sódio em água e um pequeno disco metálico.
Flexionando-se o disco metálico, dá-se início à cristalização do acetato de sódio, com consequente evolução de calor. Para que o sólido cristalizado se dissolva de novo, basta aquecer a bolsa contendo o acetato de sódio cristalizado em água fervente por aproximadamente 10 minutos.
Remove ads
Preparação

Para uso laboratorial, acetato de sódio é um produto químico barato, e geralmente é comprado em vez de ser sintetizado. É algumas vezes produzido em um experimento de laboratório pela reação de ácido acético com carbonato, bicarbonato ou hidróxido de sódio. Estas reações produzem acetato de sódio aquoso e água. Dióxido de carbono é produzido na reação com carbonato ou bicarbonato de sódio, e deixa o vaso de reação como um gás (a menos que o vaso de reação seja pressurizado). Esta é a conhecida reação "vulcão" das feiras de ciência entre o bicarbonato de sódio e o vinagre.
- CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
A reação com o carbonato de sódio, mais vigorosa, é a seguinte:
- 2 CH3COOH + Na2CO3 → 2 CH3COONa + H2O + CO2
Industrialmente, o acetato de sódio é preparado pelo ácido acético glacial e o hidróxido de sódio.
- CH3COOH + NaOH → CH3COONa + H2O
Remove ads
Reações químicas
Acetato de sódio pode ser usado para formar um éster, como o acetato de etila, com um haleto de alquila tal como o bromoetano:
- NaO2CCH3 + BrCH2CH3 → C2H5O2CCH3 + NaBr
Questões de segurança
Resumir
Perspectiva
Risco de incêndio
Altamente comburente
Risco de explosão
Baixo. É possível a explosão das partículas finamente dispersas no ar em concentrações suficientes, e na presença de uma fonte de ignição.
Risco de desastre
Baixo. Durante um incêndio gases tóxicos e irritantes podem ser gerados por decomposição térmica ou combustão.
Combate a incêndio
Usar pó químico seco, água pulverizada, gás carbônico ou espuma.
Incompatibilidade
Agentes oxidantes fortes. Misturas explosivas podem ser formadas com flúor ou nitrito de potássio.
Produtos perigosos da decomposição
Monóxido e dióxido de carbono, fumos tóxicos de óxido de sódio.
Reações perigosas
Ocorrem com ácidos fortes. Risco baixo.
Efeitos quando ocorre inalação
Pode causar irritação ao trato respiratório. Os sintomas podem incluir tosse, irritação na garganta, dificuldade respiratória e dor no peito.
Efeitos quando ocorre contato com a pele
Pode causar irritação, vermelhidão e dor.
Efeitos quando ocorre contato com os olhos
Pode causar irritação, vermelhidão e dor.
Efeitos quando ocorre ingestão
Grandes doses podem produzir dores abdominais, náuseas e vômitos.
Procedimentos de primeiros socorros
- inalação: Remover para local arejado e repousar. Se cessar a respiração, aplicar método de reanimação cardiopulmonar.
- contato com os olhos: Lavar imediatamente com muita água por, pelo menos, 15 minutos.
- contato com a pele: Lavar imediatamente com muita água e sabão até que toda a substância seja removida da pele.
- ingestão: Se a vítima estiver consciente, beber de 2 a 4 copos de água ou leite. Chamar auxílio médico.
Procedimento nos casos de derrames - vazamentos
Conter o derrame. Ventilar o local. Recolher as camadas superiores para a embalagem de origem, se não tiver havido contaminação.
Remove ads
Acondicionamento
Frascos de plástico.
Manuseio e armazenamento
Manter em lugar fresco, seco, bem ventilado e separado de ácidos fortes. Dispor em recipientes especiais, fechados e devidamente etiquetados. Evitar contato com olhos, pele e roupas. Lavar-se bem após o manuseio.
Referências
- Registo de CAS RN 127-09-3 na Base de Dados de Substâncias GESTIS do IFA, accessado em 20 de Janeiro de 2008
- Thompson, J.E. A Practical Guide to Contemporary Pharmacy Practice. 2nd ed. Philadelphia: Lippincott Williams & Wilkins, 2004.
- Voet, Donald; Voet, Judith G. (1 de janeiro de 2013). Bioquímica - 4ed. [S.l.]: Artmed Editora. ISBN 9788582710050
- Anderson de Oliveira Ferreira; pH & tampões[ligação inativa]
- Diário Oficial - Nº161 - Seção 1, quarta-feira, 21 de agosto de 2002; AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA; Diretoria Colegiada RESOLUÇÃO-RDC Nº 234, DE 19 DE AGOSTO DE 2002 Arquivado em 13 de junho de 2010, no Wayback Machine.
- Sodium Diacetate Arquivado em 12 de outubro de 2010, no Wayback Machine. - www.jungbunzlauer.com (em inglês)
- «Cópia arquivada». Consultado em 1 de janeiro de 2011. Arquivado do original em 23 de novembro de 2010
Remove ads
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



![{\displaystyle pH=pKa+\log[CH_{3}COO^{-}]\div [CH_{3}COOH]}](http://wikimedia.org/api/rest_v1/media/math/render/svg/52bb2d2200cbfe171a4024f7c26a49e94b658c5f)