Keteny
każdy związek organiczny, w którym grupa karbonylowa jest połączona z grupą alkilidenową poprzez wiązanie podwójne Z Wikipedii, wolnej encyklopedii
Keteny – nienasycone ketony ze skumulowanymi podwójnymi wiązaniami >C=C=O. Przeważnie gazowe, bardzo reaktywne i toksyczne związki chemiczne. Chemię ketenów jako pierwszy badał Hermann Staudinger[1].

Zwyczajowo ketenem nazywa się najprostszego przedstawiciela tej grupy związków, etenon (CH
2=C=O).
Keten (etenon) – właściwości
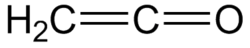
Etenon jest bezbarwnym gazem o ostrym zapachu, drażniącym oczy i błony śluzowe, po dłuższej ekspozycji może wystąpić obrzęk płuc[potrzebny przypis]. Temp. topn. −150 °C, temp. wrz. −49 °C[2].
Etenon ma 8 teoretycznie możliwych izomerów (4 tautomery, 2 izomery typu eteru i 2 izomery cykliczne typu oksiranu), z których teoretycznie najtrwalszy i potencjalnie najłatwiejszy do zaobserwowania jest hydroksyacetylen, CH≡C−OH:

Ma on energię o 152 kJ/mol większej od ketenu, ale jest oddzielony od niego barierą energetyczną o wysokości 305 kcal/mol[3], dzięki czemu ma on charakter związku metastabilnego. Można go wygenerować w spektrometrze mas[4].
Otrzymywanie
- z chlorków kwasowych przez eliminację chlorowodoru za pomocą zasady, zazwyczaj trietyloaminy:
- przegrupowanie Wolffa α-diazoketonów (przebiegające poprzez oksiren przegrupowujący się następnie do ketenu[3])
- dehydratacja kwasu fenylooctowego za pomocą zasady (wykorzystuje się tu dużą kwasowość protonu α substratu).
Reaktywność
Keteny są bardzo reaktywnymi związkami acylującymi. Hydrolizują do kwasów karboksylowych, pod wpływem amoniaku tworzą amidy, natomiast w reakcji z alkoholami dają estry. Z bogatymi w elektrony alkinami ulega cykloaddycji [2+2] do cyklobutenonów.
Łatwo dimeryzują do cyklicznych diketenów[2]:

Reakcja ta przebiega w ponad 95% w kierunku β-laktonu, czemu towarzyszy powstawanie małych ilości cyklobutano-1,3-dionu. Po ogrzaniu diketenu do 350–600 °C następuje odtworzenie ketenu, co jest wykorzystywane jako wygodne źródło tego związku w skali laboratoryjnej[2].
Bis-keteny (O=C=CH−R′−CH=C=O) polimeryzują z diolami (HO−R−OH) dając poliestry o wzorze ogólnym (−O−R−O−CO−CH
2−R′−CH
2−CO−)
n.
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

