Svoveldioksid
kjemisk forbindelse From Wikipedia, the free encyclopedia
Svoveldioksid er en fargeløs gass som dannes ved at svovel brenner. Svoveldioksid reagerer med oksygen, og er lett løselig i vann. Dette gjør at svoveldioksid kan medføre uønskede helseeffekter.
| Svoveldioksid | |||
|---|---|---|---|
 | |||
| Identifikatorer | |||
| CAS-nummer | |||
| Kjemiske egenskaper | |||
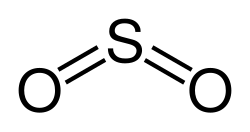
| Formel | SO2 | ||
| Molar masse | 64,066 g/mol | ||
| Utseende | Fargeløs gass med stikkende lukt | ||
| Tetthet | 2,6288 kg/m3 | ||
| Smeltepunkt | −72 °C | ||
| Kokepunkt | −10 °C | ||
| Løselighet | 94 g/L (i vann) | ||

Reaksjonslikninger
Reaksjonsligningen viser at et svovelatom kan reagere med oksygengass og danne svoveldioksid:
S + O2 → SO2
Reaksjonslikningen nedenfor viser at dersom svoveldioksid løses i vann, dannes svovelsyrling:
SO2 + H2O → H2SO3
Svovelsyrling kan igjen reagere med oksygen og danne svovelsyre, som vist i reaksjonslikningen nedenfor:
2 H2SO3 + O2 → 2 H2SO4
Svoveldioksid kan også reagere med hydrogenperoksid og danne svovelsyre:
SO2 + H2O2 → H2SO4
Strukturformel og bindingstyper
SO2 er et bøyd molekyl med C2v symmetrigruppe. Svovelatomet har et oksidasjonstrinn på +4, en ladning på 0, og er omgitt av 5 elektronpar og kan beskrives som et hypervalent molekyl. Fra perspektiv av molekylorbitalteorien, er de fleste valenselektronene bundet opp i S-O bindinger.

S-O bindingene er kortere i SO2 (143.1 pm) enn i svovelmonoksid, SO (148.1 pm), mens O-O bindingene er lenger i O3 (127.8 pm) enn i dioksigen, O2 (120.7 pm). Bindingsenergien er større i SO2 (548 kJ mol−1) enn i SO (524 kJ mol−1), mens den er mindre i O3 (297 kJ mol−1) enn i O2 (490 kJ mol−1). Disse dataene fører kjemikere til å konkludere med at S-O bindingene i svoveldioksid har en bindingsorden på minst 2, som er forskjellig fra O-O bindingene i ozon, som har en bindingsorden på 1.5[1]
Se også
Referanser
Eksterne lenker
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
