kjemisk sambinding From Wikipedia, the free encyclopedia
Karbondioksid (CO2) er ei kjemisk sambinding. Det er ein gass ved standard temperatur og trykk.
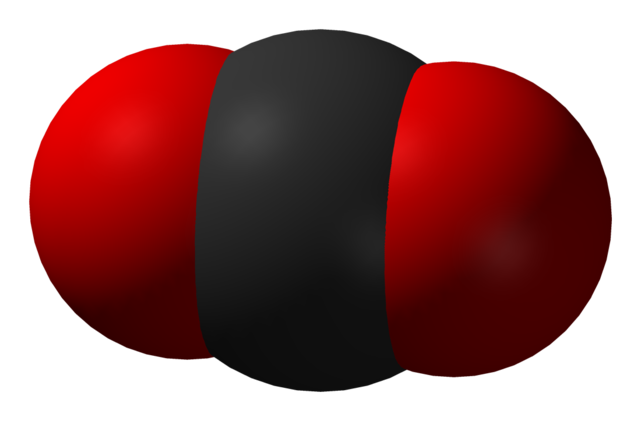
Det lineære molekylet er danna av to oksygenatom og eit karbonatom. Karbonatomet er i midten, og oksygenatoma er kovalent bundne til det.
Gassen vert danna under forbrenning, og som biprodukt ved produksjon av hydrogengass frå naturgass.
Karbondioksid vert rekna som ein drivhusgass. Han er ikkje giftig, men vil i store konsentrasjonar kunna fortrenga oksygen.
Jordatmosfæren inneheld om lag 0,03% karbondioksid, og store mengder av gassen er løyst i havet. Mykje av det karbondioksidet som vert sloppe ut i atmosfæren kjem før eller seinare til å hamna her.
I fotosyntesen omdannar plantar karbondioksid og vatn til oksygengass og glukose.
Noko av forbrenninga som dannar CO2 er celleanding, dvs at menneske og dyr pustar inn luft med oksygen og pustar ut m.a. CO2.
Menneskekroppen brukar CO2-nivå i blodet som styringsmål på kor mykje oksygen som blir tatt opp i blodet gjennom lungene.[1] Dermed kan for rask eller djup pusting til dømes ved hyperventilering føra til at blodet får lågt nivå av CO2, noko som blir tolka som at det er mykje oksygen i blodet. Dermed trekkjer blodårene mellom anna i hjernen seg saman, og det kjem mindre oksygen til hjernen. Ved ufrivillig hyperventilering kan det å pusta i ein papirpose hjelpa, sidan ein då aukar CO2-konsentrasjonen i blodet.[2] (NB: Problem med å pusta bør truleg sjekkast av lege!)
Det er mogleg at CO2 kan vera med og føra til dykkarsjuke.[3]
Karbondioksid spelar ei særskild rolle løyst i vatn sett i høve til mange andre gassar. I motsetnad til til dømes oksygen og nitrogen følgjer han ikkje Henrys lov, og finst oftast i langt større kvanta enn det som er å venta. Dette har å gjera med at CO2 opptrer i fleire ulike sambindingar enn berre rein gass.
Når ein løyser karbondioksid i vatn, vil ein særs liten del (oftast under 1%) reagera med vatnet og danna karbonsyre: . Noko av karbonsyra løyser seg vidare opp i bikarbonat og hydrogen-ion .
Dei frigjorte H+-iona fører til at pH-en søkk. Når HCO3- vidare løyser seg opp vert det frigjort ytterlegare eit ion.
I kor stor grad karbonsyra løyser seg opp er avhengig av pH-verdien i vatnet. Ved høge pH-verdiar er det nesten berre bikarbonat-ion til stades, medan det ved sure tilhøve er mest CO2 i gassform og noko H2CO3.
pH er særs viktig i akvatisk økologi, sidan dei fleste vassplantar berre kan bruka rein CO2 eller H2CO3 i fotosyntesen sin.

Karbondioksid vert brukt i brus.
Ein del brannsløkkingsapparat brukar karbondioksid.
Tørris er karbondioksid i fast form.
Superkritisk karbondioksid løyser koffein og vert nytta i produksjon av koffeinfri kaffi.
Det blir også forska på å bruka CO2-injeksjon for å pressa ut ekstra olje før det blir «tomt» på eit oljefelt, dvs når ein ikkje får pumpa opp meir med noverande teknologi.[4]
CO2 spelar ei sentral rolle for miljøet me har rundt oss.
Som nemnt over er det karbondioksid i jordatmosfæren. Det er ein relativt liten konsentrasjon, men karbondioksid er likevel viktig fordi det absorberer infraraud stråling. Dette forsterkar drivhuseffekten. Denne effekten gir ca 25° høgare gjennomsnittstemperatur, og gjer jorda leveleg for menneske.
CO2 er som nemnt ein drivhusgass, og såleis vil meir karbondioksid i atmosfæren føra til høgare temperatur. Utslepp frå menneske har auka sidan den industrielle revolusjonen, og er no på det høgaste nivået som nokon gong er målt.[5]
Bruk av fossilt brensel er ei av hovudkjeldene til utslepp av karbondioksid frå menneske. Dette blir brukt til mellom anna transport og varme, og kjem til dømes frå olje, bensin og kol.
Det siste hundreåret har den gjennomsnittlege temperaturen på jorda auka. Mange meiner at forureining frå menneske spelar ei sentral rolle i denne globale oppvarminga.[6]
Om lag halvparten av all CO2 som blir slept ut i atmosfæren blir lagra, i alle fall førebels, av økosystem i havet og på landjorda. Men økosystema på land har ein avgrensa og minkande kapasitet til å ta hand om CO2-overskot i atmosfæren.[7]
Av dei største landbaserte økosystema er regnskogane, som står for om lag 40 % av oksygenet i atmosfæren.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.