Top Qs
Tijdlijn
Chat
Perspectief
Polaire verbinding
Van Wikipedia, de vrije encyclopedie
Remove ads
Remove ads
Een polaire verbinding is een molecuul dat bestaat uit een chemische binding met een zodanige verdeling van de elektronen, dat het centrum van de negatieve ladingen niet samenvalt met dat van de positieve ladingen. Een polaire verbinding is het tegenovergestelde van een apolaire verbinding. Moleculen met zowel een polair als een apolair deel zijn amfifiel.

Om een polair molecuul te verkrijgen, zijn de volgende voorwaarden nodig:
- Een sterk elektronegatief element en een zwak elektronegatief element aan elkaar gebonden, zodat een ladingsverschil ontstaat. Zo zullen koolstof (C), helium en metaalsoorten niet polair zijn.
- Een asymmetrisch molecuul, want anders bestaan er wel positieve en negatieve ladingen, maar vallen de centra daarvan samen.

De mate waarin verbindingen polair zijn, wordt numeriek weergegeven in hun dipoolmoment.
Remove ads
Scheikundig gezien
Samenvatten
Perspectief
De polaire binding is, naast de covalente binding en de ionbinding, het derde type binding tussen atomen. In een covalente binding worden elektronen gelijkelijk verdeeld over de twee verbonden atomen; bij de ionogene binding zijn een of meer elektronen van het ene atoom op het andere overgedragen. Verdeelt een elektron zijn tijd niet netjes tussen de twee atomen (covalent) of zit het constant bij een van de twee atomen (ionogeen) dan wordt van een polaire binding gesproken. In theorie zijn er weinig stoffen die volledig als covalent of volledig ionogeen zijn. Afhankelijk van de elektronegativiteit van de deelnemende atomen aan de binding, brengt een elektron een groter of kleiner deel van zijn tijd bij een atoom door. Theoretisch zijn dus bijna alle bindingen polair. In de praktijk kunnen bindingen waarin de atomen maar een klein verschil in elektronegativiteit hebben, als covalent beschouwd worden. Heel grote verschillen in elektronegativiteit tussen deelnemende atomen leiden tot ionogene verbindingen.
Dit leidt tot de volgende vuistregel voor de elektronegativiteit:
- ionbinding: boven 1,66
- covalent: beneden 1,66
Binnen de groep covalenten kan men nog een indeling maken in:- apolair, bv. beneden of gelijk aan 0,4 (bv. de koolstof-waterstofbinding)
- polair, bv. boven 0,4 maar beneden 1,66
Let op: deze indeling is maar grof, in de praktijk zijn de overgangen geleidelijk.
Een binding wordt als polair beschouwd als twee atomen in een molecuul een verschil in elektronegativiteit hebben tussen 0,4 en 1,66. Zo vormen Cl (3,0) en H (2,1)[1], waar het verschil in elektronegativiteit dus 0,9 bedraagt, een polaire binding. Als dan ook nog eens de positieve en negatieve centra in het molecuul niet samenvallen, is er sprake van een dipoolmoment en dus dipoolverbindingen (deze staan in BINAS 55A/B). Als er sprake is van een nog grotere elektronegativiteit vormt zich een ionverbinding.
Een uitzondering op deze regel is het HF-molecuul, met elektronegativiteit 1,9. Bij dit molecuul is er nog steeds sprake van een polaire verbinding, ondanks dat de elektronegativiteit hoger is dan 1,66, en het vormt dus niet een ionbinding.
Een simpele vuistregel voor het vaststellen van polariteit bij een Lewisstructuur is:
Als er bij een lewisstructuur - waarop alle (partieel) positieve en negatieve ladingen staan aangegeven - een rechte (lijn) getrokken kan worden die alle positieve en negatieve ladingen scheidt, is het molecuul polair.
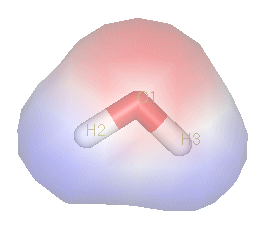
Een voorbeeld van de voorgaande regel is water, waarbij men gemakkelijk een lijn kan trekken tussen partieel positieve en partieel negatieve ladingen. Doordat de waterstofatomen niet op één lijn liggen met het zuurstofatoom, kan een lijn getrokken worden met aan de ene kant het zuurstofatoom en aan de andere kant de waterstofatomen. Bij CCl4 (hier rechts) kan men geen rechte lijn trekken tussen partieel positieve (centraal C-atoom) en partieel negatieve (de 4 chlooratomen).
HCCl3 is wel polair, hoewel in de getekende lewisstructuur geen rechte lijn getrokken kan worden tussen positieve en negatieve lading. Dat de vuistregel hier niet opgaat, hangt samen met het feit dat in de tekening een ruimtelijke structuur is platgeslagen in het vlak van tekening, en doordat in een ruimtelijke figuur niet een lijn, maar een plat vlak als scheiding tussen de positieve en negatieve ladingen wordt genomen.
Remove ads
Voorbeelden
Polaire verbindingen kunnen zijn:
- Zouten, bestaande uit positieve en negatieve ionen.
- Verbindingen met atomen van sterk uiteenlopende elektronegativiteit, bijvoorbeeld waterstofchloride (HCl) en water, waarbij deze atomen zo gesitueerd zijn, dat het zwaartepunt van de negatieve lading niet samenvalt met het zwaartepunt van de positieve lading.
- Water (H2O) is een zeer polaire verbinding, omdat de waterstofatomen niet recht tegenover elkaar aan het zuurstofatoom zitten. De verbinding vormt een hoek, wat resulteert in een groot dipoolmoment.
Remove ads
Eigenschappen
Over het algemeen kunnen polaire verbindingen goed gemengd worden met andere polaire verbindingen. Polaire verbindingen mengen niet goed met apolaire verbindingen. Dit kan worden verklaard doordat de polaire moleculen elkaar aantrekken ten gevolge van hun elektrische lading. De apolaire moleculen worden hierdoor verdrongen, zoals bij water (=polair) en olie (=apolair).
Dit heeft tot gevolg dat de meeste zouten goed oplossen in water. Zouten zijn immers opgebouwd uit geladen ionen.
Zie ook
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads