From Wikipedia, the free encyclopedia
नोबल ग्याँसहरू (ऐतिहासिक रूपमा निष्कृय ग्यासहरू, कहिलेकाहीँ एरोजेन्स भनेर चिनिन्छन् [1] ) पेरियोडिक तालिकाको समूह १८ का प्राकृतिक रूपमा पाइने सदस्यहरू हुन्: हिलियम (He), नियोन (Ne), आर्गन (Ar), क्रिप्टन (Ke)।, xenon (Xe), र radon (Rn)। साधारण अवस्थाहरूमा, यी तत्वहरू गन्धहीन, रंगहीन, धेरै कम रासायनिक प्रतिक्रियाशीलता र क्रायोजेनिक उम्लने बिन्दुहरू भएका मोनाटोमिक ग्यासहरू हुन्।





नोबल ग्याँसहरूको निष्कृयताले तिनीहरूलाई रासायनिक प्रतिकृया नचाहिने अवस्थामा उपयोगी बनाउँछ। उदाहरणका लागि, आर्गनलाई वेल्डिङमा सिल्डिङ ग्यास कवचको रूपमा र इन्यान्डेसेन्ट लाइट बल्बहरूमा फिलर ग्यासको रूपमा प्रयोग गरिन्छ। हिन्डनबर्ग दुर्घटनामा हाइड्रोजनको ज्वलनशीलताको कारणले गर्दा हुने जोखिमहरू स्पष्ट भएपछि, हाइड्रोजनलाई ब्लीम्प्स र बेलुनहरूमा हेलियमले प्रतिस्थापित गरियो। हेलियम र नियोनको पनि कम उम्लने तापक्रम को कारणले रेफ्रिजेरेन्टको रूपमा प्रयोग गरिन्छ। रेडन बाहेक नोबल ग्याँसहरूको औद्योगिक मात्रा, ग्यासहरूको तरलता र आंशिक आसवनको विधिहरू प्रयोग गरेर हावाबाट अलग गरेर प्राप्त गरिन्छ। हेलियम पनि प्राकृतिक ग्याँस को खनन प्रकृयाको एक उप-उत्पाद हो। रेडोन सामान्यतया विघटित रेडियम, थोरियम, वा यूरेनियम यौगिकहरूको रेडियोधर्मी क्षयबाट अलग गरिन्छ।
नोबल ग्याँस जर्मन शब्द Edelgas बाट अनुवाद गरिएको हो , पहिलो पटक १९०० मा Hugo Erdmann द्वारा यी ग्यासहरूको प्रतिक्रियाको अत्यन्त कम स्तर संकेत गर्न प्रयोग गरिएको थियो [2] । यो नामले " नोबल धातुहरू " शब्दसँग समानता दिन्छ, जसको पनि प्रतिकृयाको स्तर अत्यन्त कम छ। नोबल ग्याँसलाई निष्क्रिय ग्यास पनि भनिन्छ, तर धेरै नोबल ग्याँस यौगिकहरू अहिले पहिचान भएकाले यो लेबललाई हटाइएको छ। [3] दुर्लभ ग्यासहरू अर्को शब्द हो जुन प्रयोग गरिएको थियो, [4] तर यो पनि गलत छ किनभने आर्गन रेडियोधर्मी पोटासियम-४० को क्षयको कारण बन्ने भएकाले पृथ्वीको वायुमण्डलमा पर्याप्त मात्रामा (०.९४% मात्रामा, द्रव्यमान हिसाबले १.३%) छ। [5]
| Property[6][7] | हिलियम | नियोन | आर्गन | क्रिप्टन | Xenon | Radon | Oganesson |
|---|---|---|---|---|---|---|---|
| घनत्व (g/dm<sup id="mw-g">3</sup>) | 0.1786 | 0.9002 | 1.7818 | 3.708 | 5.851 | 9.97 | 7200 (predicted)[8] |
| Boiling point (K) | 4.4 | 27.3 | 87.4 | 121.5 | 166.6 | 211.5 | 450±10 (predicted)[8] |
| Melting point (K) | – | 24.7 | 83.6 | 115.8 | 161.7 | 202.2 | 325±15 (predicted)[8] |
| Enthalpy of vaporization (kJ/mol) | 0.08 | 1.74 | 6.52 | 9.05 | 12.65 | 18.1 | – |
| Solubility in water at 20 °C (cm3/kg) | 8.61 | 10.5 | 33.6 | 59.4 | 108.1 | 230 | – |
| परमाणु क्रमाङ्क | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
| Atomic radius (calculated) (pm) | 31 | 38 | 71 | 88 | 108 | 120 | – |
| Ionization energy (kJ/mol) | 2372 | 2080 | 1520 | 1351 | 1170 | 1037 | 839 (predicted)[9] |
| Electronegativity[10] | 4.16 | 4.79 | 3.24 | 2.97 | 2.58 | 2.60 | 2.59[11] |

नोबल ग्याँसहरू मानक अवस्थामा रंगहीन, गन्धहीन, स्वादहीन र अज्वलनशील हुन्छन्। [12] तिनीहरू एक पटक समूह लेबल गरिएको थियो आवधिक तालिकामा ० किनभने यो विश्वास गरिएको थियो कि तिनीहरूसँग शून्यको भ्यालेन्स छ, जसको अर्थ तिनीहरूको परमाणुहरू अन्य तत्वहरूसँग मिलाएर यौगिकहरू बनाउन सक्दैनन्। यद्यपि, पछि केही यौगिकहरू बनाउने कुरा पत्ता लाग्यो। [6]
अन्य समूहहरू जस्तै, यस समुहका सदस्यहरूले यसको इलेक्ट्रोन कन्फिगरेसनमा ढाँचाहरू देखाउँछन्। बाहिरी अर्बिट इलेक्ट्रोन को संख्याले रासायनिक व्यवहार प्रवृतिहरू निम्त्याउँछ:
नोबल ग्याँसको पूर्ण भ्यालेन्स इलेक्ट्रोन शेल हुन्छ। भ्यालेन्स इलेक्ट्रोनहरू परमाणुको सबैभन्दा बाहिरी इलेक्ट्रोनहरू हुन् र सामान्यतया रासायनिक प्रतिकृयामा भाग लिने इलेक्ट्रोनहरू मात्र हुन्। पूर्ण भ्यालेन्स इलेक्ट्रोन शेल भएका परमाणुहरू अत्यन्तै स्थिर हुन्छन् र त्यसैले रासायनिक प्रतिकृयामा सहभागी हुँदैन र इलेक्ट्रोनहरू प्राप्त गर्ने वा गुमाउने प्रवृत्ति निकै कम हुन्छ। [13] यद्यपि, राडोन जस्ता भारी नोबल ग्याँसहरू हेलियम जस्ता हल्का नोबल ग्याँसहरू भन्दा इलेक्ट्रोम्याग्नेटिक बल कम हुन्छ, यसले भारी नोबल ग्याँसहरूमा बाहिरी इलेक्ट्रोन हटाउन सजिलो हुन्छ।
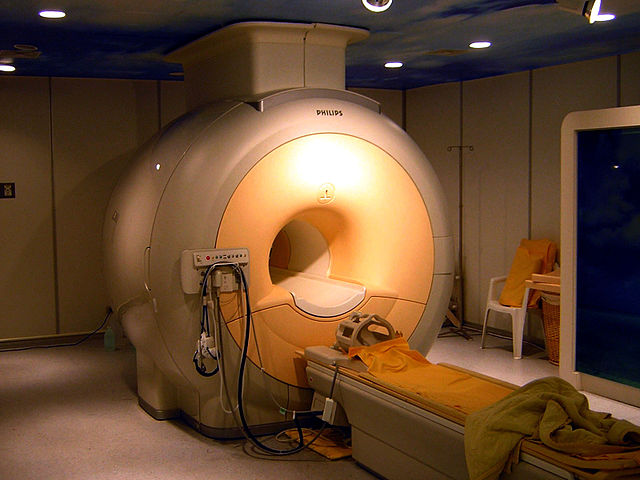
नोबल ग्याँसको उम्लने र पग्लने बिन्दु धेरै कम हुन्छ, त्यसकारण तिनीहरू क्रायोजेनिक रेफ्रिजेरेन्टको रूपमा उपयोगी हुन्छन्। [14] विशेष गरी, तरल हीलियम, जुन ४.२ के (−२६८.९५ °से; −४५२.११ °फे) मा उम्लन्छ, सुपरकन्डक्टिङ चुम्बकहरूका लागि प्रयोग गरिन्छ, जुन आणविक चुम्बकीय अनुनाद इमेजिङ र आणविक चुम्बकीय अनुनादमा आवश्यक हुन्छ। [15] तरल नियोन पनि क्रायोजेनिक्समा प्रयोग हुन्छ, यद्यपि यो तरल हीलियम जत्तिकै कम तापक्रममा पुग्दैन, तैपनी यसमा ।तरल हीलियम भन्दा ४० गुणा बढी र तरल हाइड्रोजन भन्दा तीन गुणा बढी फ्रिज क्षमता हुन्छ। [16]
Noble gases are commonly used in lighting because of their lack of chemical reactivity. Argon, mixed with nitrogen, is used as a filler gas for incandescent light bulbs.[16] Krypton is used in high-performance light bulbs, which have higher color temperatures and greater efficiency, because it reduces the rate of evaporation of the filament more than argon; halogen lamps, in particular, use krypton mixed with small amounts of compounds of iodine or bromine.[16] The noble gases glow in distinctive colors when used inside gas-discharge lamps, such as "neon lights". These lights are called after neon but often contain other gases and phosphors, which add various hues to the orange-red color of neon. Xenon is commonly used in xenon arc lamps, which, due to their nearly continuous spectrum that resembles daylight, find application in film projectors and as automobile headlamps.[16]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.