水素化アルミニウムリチウム
ウィキペディアから
水素化アルミニウムリチウム(すいそかアルミニウムリチウム、lithium aluminium hydride)は、組成式 LiAlH4で表されるアルミニウムのヒドリド錯体で無機化合物の一種であり、ケトン、アルデヒド、アミド、エステルなどの還元に用いられる。粉末状の強い還元剤であり、水と激しく反応し水素を発生するため、使用する際はジエチルエーテルなどの脱水溶媒を用いる必要がある。LAH(ラー)という略称がよく用いられる。
| 水素化アルミニウムリチウム | |
|---|---|
 | |
 | |
リチウムアルミニウムヒドリド | |
別称 LAH 水素化アルミニウムリチウム 水素化リチウムアルミニウム テトラヒドリドアルミン酸リチウム | |
| 識別情報 | |
| CAS登録番号 | 16853-85-3 |
| RTECS番号 | BD0100000 |
| 特性 | |
| 化学式 | LiAlH4 |
| モル質量 | 37.954 g/mol |
| 外観 | 白色結晶(純粋) 灰色粉末(市販品) |
| 密度 | 0.917 g/cm3, 固体 |
| 融点 |
150 °C, 423 K, 302 °F (分解) |
| 水への溶解度 | 水と反応 |
| 構造 | |
| 結晶構造 | 単斜晶 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−116.3 kJ mol-1 |
| 標準モルエントロピー S |
78.74 J mol-1K-1 |
| 標準定圧モル比熱, Cp |
83.18 J mol-1K-1 |
| 危険性 | |
| 主な危険性 | 強い可燃性 (F) |
| NFPA 704 | |
| R/Sフレーズ | R15 R7/8 R24/25 R43 |
| 関連する物質 | |
| 関連する水素化物 | 水素化アルミニウム 水素化ホウ素ナトリウム 水素化ナトリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
反応性
要約
視点
LAHは非常に強力な還元剤である。水素化ホウ素ナトリウム(NaBH4)も還元剤として知られているが、LAHの方がはるかに強力である。これは、Al-H結合が、B-H結合に比べて弱いためである。LAHは、エステルやケトン、アルデヒドをアルコールへ、アミド、ニトリル、ニトロ化合物をアミンへと還元する。ジエチルエーテルから再結晶した純粋なLAHは白色固体であるが、市販品はアルミニウムの混入により灰色をしていることが多い。空気に晒されても白色を保っているものは、水蒸気と反応した結果生成した水酸化リチウムと水酸化アルミニウムが表面を覆っていると考えられる。
LAHはその塩基性の強さから、アルコールのようなプロトン性溶媒や水と激しく反応して以下のように分解される[1]。
調製
LAHは水素化リチウム (LiH) と塩化アルミニウム (AlCl3) を用いて合成される。
この反応は 97%(重量)という高い収率で進行する。反応混合物をエーテルに溶解させた後に、固体として残る塩化リチウム (LiCl) をろ過で除去する。
構造
固体はリチウムイオン (Li+) と水素化アルミニウムイオン (AlH4−) からなるイオン結晶で、単斜晶系に属する。AlH4− は四面体型構造で、結晶中の Al−H 平均結合距離は 1.55 Åである。
無機反応
要約
視点
LAH と水素化ナトリウムは THF 中の複分解により水素化アルミニウムナトリウム (NaAlH4) を生成する(収率 90.7%(重量))。
同じようにして水素化アルミニウムカリウム (KAlH4) も合成できる(収率 90%(重量))
水素化アルミニウムナトリウム (NaAlH4)、水素化アルミニウムカリウム (KAlH4) からは塩化リチウムを用いた逆反応も進行する。溶媒にはジエチルエーテルもしくは THF を用い、収率はそれぞれ 93.5%(重量)、91%(重量)となる。
水素化アルミニウムマグネシウム (Mg(AlH4)2) は LAH と臭化マグネシウム (MgBr2) から合成される。
有機化学での利用

LAH は有機化学において非常に強力な還元剤として広く利用されている。反応性が高いため大量の LAH を扱うには問題があるが、それにもかかわらず小規模な化学工業にも用いられている。しかし大規模な化学工業上の反応では水素化ビス(2-メトキシエトキシ)アルミニウムナトリウムが利用されることが多い。反応にはジエチルエーテルが良く用いられ、反応後に水洗されることが多いが、これは還元反応後に生成する無機副生成物を除去するためである。
LAH について広く知られている反応はエステルやカルボン酸を1級アルコールへと還元する反応である。LAH が開発される以前の反応は、金属ナトリウムをエタノール中に加え加熱するという非常に厳しい条件での反応であった(ブーボー・ブラン還元)。LAH でアルデヒドやケトンもアルコールへと還元することができるが、より穏やかな試薬である水素化ホウ素ナトリウム等が用いられることも多い。α,β-不飽和ケトンはアリルアルコールへと還元される。エポキシドを還元する際には、LAH が立体障害が少ない方のエポキシド末端を攻撃するため、通常2級もしくは3級アルコールが生成する。
アミドやオキシム、ニトリル、ニトロ化合物、アルキルアジドを還元するとアミンが得られる。また、ハロゲン化合物を脱ハロゲン化しアルカンへと還元することができる。
LAHは、単純なアルケンやベンゼン環を還元することはできないが、近傍に酸素官能基を有するアルキンをアルケンに還元できる。
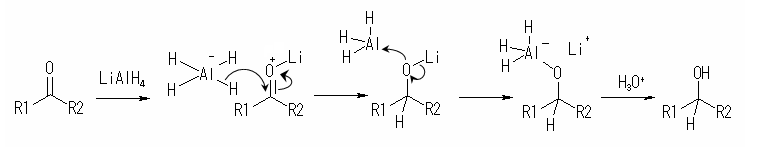
反応機構
AlH4− が分解すると同時に、誘起効果もしくはメソメリー効果により低い電子密度を持っている有機化合物の活性中心をヒドリドイオンが攻撃する。
危険性
LAH は水と激しく反応し、時には空気中の水蒸気とも反応する。このため反応にはよく脱水した溶媒を用いる必要がある。純粋なものは発火性を持ち、特に静電気などの影響で着火して、溶媒のジエチルエーテルに引火する事故が多い。また発火した場合は水や二酸化炭素消火器ではなく、粉末式の消火器を用いて消火する。
またトリフルオロアセチル基を持った化合物をLAHで還元しようとすると爆発性の錯体を形成し、スケールによっては激しい爆発を起こすことがある。
日本では、消防法で定める第3類危険物(金属の水素化物)に該当する。
近年はタブレットやTHF溶液など、安全に使用できる製品が市販されており、LAHの工業的に大量使用できるようになっている[2]。
熱分解
要約
視点
室温では LAH は準安定である。長期間保存しておくと徐々に八面体型六配位のヘキサヒドリドアルミン酸イオンを含む Li3AlH6 と LiH に分解する。この分解はチタン、鉄、バナジウムなどの触媒存在下で加速する。
LAHの加熱分解には3つの反応機構が関係している。
1 の反応は LAH を 150–170 ℃ に加熱融解すると、即座に固体の Li3AlH6 が生成するというものである。200–250 ℃で Li3AlH6 は LiH へと分解し (2)、400 ℃ 以上になると続いて LiAl となる。LiAlH 4は準安定物質であるため、1 は事実上不可逆反応である。2 の可逆性については未だ結論が出ていない。3 については 500 ℃、0.25 bar の条件下で平衡となる。1 と 2 については触媒が存在すれば室温でも反応が進行する。
溶解度
LAH は様々なエーテル系溶媒に可溶である。触媒となりうる不純物の存在下では自発的に分解してしまうが、THF 中ではその安定性が増していると考えられている。このため THF はジエチルエーテルよりも溶解度が低いにもかかわらず好んで用いられる。
注意: LiAlH4 を用いる反応の溶媒に水を用いてはならない。水と LAH は激しく反応してしまう。
反応後の処理
LAHは前述のように高い反応性を持つので、反応終了後の処理の際には慎重に分解を行う必要がある。また処理の仕方によってはアルミニウムを含む不溶性の沈殿が大量に生成し、ここに目的物が吸着されると収率を低下させる要因になる。これを防ぐためいくつかの処方が知られている。
- X gの LAH で還元を行った反応液に、X mLの水、X mLの15%水酸化ナトリウム水溶液、3X mLの水を順次ゆっくりと滴下し、しばらく室温で攪拌する。灰色の沈殿ができたらセライトなどを用いて吸引濾過し、少なくとも50X mL以上の溶媒で洗う。溶媒を留去し、目的物を得る。
- 芒硝(硫酸ナトリウム十水和物)を大量に加え、含まれる水分によってLAHを分解する。酢酸エチルを加えてさらさらになるまで撹拌し、不溶物をセライトなどを用いて濾過、溶媒を留去する。
- ロッシェル塩(酒石酸カリウムナトリウム)飽和水溶液を低温でゆっくりと加え、30分ほど撹拌するとアルミニウム塩が酒石酸とキレート錯体を形成し、溶解する。これを分液処理する。
- 0 °Cに冷却した上で飽和塩化アンモニウム水溶液を加えて反応を停止させる。この灰色のエマルジョンにトリエチルアミン/メタノール/酢酸エチル3:10:87の混液(反応溶媒のTHFに対して2.5倍量)を加え、セライトなどを用いて濾過する。濾液を通常通り分液処理し、目的物を得る。
脚注
参考文献
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.












