小胞融合
ウィキペディアから
小胞融合(しょうほうゆうごう、英: vesicle fusion)とは、小胞が他の小胞や細胞膜と合体することである。分泌小胞からの分泌の最終段階は小胞と細胞膜の融合であり、エキソサイトーシスによって分泌小胞の内容物が細胞外へ排出される。小胞はリソソームなど、他の細胞区画とも融合することができる。
エキソサイトーシスは、分泌小胞が細胞膜のポロソームと呼ばれるお椀型の構造に一過的なドッキングと融合を行った際に生じる。小胞融合は、細胞内のカルシウム(Ca2+)濃度が上昇した状況下でのSNAREタンパク質の作用に依存している可能性がある。
トリガー
さまざまな刺激が細胞内のCa2+濃度を高めることで小胞融合を引き起こす。
- シナプスに到達した神経インパルスは電位依存性カルシウムチャネルを活性化し、細胞内へのCa2+の流入を引き起こすことで、シナプス小胞の融合過程を開始する。
- 内分泌系において多くのホルモンは、各ホルモンに対応する放出ホルモンがGq αサブユニットと共役したGタンパク質共役受容体に結合し、IP3/DAG経路が活性化されてCa2+濃度が上昇することで放出が開始される。この機構の例としては次のようなものがある。
- 性腺刺激ホルモン放出ホルモン[1]
- 甲状腺刺激ホルモン放出ホルモン[1]
- 成長ホルモン放出ホルモン[1] (副経路、主経路はcAMP依存性経路である[2])
モデルシステム
単一のリン脂質または混合物からなるモデルシステムを用いて融合過程の研究がなされており、より小さな超分子の凝集のための核生成や、生体膜構造の相変化などによるこの過程の説明が試みられている[3][4]。
機構
要約
視点
シナプス間隙での融合
シナプス小胞の融合過程が開始されるには、小胞は標的膜から数ナノメートル以内に位置しなければならない。両者の膜が十分に近接することで、特定のタンパク質による接合部からの水の除去と、細胞膜と小胞の間での脂質の交換が可能となる。適切な位置に来た小胞は、シナプス前膜に活動電位が伝達され、Ca2+が細胞内に流入するのを待つ[5]。Ca2+は神経細胞内のシナプトタグミンなどの特定のタンパク質と結合し、小胞と標的膜との完全な融合を引き起こす[6]。
SNAREタンパク質は、どの膜がどの小胞の標的となるかを媒介する役割も果たしていると考えられている[7]。
SNAREタンパク質と細孔の形成
→詳細は「SNAREタンパク質」を参照
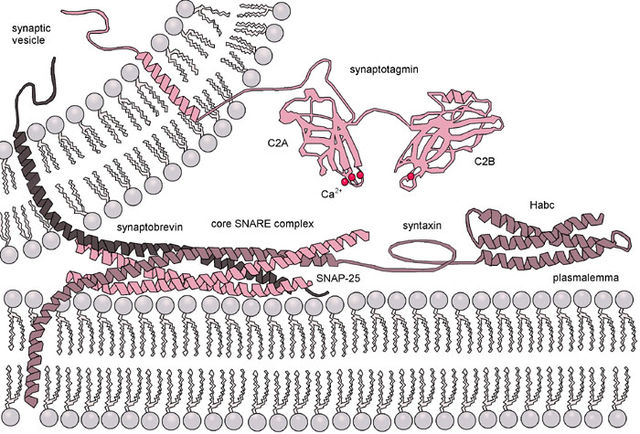
小胞と細胞膜上にそれぞれ位置するSNAREタンパク質が「トランス」複合体へと組み立てられると、複合体は向き合った細胞膜と分泌小胞の2つの脂質二重層のブリッジとなり、両者を近接させて融合を誘導する。細胞内へのカルシウムの流入が組み立て反応の完結の引き金を引く。この過程はカルシウムセンサーと推測されるシナプトタグミンと、膜脂質または部分的に組み立てられたSNARE複合体との相互作用によって媒介される。
ある仮説では、SNARE複合体内のコンプレキシンがシナプトタグミンと相互作用することが示唆されている[9]。「クランプ」仮説では、コンプレキシンは通常は小胞の細胞膜への融合を阻害しているとされる。しかし、Ca2+イオンがシナプトタグミンに結合すると、コンプレキシンが放出されるか不活性化され、小胞は融合できるようになる[10]。
「ジッパー」仮説では、複合体の組み立てはSNAREモチーフのN末端部分から開始され、タンパク質が膜に固定されているC末端側へ向かって進行するとされる。「トランス」SNARE複合体の形成過程では、SNAP-25とシンタキシン1からなる中間複合体がまず形成され、その後にシナプトブレビン2が加わる(神経細胞での神経伝達物質の放出の場合)。
融合の結果形成される「シス」SNARE複合体の安定性からは、組み立て過程で放出されるエネルギーが膜間の反発力を乗り越える手段となっていることが予測されている。ストークや融合細孔(fusion pore)の形成など、膜融合のその後の段階にはいくつかのモデルが提唱されているが、正確な機構にはいまだ議論がある。融合細孔の形成のモデルに関しては、脂質で裏打ちされた融合細孔(lipid-lined fusion pore)とタンパク質で裏打ちされた融合細孔(protein-lined fusion pore)という2つの主要な仮説が存在する[11]。
脂質で裏打ちされた融合細孔

融合細孔の形成機構として可能なモデルの1つは、脂質で裏打ちされた融合細孔の形成である。このモデルでは、SNARE複合体の「ジッパー」機構によって膜が十分に近接すると、膜融合は自発的に生じるとされる。2つの膜が臨界距離内に近づけられると、一方の膜の脂質の親水的な頭部が向き合った膜に挿入される現象が生じることが示されている[12]。このモデルでは、SNARE複合体は足場として双方の膜を臨界距離内に双方の膜を引きつける機能を果たすとされる。2つの膜の融合が開始されると脂質で裏打ちされたストークが形成され、融合の進行とともに外側へ広がってゆく。
脂質で裏打ちされた細孔は形成可能であり、初期細孔形成で観察されているのと同じ特性を得ることができるが、これが唯一の方法であることを証明するだけの十分なデータは存在しない[13]。今のところ、脂質で裏打ちされた細孔の変動を細胞間で調節する機構は提唱されておらず、タンパク質で裏打ちされた細孔と比較して、"kiss-and-run"のような効果を生み出すのはかなり困難であると考えらえる。また、脂質で裏打ちされた細孔の形成効率は双方の膜の組成に大きく依存ており、その成否は弾性や剛性の変化によって大きく変動すると考えられる[13]。
タンパク質で裏打ちされた融合細孔
融合細孔の形成機構として可能な他のモデルは、タンパク質で裏打ちされた融合細孔の形成である。このモデルでは、カルシウムによるシナプトタグミンの活性化の後、いくつかのSNARE複合体が集合してリング構造を形成し、シナプトブレビンが小胞膜に、シンタキシンが細胞膜にそれぞれ細孔を形成する[14]。初期細孔が拡大するにつれて双方の脂質二重層から脂質が取り込まれ、最終的に2つの膜は完全に融合する。このモデルではSNARE複合体はより活発な役割を果たす。初期細孔は完全にSNARE複合体によって構成されているため、細孔を細胞間で調節することは容易であり、"kiss-and-run"機構をより容易に達成することができる[9]。
タンパク質で裏打ちされた細孔の形成は初期細孔形成で観察されている条件をすべて満たすが、一部のデータはこの仮説を支持しておらず[14]、これが主要な方法であることを示すだけの十分なデータは存在しない。タンパク質で裏打ちされた細孔の形成には少なくとも5コピーのSNARE複合体が必要であるが、融合はわずか2コピーでも観察されている[14]。
どちらの仮説ではSNARE複合体の機能には大きな差異はなく、融合の開始にはSNARE複合体全体が必要である。しかしながらin vitroでは、v-SNARE(小胞側に存在するSNAREタンパク質)を含むシナプス小胞とのCa2+非依存的な自発的な融合を駆動するには、シンタキシンだけで十分であることが示されている[15]。このことは、神経細胞でのCa2+依存的なエキソサイトーシスにおいてシナプトタグミンは、Ca2+イオンの非存在下ではSNAREのダイナミクスを阻害し、Ca2+イオンの存在下では膜融合過程のアゴニストとして作用する、二重の調節因子であることを示唆している。
Kiss-and-run
シナプス小胞がシナプス間隙に神経伝達物質を放出する際、小胞がシナプス前膜と完全には融合しない場合があることを一部の神経科学者は示唆している。神経伝達物質の放出後の小胞の再形成の際にエンドサイトーシスが常に起こるかどうかに関しては議論がある。小胞の内容物を細胞外液へ放出する際の完全な膜融合以外の機構として、"kiss-and-run"と呼ばれる機構が提唱されている。
この機構では、小胞はシナプス前膜に小さな孔を形成するだけであり、内容物が標準的な拡散過程によってしばらく放出された後、シナプス前細胞の中へ戻っていくことが示唆されている。この機構は、クラスリンを介したエンドサイトーシスを回避する方法であると考えられる。また、小胞の再充填の際にエンドソームへ戻る必要がないことも提唱されているが、どのような機構で再充填が行われているのかは十分に理解されていない。この機構は、小胞の完全な膜融合過程を排除するものではなく、シナプス間隙で両方の機構が動作している可能性があることを述べているに過ぎない。また、"kiss-and-run"は内分泌細胞で起こることが示されているが、シナプス間隙で直接観察されているわけではない[16]。
出典
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.