トップQs
タイムライン
チャット
視点
リボ核酸
核酸の一種 ウィキペディアから
Remove ads
リボ核酸(リボかくさん、英: ribonucleic acid、RNA)は、非コードRNAとして細胞機能に直接関与するほか、メッセンジャーRNA(mRNA)のようにタンパク質合成の鋳型としても働く、生命に不可欠な高分子である。
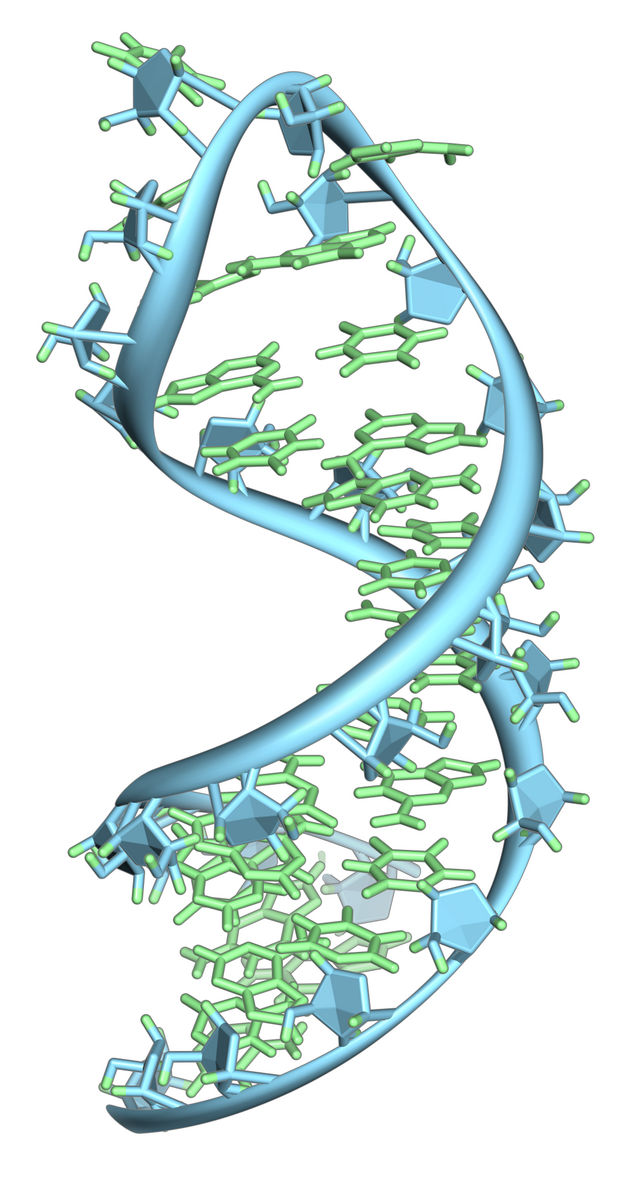
RNAは、デオキシリボ核酸(DNA)と同様に核酸に分類され、すべての既知の生命にとって必要な4種類の主要高分子の一つである。RNAは、ヌクレオチドと呼ばれる単位が鎖状に連なって構成される。細胞生物では mRNAを用いて、アデニン(A)、ウラシル(U)、シトシン(C)、グアニン(G)の4種の核酸塩基で記された遺伝情報を伝達し、それに基づいて特定のタンパク質を合成する。また多くのウイルスは、RNAを遺伝物質(ゲノム)として用い、生物自身の遺伝情報を保持している。
一部のRNA分子は、生物学的反応の触媒作用を担ったり、遺伝子発現を調節したり、細胞内シグナルを感知して応答を促したりするなど、能動的な機能を果たしている。なかでもタンパク質合成はRNAの代表的な機能で、すべての生命に共通する普遍的な仕組みである。リボソーム上では、トランスファーRNA(tRNA、転移RNA)がアミノ酸を運び、リボソームRNA(rRNA)がそれらをつなぎ合わせることで、遺伝情報に基づくタンパク質が形成される。
さらに、地球上の生命の進化初期には、DNAやタンパク質酵素が進化する以前に、「RNAワールド」と呼ばれる時代が存在したとする仮説が、科学界で広く支持されている[1]。この仮説によれば、当時のRNAは、今日のDNAのように遺伝情報を保存し、また現在のタンパク質酵素のように、細胞内で触媒作用も果たしていた可能性がある。
Remove ads
構造と物理特性
要約
視点
→詳細は「核酸構造」を参照
化学構造

RNAを構成する各ヌクレオチドは、1'から5'まで番号が付けられた炭素原子を持つリボース糖を含んでいる。1'位には、一般にアデニン(A)、シトシン(C)、グアニン(G)、またはウラシル(U)の塩基が結合する。アデニンとグアニンはプリン塩基、シトシンとウラシルはピリミジン塩基に分類される。リン酸基は、あるリボースの3'位と次のリボースの5'位に結合しており、各リン酸基は負の電荷を持つため、RNAはポリアニオンとして通常、負電荷を帯びる。塩基間は、シトシンとグアニン、およびアデニンとウラシルの間に標準的な水素結合が形成される。一方で、グアニンとウラシルは非標準的なG-Uゆらぎ塩基対として結合することもある[2]。しかし、複数のアデニン塩基が互いに結合して隆起部(バルジ)を形成したり[3]、グアニンとアデニンが塩基対を形成するGNRAテトラループのような他の相互作用も観察されている[2]。
DNAとの主要な違い

RNAの化学構造はDNAとよく似ているが、次の3点において重要な違いがある。
- 二本鎖DNAとは異なり、RNAは通常は一本鎖分子(ssRNA)[4]として機能し、DNAよりも短いヌクレオチド鎖から構成されている[5]。ただし、RNAは二本鎖RNA(dsRNA)を形成することがあり、また、tRNAのように1本のRNA分子が自己相補的な塩基対を持って、鎖内二重らせん構造をとることもある。
- DNAの骨格にはデオキシリボースが含まれるが、RNAではリボースが用いられる[6]。リボースは2'位にヒドロキシ基を持つ一方で、デオキシリボースにはこの基がない。このヒドロキシ基は、RNA加水分解の活性化エネルギーを低下させるため、RNAはDNAよりも化学的に不安定である。
生物活性をもつRNAの多く(mRNA、tRNA、rRNA、snRNA、その他の非コードRNA)は、自己相補的な配列を含んでおり、その一部が折りたたまれて二重らせん構造を形成する[8]。このようなRNAの構造は高度に組織化されており、DNAのような長い二重らせんではなく、短いらせんが集合した、タンパク質に類似した立体構造を持つ。
この構造的特徴により、RNAは酵素のように化学反応を触媒する能力を持つ場合がある[9]。たとえば、タンパク質の合成を触媒するRNA-タンパク質複合体 (en:英語版) であるリボソームの構造解析によって、その活性部位が完全にRNAで構成されていることが明らかになった[10]。

RNAとDNAを構造的に区別する重要な要素は、リボースの2'位にヒドロキシ基が存在することである。この官能基の存在により、RNAのらせんは主にA型構造をとるが[11]、一本鎖ジヌクレオチド鎖の場合、DNAで最も一般的なB型構造をとることも稀にある[12]。A型構造は、非常に深く狭い主溝と、浅く広い副溝を特徴とする[13]。さらに、2'位のヒドロキシ基は、RNA分子の二重らせんを形成していない柔軟な領域において、隣接するホスホジエステル結合を化学的に攻撃し、RNAの主鎖を切断する可能性がある[14]。
二次構造・三次構造
一本鎖RNA分子が機能を発揮するには、タンパク質と同様に特定の空間的な三次構造をとる必要があることが多い。こうした構造の骨格は、分子内の水素結合によって作られる二次構造要素によって支えられている。これにより、ヘアピンループ、バルジ、内部ループなど、特徴的な構造の「ドメイン」が形成される[15]。
特定の二次構造を持つRNAを設計するには、2~3種類の塩基では不十分であるが、4塩基あれば十分である[16]。このことは、自然界がRNAの構成要素として4種類の塩基を「選択」した理由の一つであると考えられる。4塩基では全ての構造を実現でき、5塩基以上は必要ではない。
RNAは帯電しているため、多くの二次・三次構造を安定化させるには、Mg2+などの金属イオンが必要となる[17]。
RNAの天然のエナンチオマーは、D-リボヌクレオチドからなるD-RNAであり、すべてのキラル中心はD-リボース上に存在する。L-リボース、またはL-リボヌクレオチドを用いることで、L-RNAを合成することができる。L-RNAはリボヌクレアーゼ(RNase)による分解に対して著しく安定である[18]。
タンパク質などの他の構造化された生体高分子と同様に、折りたたまれたRNA分子のトポロジーを定義することができる。これは、RNA分子内の鎖内接触の配置に基づく回路トポロジーとして記述されることが多い。
Remove ads
RNAの種類と機能
要約
視点
→「RNAの一覧」も参照
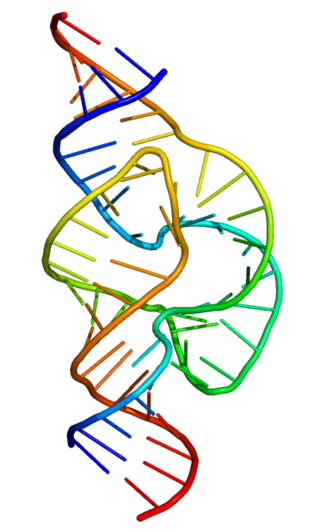
メッセンジャーRNA(mRNA)は、DNAから細胞質内のリボソームへと遺伝情報を運ぶRNAの一種である。リボソームはタンパク質合成(翻訳)の場である。mRNAのコード領域は、合成されるタンパク質のアミノ酸配列を決定する[19]。一方で、多くのRNAはタンパク質をコードしない(真核生物では、転写産物の約97%は非タンパク質コードRNAである[20][21][22][23])。
このような非コードRNA(ncRNA)は、タンパク質をコードしないRNA遺伝子から転写される場合もあれば、mRNAのイントロンから生じる場合もある[24]。非コードRNAの代表的な例には、翻訳に関与するトランスファーRNA(転移RNA、tRNA)およびリボソームRNA(rRNA)がある[7]。その他にも、遺伝子調節やRNAプロセシング、その他の機能に関与する非コードRNAが存在する。一部のRNAは、他のRNA分子の切断や結合[25]、リボソームでのペプチド結合形成といった化学反応を触媒する能力を持ち[10]、これらはリボザイム(ribozyme)と呼ばれる。
RNAはその鎖の長さに基づき、低分子RNA(small RNA)と長鎖RNA(long RNA)に分類される[26]。一般に、低分子RNAは長さが200塩基未満であり、長鎖RNAは200塩基を超える[27]。長鎖RNA(または高分子RNA、large RNA)には、主に長鎖非コードRNA(long non-coding RNA、lncRNA)とmRNAが含まれる。低分子RNAには、主に5.8S リボソームRNA(rRNA)、5S rRNA、トランスファーRNA(tRNA)、マイクロRNA(miRNA)、低分子干渉RNA(siRNA)、核小体低分子RNA(snoRNA)、Piwi相互作用RNA(piRNA)、tRNA由来低分子RNA(tsRNA)[28]、小rDNA由来RNA(srRNA)[29]などが含まれる。ただし、古細菌ハロコックス属(Halococcus)に見られる 5S rRNAのように、配列挿入によって例外的にサイズが増加するものもある[30][31][32]。
タンパク質合成に関与するRNA
メッセンジャーRNA(mRNA)
→詳細は「mRNA」を参照
メッセンジャーRNA(mRNA)は、タンパク質のアミノ酸配列に関する情報をリボソームに伝える。mRNAは、3連のヌクレオチド(コドン)ごとに1つのアミノ酸に対応するようにコード化されている。真核細胞では、DNAから転写されたmRNA前駆体(pre-mRNA)は、成熟mRNAにプロセシング(加工)され、イントロン(非コード領域)が除去される。その後、mRNAは核から細胞質へ輸送され、リボソームに結合して、tRNAの助けも借りながら対応するタンパク質へと翻訳される。原核細胞の場合は、核と細胞質という区画が存在しないため、mRNAはDNAからの転写される過程でリボソームに結合できる。一定時間が経過すると、mRNAはリボヌクレアーゼによってヌクレオチドに分解される[19]。
トランスファーRNA(tRNA)
→詳細は「tRNA」を参照
トランスファーRNA(tRNA)は、約80個のヌクレオチドからなる低分子RNA鎖であり、翻訳中にリボソームのタンパク質合成部位で成長中のポリペプチド鎖へ特定のアミノ酸を輸送する。tRNAはアミノ酸結合部位およびアンチコドン領域を持ち、アンチコドンはmRNA鎖の対応するコドンと水素結合によって相互作用する[24]。tRNAに結合したアミノ酸は、リボソームの触媒作用によってポリペプチド鎖に付加され、タンパク質が合成される。
リボソームRNA(rRNA)
→詳細は「rRNA」を参照

リボソームRNA(rRNA)はリボソームの触媒活性を担う構成要素で、翻訳の場となる。真核生物のリボソームには、18S、5.8S、28S、5Sの4種類のrRNA分子が含まれる。このうち3種は核小体で合成され、1種は別の核質で合成される。細胞質では、rRNAとタンパク質が結合して、核タンパク質であるリボソームを形成する。リボソームはmRNAと結合してタンパク質合成を行い、1つのmRNAに複数のリボソームが同時に結合することもある[19]。真核細胞に存在するRNAのほとんどはrRNAである。
転移メッセンジャーRNA(tmRNA)
転移メッセンジャーRNA(transfer-messenger RNA、tmRNA)は、多くの細菌およびプラスチドに存在する。これは、終止コドンを持たないmRNAにコードされたタンパク質の分解を促すよう標識し、リボソームの停止を防ぐ[33]。
調節RNA
遺伝子発現に関する最も初期の調節因子として知られていたのは、リプレッサー(抑制因子)およびアクティベーター(活性化因子)と呼ばれるタンパク質であった。これらは、調節対象となる遺伝子近傍にあるエンハンサー領域内の特異的な短い結合部位に作用する調節因子である[34]。後の研究により、RNAも遺伝子の調節に関与することが明らかとなった。
真核生物では、RNA依存性プロセスが複数存在し、遺伝子発現のさまざまな段階でこれを制御している。たとえば、RNA干渉は転写後に遺伝子を抑制し、長鎖非コードRNAはクロマチン領域をエピジェネティックに不活性化する。また、エンハンサーRNAは遺伝子発現を促進する働きを持つ[35]。さらに、細菌および古細菌でも、細菌低分子RNAおよびCRISPRのようなRNAベースの制御システムが存在することが示されている[36]。
マイクロRNA(miRNA)および低分子干渉RNA(siRNA)
多くの遺伝子では、転写後の発現レベルがRNA干渉によって制御されている。この過程では、miRNAという特定の低分子RNAが、標的mRNAの一部領域と塩基対を形成して翻訳を抑制する[37]。RNA干渉は、RNA誘導サイレンシング複合体(RISC)によって行なわれる。RISCは、miRNAをガイドとして利用し、相補的mRNAに結合してそれを分解するかまたは翻訳を阻害する[38]。
長鎖非コードRNA(lncRNA)
→「長鎖ノンコーディングRNA」も参照
調節機能と関連付けられた次のRNAは、Xistを初めとするX染色体の不活化に関与する長鎖非コードRNA(lncRNA)である。これらの役割は当初不明であったが、Jeannie T. Leeらの研究により、ポリコーム複合体を動員してクロマチン領域を不活性化し、その領域からのmRNA転写を抑止する機構が明らかにされた[39]。現在、lncRNAは、200塩基対以上の長さで、コード能力を持たない(翻訳されない)RNAとして定義されているが[40]、幹細胞の多能性や細胞分裂の制御などにも関連することが明らかになっている[40]。
エンハンサーRNA
→「エンハンサーRNA」も参照
調節RNAの三番目の主要なグループとして、エンハンサーRNAが知られている[40]。これがさまざまな長さのRNAからなる独自したカテゴリーなのか、それともlncRNAの一種なのかは現時点では明確ではない。いずれにせよ、エンハンサーRNAは、制御対象の遺伝子近傍に位置するエンハンサーという既知の調節領域から転写される[40][41]。これらのRNAは、自らが転写されたエンハンサーが制御する遺伝子(群)の転写を促進する[40][42]。
原核生物の低分子RNA(sRNA)
→「sRNA」および「細菌のsRNA」も参照
当初、RNAによる遺伝子調節は真核生物に特有の現象と考えられていた。これは、高等生物において、予測以上に多くの転写が観察される理由の一つとされたためである。しかし、研究者が細菌におけるRNA調節因子の可能性を探り始めると、すぐに細菌にも小さな調節RNA、すなわち低分子RNA(small RNA、sRNA)が発見された[43][36]。現在では、RNAを用いた遺伝子制御システムが生物全体に普遍的に存在することが明らかとなり、RNAワールド仮説を支持する証拠ともされている[35][44]。
腸内細菌のsRNAは、さまざまな細胞プロセスに関与していると考えられており、膜ストレス、飢餓ストレス、リン酸糖ストレス、DNA損傷などのストレス応答において重要な役割を果たしている可能性がある。また、sRNAは反応速度や安定性といった動的特性により、生理的状態の迅速な適応と安定化を可能にするため、ストレス応答において重要な役割を担うよう進化してきたと考えられている[4]。
細菌のsRNAは、通常、mRNAとのアンチセンス対合を介して機能し、mRNAの安定性やcis結合能に影響を与えることで翻訳を抑制する[35]。また、リボスイッチと呼ばれる調節RNA配列も発見されており、これらは代謝産物と結合して構造変化を起こし、クロマチンへの結合能力を獲得または喪失することで、アロステリックに遺伝子発現を制御する[45][46]。
CRISPR RNA
→「CRISPR」も参照
古細菌においても、RNAによる調節システムが存在する[47]。CRISPRシステムは、近年DNAのin situ編集に応用されているが、本来の役割は古細菌および細菌において、RNAを介してウイルスなどの外来DNAの侵入を防御することである[35][48]。
Remove ads
RNAの合成と転写後プロセシング
要約
視点
合成
→詳細は「転写 (生物学)」を参照
RNAの合成は、通常、細胞核内で行われる。DNAを鋳型として、RNAポリメラーゼと呼ばれる酵素がこの反応を触媒する。この過程は転写と呼ばれる。転写は、RNAポリメラーゼ酵素がDNA上のプロモーター配列(通常は標的遺伝子の「上流」に位置する)に結合することで開始する。続いて、ヘリカーゼ酵素の活性によってDNAの二重らせん構造が解かれる。その後、RNAポリメラーゼは鋳型鎖に沿って3'から5'の方向に移動しながら、それに相補的なRNA鎖を合成する。DNAの配列は、RNA合成がどこで終結するかも決定する[49]。
一次転写産物として得られたRNAは、多くの場合、転写後に酵素によって修飾を受ける。たとえば、真核生物のmRNA前駆体(pre-mRNA)には、ポリ(A)テールと5’キャップが追加され、イントロンはスプライソソームによって除去される。
また、RNAを鋳型として新しいRNA鎖を合成するRNA依存性RNAポリメラーゼも多数存在する。たとえば、ポリオウイルスのようなRNAウイルスは、この種類の酵素を用いて自身の遺伝物質を複製する[50]。さらに、RNA依存性RNAポリメラーゼは、多くの生物におけるRNA干渉経路(RNA interference pathway)にも関与している[51]。
前駆体から成熟RNAへの加工

多くのRNAは、他のRNAの修飾に関与している。たとえば、pre-mRNAからのイントロンの除去は、複数の核内低分子RNA(small nuclear RNA、snRNA)を含むスプライソソームによって行われる[7]。また、イントロン自体がリボザイムとして自己スプライシングする場合もある[52]。
RNAは、構成ヌクレオチドがA、C、G、U以外の化学構造に修飾されることによっても改変される。真核生物では、このようなRNAヌクレオチドの修飾は、一般に核小体やカハール体に存在する低分子核小体RNA(small nucleolar RNA、snoRNA。60–300塩基)によって誘導される[24]。snoRNAは酵素と結合し、標的RNAと塩基対を形成することで酵素を特定部位に誘導する役割を担う。その後、酵素がヌクレオチドを修飾する。
rRNAおよびtRNAは特に高頻度で修飾されるが、snRNAとmRNAも塩基修飾の対象となることがある[53][54]。また、RNA分子がメチル化されることもある[55][56]。
化学修飾

RNAはアデニン、シトシン、グアニン、ウラシルの4種類の塩基によって転写されるが[57]、RNAが成熟する過程で、これらの塩基およびリボースが多様な修飾を受けることがある。代表的な修飾には、ウラシルとリボース間の結合がC–N結合からC–C結合に変化したシュードウリジン(Ψ)や、リボチミジン(T)があり、tRNAのTΨCループに頻出する[58]。もう一つの代表的な修飾塩基はヒポキサンチンで、これはアデニン塩基が脱アミノ化されたもので、そのヌクレオシドはイノシン(I)と呼ばれる。イノシンは、遺伝暗号のゆらぎ仮説において重要な役割を果たしている[59]。
100種類を超える天然の修飾ヌクレオシドが同定されており[60]、中でもtRNAでは最も多様な構造的修飾が見られる[61]。一方、rRNAにはシュードウリジンおよび 2'-O-メチルリボースを含むヌクレオシドが多く見られる[62]。RNAにおける、これらの修飾の多くについて、その機能は詳細に解明されていないもののリボソームRNAでは、多くの転写後修飾がペプチジルトランスフェラーゼ中心[63]やサブユニット界面など、機能的に重要な領域に集中していることが知られており、これらの修飾が正常な機能に寄与していると考えられている[64]。
遺伝学と進化的側面
RNAゲノム
DNAと同様に、RNAも遺伝情報を運ぶことができる。RNAウイルスのゲノムは、複数のタンパク質をコードするRNAで構成されている。これらのタンパク質の一部はウイルスゲノムの複製を担い、他のタンパク質は、ウイルス粒子が新たな宿主細胞へ移動する際にゲノムを保護する。ウイロイドは別の病原体群であり、RNAのみから構成され、タンパク質をコードせず、宿主植物細胞のポリメラーゼによって複製される[65]。
逆転写
逆転写ウイルスは、自らのRNAからDNAコピーを逆転写し、そのDNAコピーを鋳型として新たなRNAを転写することでゲノムを複製する。レトロトランスポゾンもDNAとRNAを相互にコピーすることで拡散する[66]。また、テロメラーゼには、真核生物の染色体末端を形成する際の鋳型として利用されるRNAが含まれている[67]。
二本鎖RNA(dsRNA)

→詳細は「二本鎖RNA」を参照
二本鎖RNA(dsRNA)は、2本の相補的な鎖からなるRNAで、すべての細胞に見られるDNAに類似しているが、チミンがウラシルに置き換えられ、酸素原子が1つ多いという違いがある。dsRNAは、一部のウイルス(二本鎖RNAウイルス)の遺伝物質を構成する。ウイルスRNAやsiRNAなどのdsRNAは、真核生物ではRNA干渉を、脊椎動物ではインターフェロン応答を引き起こすことがある[68][69][70][71]。真核生物においては、dsRNAはウイルス感染に対する自然免疫系の活性化にも関与している[72]。
環状RNA(circRNA)
→詳細は「環状RNA」を参照
1970年代後半、動植物界全体において、共有結合で環状に閉じた一本鎖RNA、すなわち環状RNA(circRNA)が存在することが示された[73]。circRNAは、スプライソソームが上流の3'アクセプター部位と下流の5'ドナースプライス部位を結合するバックスプライス反応(back-splice reaction)によって生じると考えられている。circRNAの機能は大部分が未解明であるが、いくつかの例では、マイクロRNAを吸着するcircRNAのスポンジング活性が示されている[74]。
Remove ads
前生物化学と生命の起源
RNAワールド仮説
→詳細は「RNAワールド仮説」を参照
1968年、カール・ウーズは「RNAワールド仮説」を提唱し、遺伝情報の担体であると同時に触媒としても機能した可能性があると示唆した[75][76]。2022年5月には、初期地球に存在したと推定される玄武岩質の溶岩ガラス上で、RNAが自発的に形成されることが発見された[77][78]。
RNA前駆体の宇宙空間における検出と生成
2015年3月、隕石中にも含まれるピリミジンなどを出発物質として、ウラシル、シトシン、チミンを含むDNAおよびRNAの核酸塩基が、宇宙空間を模した実験室の条件下で生成されたことが報告された。ピリミジンは、多環芳香族炭化水素と同様に、宇宙で最も炭素含有量の高い化合物の一つであり、赤色巨星や宇宙塵、ガス雲で形成された可能性がある[79]。さらに2022年7月、天文学者は、銀河系の中心部でRNAの前駆体の可能性がある大量の前生物分子 (en:英語版に詳しい) を検出したと報告した[80][81]。
Remove ads
医療への応用
RNAは半減期が短いことから当初は治療への利用が難しいとされていたが、分子安定化技術の進歩により、その有用性が高まっている。RNAが複雑な立体構造をとることで、タンパク質、核酸、低分子と相互作用しながら触媒中心を形成することから、治療への応用が期待されている[82]。
RNAワクチン
RNAベースのワクチンは、不活性化または弱毒化した病原体に基づく従来型よりも短期間で製造可能と考えられている。その理由は、従来の開発では病原体を培養・解析して、ワクチンに使用する分子部位を特定・不活化したうえでワクチン化するまでに数ヶ月から数年を要する場合があるのに対し、RNAワクチンはこのプロセスを大幅に短縮できるからである。
mRNAワクチンは、mRNAを使用して免疫応答を誘発するタンパク質を体内で作らせる新たなワクチンであり、その最初の大規模な成功例は、COVID-19パンデミック中のCOVID-19ワクチンの導入であった。
RNA標的低分子
これまでに承認された治療用低分子の中には、RNAあるいはDNAの構造を標的とすることで、新たな疾患の治療が可能になるものもある。しかし、RNAを標的とする低分子を扱う研究は限られ、ヒト疾患に適応される承認薬も少ない。その例として、リバビリン、ブラナプラム、アタルレンがあり、これらは二本鎖RNA構造を安定化させ、さまざまな疾患におけるスプライシングを制御するのに用いられる[83][84]。
IVT‑mRNA
一方、タンパク質をコードするmRNAは新たな治療候補として注目されており、特にRNA置換法は短期間で大量のタンパク質発現を可能にする[85]。in vitro転写mRNA(In vitro transcribed mRNAs、IVT-mRNA)は、動物モデルにおいて骨再生、多能性や心臓機能改善のためのタンパク質の送達手段として利用されている[86][87][88][89][90]。
siRNA
また、siRNAは、ウイルスに対する生体防御やクロマチン構造の制御に重要な役割を果たしている。これらを人工的に導入することで、特定の遺伝子発現を抑制でき、遺伝子機能の研究、治療標的の検証、創薬などに応用されている[85]。
Remove ads
歴史的発見と重要な研究成果
要約
視点
→詳細は「RNA生物学の歴史」を参照
→「遺伝子 § 歴史」も参照

RNAの研究は、多くの重要な生物学的発見と数々のノーベル賞につながった。1868年、フリードリッヒ・ミーシェルは核酸を発見し、その存在が細胞核内で見られたことから「nuclein(ヌクレイン)」と名付けた[91]。その後、核を持たない原核細胞にも核酸が存在することが明らかになった。1939年には、RNAがタンパク質合成に関与している可能性が示唆された[92]。1958年に、Hubert Chantrenne は、タンパク質合成におけるメッセンジャーとしてのRNAの役割を解明した[93]。
1959年には、セベロ・オチョアが、実験室でRNAを合成できる酵素を発見し、ノーベル医学賞を受賞した(DNA合成酵素を単離したアーサー・コーンバーグと共同受賞)[94]。ただし、当初RNA合成酵素と考えられたポリヌクレオチドホスホリラーゼ)は、後にRNA分解に関与する酵素であることが分かった。1956年には、Alex Rich と David Daviesが、2本のRNA鎖をハイブリダイズさせ、X線結晶構造解析で解析可能なRNA結晶を初めて作成した[95]。
1965年、ロバート・W・ホリーは、酵母tRNAの77ヌクレオチドの配列を決定し[96]、1968年にハー・ゴビンド・コラナ、マーシャル・ニーレンバーグと共にノーベル医学賞を受賞した。
1970年代初頭には、レトロウイルスと逆転写酵素が発見され、RNAがDNAに複製されうることが示された(遺伝情報伝達の通常の流れと逆)。この功績により、デビッド・ボルティモア、レナート・ドゥルベッコ、ハワード・テミンが1975年にノーベル賞を受賞した。続く1976年に、ウォルター・ファイヤーズ(Walter Fiers)と研究チームが、バクテリオファージMS2というRNAウイルスの全ゲノムのヌクレオチド配列を初めて解読した[97]。
1977年には、イントロンとRNAスプライシングが哺乳類のウイルスと細胞遺伝子の両方において発見され、これにより1993年にフィリップ・シャープとリチャード・ロバーツがノーベル賞を受賞した。1980年代初頭には、触媒RNA分子(リボザイム)が発見され、1989年にトーマス・チェックとシドニー・アルトマンがノーベル賞を受賞した。1990年には、ペチュニア植物(Petunia)において、導入された遺伝子が植物自身の類似遺伝子をサイレンシングできる現象が発見され、現在これはRNA干渉によるものとされている[98][99]。
ほぼ同時期に、現在マイクロRNAと呼ばれている22塩基長のRNAが、カエノラブディティス・エレガンス(Caenorhabditis elegans) の発生に関与していることが発見された[100]。2006年には、アンドリュー・ファイアーとクレイグ・メローがRNA干渉の発見によりノーベル生理学・医学賞を受賞し[101]、ロジャー・コーンバーグが真核生物の転写の分子的基盤の研究によりノーベル化学賞を受賞した[102]。
遺伝子調節RNAの発見に伴い、siRNAなどによる遺伝子発現を抑制するRNA医薬品開発も試みられるようになった[103]。2009年には、リボソームの原子レベルでの構造解析により、ヴェンカトラマン・ラマクリシュナン、トマス・A・スタイツ、アダ・ヨナスがノーベル賞を受賞した。2023年には、SARSコロナウイルス2(COVID-19)に対するmRNAワクチン開発を可能にした修飾ヌクレオシドの発見により、カリコー・カタリンとドリュー・ワイスマンがノーベル生理学・医学賞を受賞した[104][105][106]。
Remove ads
参照項目
- RNAウイルス - リボ核酸(RNA)を遺伝物質とするウイルス
- RNAベースの進化 - RNAが表現型の決定に独立した役割を果たすという理論
- RNAワールド仮説 - 地球上の生命進化の初期段階における仮説上の段階
- RNA学会 - リボ核酸(RNA)研究に関する国際的な科学学会
- RNA折り紙 - RNAのナノスケール折り畳み
- RNA生物学の歴史
- RNA生物学者の一覧
- アプタマー - 特定の標的分子に結合するオリゴヌクレオチドまたはペプチド
- ガイドRNA(Guide RNA:gRNA) またはシングルガイドRNA(single guide RNA:sgRNA) - 核酸編集に関与するRNAの一種
- デオキシリボ核酸(DNA) - 遺伝情報の輸送を担う分子
- トランスクリプトーム (en:英語版) - 細胞または細胞集団内のすべてのRNA分子の集合
- 非コードRNA(noncoding RNA:ncRNA)またはノンコーディングRNA - タンパク質に翻訳されない機能的なmRNAの一種
- 核内低分子RNA(snRNA)- 真核細胞の細胞核内に存在する低分子RNAの一種
- 核小体低分子RNA(snoRNA) - 他のRNA(主にrRNA、tRNA、snRNA)の化学修飾を誘導する小分子RNAの一種
- 核酸構造 - DNAやRNAなどの核酸の生物分子構造(一次構造~四次構造の解説)
- 生体分子構造 - 生物学的配列(DNA、RNA、タンパク質など)の3次元構造
- 高分子 - タンパク質などの非常に大きな分子
Remove ads
脚注
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
