トップQs
タイムライン
チャット
視点
H5N1亜型
ウィキペディアから
Remove ads
H5N1亜型(エイチごエヌいちあがた、英: Influenza A virus subtype H5N1)は、A型インフルエンザウイルスの亜型の一つであり、H5N1、A(H5N1) とも表記される。H5N1亜型内でも僅かな抗原性の違いによって少しずつ種類(クレード)の違うものであったりするが、一般的にH5N1亜型の形質を保っているものをまとめてH5N1と言う。
H5N1はトリ、ヒト、その他多くの動物においてインフルエンザを引き起こす[1]。高病原性トリインフルエンザ(HPAI)を引き起こす株はHPAI A(H5N1) と総称され、特に東南アジアの多くのトリの間でエピデミック(局地的流行)を起こしている(「鳥インフルエンザ」も参照)。HPAI A(H5N1) の変異株の1つがアジアで出現した後、現在では世界中に広がっている。また、ヒトの間で爆発的な感染に繋がる恐れのある新型インフルエンザへの変異が懸念されている。なお、2009年に発生した新型インフルエンザはH1N1亜型によるもので、これとは異なる。
動物間で流行が起こった場合、感染の疑いがある多くのトリやその他の動物を淘汰(殺処分)して流行を食い止める[2]。そのため、H5N1やトリインフルエンザはよくマスメディアに取り上げられる[3]。
Remove ads
概要
要約
視点
H5N1は主に野鳥の間で伝染する。H5N1を含むA型インフルエンザウイルスのいくつかの亜型(H7N7など)は鳥インフルエンザを引き起こす。トリインフルエンザは症状の程度により、高病原性トリインフルエンザ(HPAI)と、低病原性トリインフルエンザ(LPAI)に分けられる。宿主である野生の水鳥がHPAI株に感染した場合でも発症することはないが、家禽に感染した場合は患畜の多くが死亡する。LPAI株も主に野鳥の間で伝染するが、鳥類に感染した場合の症状は比較的軽いか発症しない。その他にも、ネコ科の動物、イヌ、ブタなどに感染した例がある。
1980年代になってから感染症は予防接種や抗生剤の服用によって治療することができるという、一種の危機感の薄れがあった。しかし、1997年、香港で本来人間に感染することはないとされていたH5N1型のトリインフルエンザが人間に感染した。このウイルスに18名が感染し、うち6名が死亡した。その後も、何度か人間に対して感染が起こっており、現在HPAIを引き起こすアジア株に感染した場合のヒトの死亡率は約60%である。世界保健機関(WHO)によると、2021年11月時点で累計863人が感染し456人が死亡している[4]。感染者は、ほぼ全てのケースにおいてトリと物理的接触をしたことが確認されている。ヒト同士の間で伝染、もしくはヒトに空気感染すると言う証拠は発見されていない。
また、その後の研究により過去のスペインかぜ(H1N1)、香港かぜ(H3N2)などのパンデミックはトリインフルエンザウイルスに由来するものであった可能性が高いという証拠が発見された。これは次のパンデミックもトリインフルエンザウイルスの変異によって現われる可能性が高いということを表している(ただしそれは強毒のH5N1ではない。H5N1は人間同士の感染力が弱いことが多いので、パンデミックにはなりにくい)。
多くのインフルエンザウイルスは増殖の過程で突然変異しやすいものであり、H5N1も例外ではない。さらに、このウイルスは同じトリインフルエンザウイルスであるH9N2と比べても世界規模で広範に家禽に流行しており、ウイルスの個体数から考えてもヒト感染型の変異体の発生の可能性はきわめて高いと考えられる。
また、突然変異でなくとも人間に感染したウイルスが体内でヒトインフルエンザウイルスと遺伝子再集合をした場合、高病原性を保持したまま人間同士での感染力の高いウイルスが生まれる可能性がある。
2005年9月、トリインフルエンザのアウトブレイクにより500万から1億5000万の死者が出る可能性があることが発表された[5][6]。 トリインフルエンザウイルスは進化を続け、パンデミックを起こすことが予想されている。この進化のスピードは当初の予想よりずっと速いものであった。
HPAI A(H5N1) はもともと致死率が高いことに加え、進化によって毒性も高くなりつつある。そのため、世界的なパンデミックに備えた対策が取られつつある[7]。
流行の際の致死率を下げることを目的として、プレパンデミック・ワクチンが開発された。しかし、プレパンデミック・ワクチンで感染を確実に抑えることが出来るかどうかは不明であり、実際に効果があるワクチンが製造出来るまでにはパンデミックが起こってから数ヵ月が必要である。変異株の出現後3か月以内に予防ワクチンの本格的な生産開始が望まれ、1年以内に10億人分のワクチンを用意することが要求されている[8]。
H5N1はトリの間で突然変異を続けることにより、人間の集団免疫(Herd immunity)の限界を超えて複数回のパンデミックを起こす可能性がある[9]。その遺伝子子孫によって起こるインフルエンザ・パンデミックでは、H5N1以外の亜型を含むことも考えられる[10]。
H5N1の遺伝子解析の結果、H5N1の遺伝子子孫によってパンデミックが起こった場合はスペインかぜより致死率が高くなると予想され、スペインかぜ以上の大規模なパンデミックになる可能性がある[11]。
Remove ads
遺伝学的解析
要約
視点

HPAI A(H5N1)の最初に発見された株はA/chicken/Scotland/59と呼ばれ、1959年にスコットランドで2つのニワトリの群れを病死させた。しかし、この株と現在流行している高病原性株との違いは非常に大きい。
2004年に主に流行したHPAI A(H5N1)は、1999年から2002年にかけてZ genotypeを持つように進化した[12]。これはアジア型HPAI A(H5N1)(Asian lineage HPAI A(H5N1))と呼ばれている。
アジア型HPAI A(H5N1)は抗原性によって2つのクレード(clade)に分けられる。
- クレード 1
- ベトナム、タイ、カンボジアでのヒトとトリからの分離株、およびラオス、マレーシアでのトリからの分離株。
- クレード 2
- 最初に中国、インドネシア、日本、韓国のトリから分離され、後に中東、ヨーロッパ、アフリカへ広がった。
WHOの発表では、2005年後半から2006年にかけてヒトへ感染したH5N1は主にクレード 2であった。
遺伝子解析により、クレード 2はさらに6つのサブクレードに分けられ、その内の地理的に異なった場所に分布している3つがヒトに感染した[13]。地図
2007年、EMAサブクレードの変異株についての研究が行われた。36の変異株の全ゲノム配列が解析され、現在存在するH5N1の遺伝子の解析が進んだ。この研究が行われる前にも、2004-2006年のヨーロッパの5つの株の全ゲノム配列の解析が行われていたが、中東と北アフリカの株については全ゲノムの解析は行われていなかった。
解析の結果、全てのヨーロッパ、中東、アフリカのサンプルは現代アジアのクレードとは別のクレードに分けられ、共通の祖先が1997年の香港株であることがわかった。図1(リンク先)はHA(ヘマグルチニン)によって分けられた系統発生樹であり、3つの型(lineage)が存在することが示されている。クレードの内2つはベトナムの分離株のみであり、5つの分離株が含まれている小さいクレードはV1、9つの分離株が含まれている大きなクレードはV2と名付けられた。残りの22株はヨーロッパ、中東、アフリカから分離されたものであり、EMAクレードに分類される[16]。
用語
分離されたH5N1の変異株には一定の条件で名前が付けられる。例として A/chicken/Nakorn-Patom/Thailand/CU-K2/04(H5N1) の命名法を説明する。
- A - インフルエンザウイルスの型(A、B、C)
- chicken - 変異株が発見された動物種
- Nakorn-Patom/Thailand - 変異株が分離された場所
- CU-K2 - 同じ場所で分離された他の株との区別
- 04 - 発見された年(2004年)
- H5 - ヘマグルチニンの種類
- N1 - ノイラミニダーゼの種類
他にも、A/duck/Hong Kong/308/78(H5N3)、A/avian/NY/01(H5N2)、A/chicken/Mexico/31381-3/94(H5N2)、A/shoveler/Egypt/03(H5N2)という風に命名される[17] 。
他のトリインフルエンザ・ウイルスと同様に、H5N1も高病原性(highly pathogenic:HP)と低病原性(low-pathogenic:LP)に分けられる。HPAIを起こすウイルスの毒性は非常に高く、感染した個体はほぼ100%死亡する。LPAIウイルスの毒性はそれほど高くはないが、このウイルスはHPAIウイルスの祖先である可能性がある。
世界中でトリを死亡させているH5N1はHPAI株である。その他の株はLPAI株であり、病気を引き起こさない北アメリカ株もこれに含まれる。現在確認されているHPAI株はH5亜型かH7亜型のものである。通常HPAIウイルスはヒトと野鳥のどちらか片方にのみ高い毒性を持っている。
遺伝子構造と亜型

H5N1はオルトミクソウイルス科A型インフルエンザウイルス属の亜型の一つであり、RNAウイルスである。ゲノムは8つの領域(PB2、PB1、PA、HA、NP、NA、M、NS)があり、マイナス一本鎖型RNAで構成されている。
HAは抗原性糖タンパク質であるヘマグルチニンをコードしている。ヘマグルチニンはウイルスの表面に存在し、感染する対象の細胞にウイルス結合させる働きがある。NAはグリコシダーゼの一種であるノイラミニダーゼをコードしている。ノイラミニダーゼは感染細胞からのウイルスの放出に関係している[18]。
→詳細は「インフルエンザウイルス」を参照
ヘマグルチニン(HA)やノイラミニダーゼ(NA)は抗ウイルス薬や抗体のターゲットとなるため、医学的に重要な要素である。H5N1はH(ヘマグルチニン)とN(ノイラミニダーゼ)の種類を表している。
A型インフルエンザは度々多数の死者を出す大流行を繰り返してきた。これまでパンデミックおよび小規模な流行を引き起こした、もしくは死者を出した主な亜型を死者の多い順に並べると以下のようになる。
パンデミック
- H1N1 - スペインかぜを引き起こした。「Aソ連型」としても知られ、現在は季節性インフルエンザを起こす。
- H2N2 - アジアかぜを引き起こした。
- H3N2 - 香港かぜを引き起こした。「A香港型」としても知られ、現在は季節性インフルエンザを起こす。
小規模な流行
低病原性H5N1
低病原性トリインフルエンザH5N1(LPAI H5N1)は北アメリカ株と呼ばれ、野鳥の間で伝染する。野鳥に感染した場合の症状は軽いか、全く出ないことが多いが、ヒトに及ぼす影響に関しては分かっていない。この株が家禽の間で伝染するようになった場合、伝染していく途中で突然変異を起こす可能性も考えられる。
- 1975年 – LPAI H5N1がウィスコンシン州で野生のマガモとアオハクガンから発見された。
- 1981年、1985年 – LPAI H5N1がミネソタ大学によってカモから発見された。
- 1983年 – LPAI H5N1がペンシルベニア州でオビハシカモメから発見された。
- 1986年 - LPAI H5N1がオハイオ州で野生のマガモから発見された。
- 2005年 - LPAI H5N1がカナダのマニトバ州でアヒルから発見された。
以前は州と大学が野鳥において調査したLPAI H5とH7のことを報告する義務がなかったため、上のリストでは昔のLPAI株のことが含まれていない可能性がある。後に国際獣疫事務局(OIE)はLPAI株のことも報告するように義務付けた。2006年、OIEはLPAI H5とH7が突然変異を起こす恐れがあるとして、確認された全てのLPAI H5とH7を報告するように求めた。そのため、USDAはあらゆる方面でこれらの株のことを調査している[20]。
Remove ads
H5N1の特性
要約
視点
伝染力
| 高病原性H5N1の伝染状況 | |
|---|---|
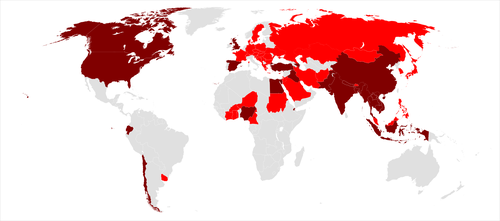 | |
| → H5N1によって家禽、野鳥が死亡した国 | |
| → H5N1によってヒト、および家禽、野鳥が死亡した国 | |
H5N1は野鳥に感染することによって世界中に広がる可能性がある。H5N1は突然変異と遺伝子の再集合を起こすことにより、今まで感染しなかったヒトなどの動物に感染するようになることも考えられる。
H5N1はトリの気道にあるガラクトース受容体の一種に結合する。このガラクトース受容体はヒトには存在しないタイプのものであるが、ヒトでは肺胞の内外でのみ増殖する。そのため、普通の伝達ルートである咳やくしゃみによっては放出されにくい[21][22][23]。
H5N1は主に家禽によって伝染する。家禽が直接移動した場合、鳥肉製品として流通した場合、鳥肉が試料や肥料として利用された場合などに感染が広がると考えられている。
ヒトがH5N1に感染した場合は、トリから伝染したケースがほとんどである。野生のカモ、アヒル、白鳥は発症することなくH5N1を運ぶことがある[24][25]。多くの哺乳類や鳥類はHPAI A(H5N1)に感染するが、水鳥が宿主としてどのような働きをしているかはわかっていない[26]。WHOは、肥料の表面に付着したH5N1が世界中に広がる可能性があることを報告した[27]。
毒性
突然変異によって様々な毒性を持つH5N1の株が誕生した。一つの動物種にしか病原性を持たないものや、様々な種に病原性を持つものなどが存在する。抗原ドリフトにより、同じクレードの中でも様々な毒性をもつ高病原性株が数十種類誕生したが、現在存在するものは全てgenotype Zに属する[28][29]。
1997年と2001年に香港で分離されたH5N1は、トリの間で伝染せず病気も引き起こさない株であった。2002年に香港のトリから新しい変異株が分離された。この株はカモに対して神経障害を起こして死亡させた[30]。Genotype Zは、2002年に既存の高病原性H5N1株からの遺伝子再集合によって誕生した[3][31][28][29]。Genotype Zにはヒトに感染することができるクレードが2つ存在し、東南アジアのトリの間でエンデミックを起こしている。突然変異はこのgenotypeの中で起こっている[32]。
伝染と宿主

H5N1に感染したトリは唾液、鼻の粘液、糞、血液などによってウイルスを伝染させる。他の動物はこれらのものに直接接触することによってH5N1に感染すると思われる。
H5N1は0℃で30日、37℃で6日、常温で数週間感染力を保つことが出来る。北極のような環境でも変化することはほとんどない。渡り鳥はH5N1の宿主の一つであり、世界中にウイルスを輸送する。H5N1はこれまで知られていた他の高病原性トリインフルエンザ・ウイルスと違い、家禽以外の動物によっても伝染する。
2004年10月、H5N1はそれまでの予想よりずっと危険なウイルスであることがわかった。水鳥が高病原性H5N1株をニワトリ、カラス、ハトなどに伝染させていることが判明した。さらにウイルス自体も哺乳類に対する感染力を強めていった。パンデミックを遅らせることは出来るが、完全に止めることは不可能であると予想されている。
1997年以降、H5N1の抗原性、遺伝子座が進化し続けていることが判明した。それによって、以前より広範囲の鳥類とネコ科の動物にも感染するようになった。病原性も強力になり、実験用のマウスとフェレットに全身症状を引き起こした。さらに環境に対する安定性も増加している[33]。
2007年8月22日、バリ島でのトリインフルエンザによる2人目の犠牲者として、28歳のニワトリ業者のインドネシア人が入院の4日後に死亡した。インドネシアにおける犠牲者は84人となった。地元の研究所の検査により、H5N1の陽性反応が出た [34]。
2007年9月29日、H5N1は妊婦の胎盤を通過して胎児に感染する可能性があることが判明した。さらに、ウイルスが肺だけでなく消化管、脳、肝臓、血球など全身に影響を与えることもわかった [35]。
高い変異率
インフルエンザウイルスはRNAウイルスであるため、突然変異率が高い。また、新たな変種が生まれる原因には、同じ宿主に2種類のインフルエンザ・ウイルスが感染した場合、ウイルス・ゲノムが分割されることによって遺伝子再集合が起こり、遺伝子組み換えが起こることがある[28][29]。これにより、病原性のなかった株がヒトに対して病原性を持つようになる可能性がある。
ある種の動物にのみ感染するという選択性は、主にウイルスが持っているヘマグルチニンの種類によって決まる。ヘマグルチニンのアミノ酸配列が1つでも変化すると、標的細胞への感染能力に大きな変化が起こる。トリインフルエンザにこのような変化が起こった場合、ヒトに容易に感染するようになることも考えられる[36]。
H3N2(豚インフルエンザ)はベトナムのブタから発見され、中国のブタの間で感染流行を起こしている。この亜型は新たな変異種が発生する恐れがある。2006年2月に流行したH3N2はアマンタジンとリマンタジンに対して耐性を示した。H5N1とH3N2が、遺伝子の再集合によって遺伝子交換を行うことが懸念されている。H5N1の中で遺伝子再集合が起こった場合はH5N1亜型のままであるか、亜型がシフト(抗原シフト)することも考えられる。H3N2はH2N2から抗原シフトによって進化した。
H2N2とH3N2のパンデミックを起こした株は、トリインフルエンザのRNA領域を持っている。1957年(H2N2)と1968年(H3N2)にパンデミックをおこした株は、ヒト由来ウイルスとトリ由来ウイルスが遺伝子再集合を行って誕生した株であった。1918年にスペインかぜを起こしたウイルスはトリ由来のものであったことが判明している[12]。
Remove ads
ヒトへの影響
要約
視点
H5N1が最初にヒトに感染したのは、香港のトリの間で大流行したのと同じ時期である。この時は香港市内のトリを全て処分することで流行を食い止めた。 感染経路は、感染した鳥やその排泄物、死体、臓器などに濃厚に接触することによってまれに感染することがある。日本では発症した人は確認されていない。[37]
症状
トリインフルエンザウイルスのヘマグルチニンはα2-3シアル酸レセプターに結合するが、ヒトインフルエンザウイルスのヘマグルチニンはα2-6シアル酸レセプターに結合する。ヒト型のH5N1は存在しないため、H5N1に感染したヒトは鳥型のH5N1に感染したことになる。
ヒトインフルエンザの一般的な症状は、発熱、咳、咽喉痛、筋肉痛、結膜炎などで、さらに重症化した場合は肺炎などを起こし死に至ることもある。症状の重さは感染者の免疫によって変化し、以前どのタイプのウイルスに感染したかによって大きく変化する。
高病原性H5N1は従来型のヒトインフルエンザと異なりウイルスの増殖部位が呼吸器系に限定されず全身の臓器において増殖する力がある。これは普通はHA基がヒトでは呼吸器にしか存在しないタンパク質分解酵素によって開裂(かいれつ)と呼ばれる2つに分かれる過程が必要とされるが、高病原性H5N1ではヒトの全身にあるタンパク質分解酵素で開裂が起きるためである。このことが、ヒトが高病原性H5N1に感染した場合の死亡率の高さとなると考えられている[38]。WHOの報告によると適切な治療を受けない場合の致死率は60%になるとされるが、トリインフルエンザに感染し、治療を行わない場合でも実際の死亡率がWHOの報告より低い可能性がある[39][40]。あるケースでは、H5N1に感染した男児が風邪のような症状を示さず、速やかに下痢を伴う昏睡状態に陥った[41]。
H5N1がヒトのサイトカイン濃度に影響を与えることが報告された。感染部位の組織の破壊と他のサイトカイン生産に関係するタンパク質の一種、TNF-α(腫瘍壊死因子α)の濃度がH5N1に感染することによって高くなる。インフルエンザウイルスによってサイトカインの濃度が上がることで、高い発熱、悪寒、嘔吐、頭痛などが起こり、組織の損傷がひどい場合は死に至ることもある[5]。
このような免疫系の正のフィードバックによるサイトカインの過剰生産はサイトカインストームと呼ばれ、H5N1に感染した場合は他のウイルスより激しく起こるのが特徴である[42]。従来のインフルエンザは高齢者のみが致命的なハイリスク・グループであるが、サイトカインストームによって、免疫力の強い若年層でも多数が致命的な症状に至る可能性が指摘されている[38]。しかし、スペインかぜではサイトカインストームは起きていなかったと言う研究者もおり、若年層で死亡率が高い原因はまだ十分に解明されてはいない。
予防と治療
H5N1に対する確実な治療法は存在しないが、オセルタミビル(タミフル)を投与することによってウイルスの増殖を抑制することができる。一部の国と組織は、オセルタミビルをH5N1に対する予防薬として使用するかどうかを検討した[43]。
WHOの専門家によれば、オセルタミビルの実際の効果はまだ調査中であり確実なことはわかっていない。ワクチンの製造も新しいウイルスの出現から6-9か月はかかると予測されている。過去90年の伝染病の例を見ても、ワクチンによって流行を止められるかどうかは疑わしい[44]。
H5N1のいくつかの株に対するワクチンがすでに存在する。しかしH5N1は継続的に変化し続けているため、ワクチンの使用は限られている。
H5N1に対するワクチンは由来とタイミングによって大きく2種類があり、今あるトリインフルエンザ・ウイルスを弱毒化するなどの手法で、実際のヒトへの感染流行前にあらかじめ作り置きしておく「プレパンデミックワクチン」と、ヒトへの感染流行が始まってからそのウイルスそのものからワクチンを作る「パンデミックワクチン」である。「プレ」ではヒトへの感染流行に対して最小の遅れで提供でき、事前に安全確認の時間も取れるなどの利点があるが、実際に流行するウイルス株とは異なるためにワクチンとしての効果は劣ると考えられている[38]。
H5N1が実際にパンデミックを起こすまでワクチンを作ることは出来ないが、プレパンデミックワクチンが開発された。さらにワクチンの製造会社にも、ワクチンを現状より大量に速く製造できるよう設備を拡大することが求められている[45][46][47][48]。
動物実験により、ザナミビル(リレンザ)がH5N1に効果的であることがわかった。2000年にマウスを使った実験によって、ザナミビルが他のトリインフルエンザウイルスであるH6N1、H9N2に感染した哺乳類にも効果があることが判明した[49]。
ザナミビルがH5N1のパンデミックに対して有効かどうかは定かではないが、タミフルとともにザナミビルを備蓄しておくことはパンデミックの対策になる可能性がある[50]。
2006年9月、WHOはタミフルとアマンタジンに抵抗を持った株を確認したことを発表した[51]。
近年ロンドンの研究所で行われた実験では、アイスランドの会社Zymetechで開発された酵素混合物を使用することにより、H5N1の99%を無力化することに成功した。この混合物は正常な細胞に影響を与えず、5分以内にウイルスを無力化することができる[52]。
薬品備蓄と医療体制
2008年初頭現在、アメリカ合衆国では2,700万人分のフランスサノフィパスツール社が開発したプレパンデミック・ワクチンを用意しているが、さらにアジュバントと呼ばれるグラクソ・スミスクライン社とノバルティス社が開発した物質によって必要な抗原量を12分の1程度まで減らせられる可能性がある。
2006年5月にインドネシアで大流行直前まで事態が進展した時点では、スイスのバーゼルにあるロシュ社本社と米国ニュージャージー州のWHO倉庫にはWHOが保管するタミフルがそれぞれ150万人分、計300万人分が全世界に向けた分として確保されていた。これは、パンデミックの発生初期に短期間・集中的に大量供給する事で感染を一地域に閉じ込めるため用意されている分である。
日本では2008年3月現在、2,000万人x2回分のプレパンデミック・ワクチンが原液の状態で準備されている。2008年内に感染症指定の医療関係者など5,561人にこのワクチンが投与され、内8人が何らかの異常によって入院した。2009年度からは安全性が確認されればという条件付ながら、パンデミック発生と同時に医療関係者や公務員、交通関係者などのライフライン従事者を中心に1,000万人に接種されることが決定されている。また、これ以降の将来に全国民に対する接種の必要性が検討されている。この決定以前は、国内でのヒト-ヒト感染が確認されてから初めて接種準備を始めることとなっていたので、原液の製剤化、1人2回の接種と免疫獲得までの2.5か月を考えれば、国際的にもかなり進んだ対策となっている。ただ、実際の大流行発生時には、発熱している患者を診察・収容する医療機関側の準備が実訓練ではほとんど行なわれておらず、医療関係者も感染を防ぐ対策が自分自身で確実と実感出来なければ参集しないのではないかという懸念がある。国や地方自治体のレベルでもパンデミックに対する対応準備は徐々に進められている。米国での一般住民を巻き込んだ大規模な予行演習レベルと日本の現状ではまだ差があり、薬以外の準備は「構想」だけかごく小規模に行なわれた「予行演習」に留まっている。
米国では、少なくともプレワクチン接種は広い駐車場に特設されたドライブスルーによって、接種者同士や医療関係者の感染リスクを最小にしながら10分以内ですべて終えて出てゆけるまでに準備が行なわれている。カリフォルニア州では学校に対する、感染の広がり、学校閉鎖の決定と伝達の手順や、生徒の退去手順、再開の手順などが含まれる7時間の研修コースが行なわれており、WebとDVDでもガイドが提供されている。CDCは最大12週間は生徒を学校に集めないように警告している。また、本格的な大流行によって、救命すべき患者が医療機関の能力を越えた時のことを考慮して、2005年11月に公表された米政府の「高齢者優先救命」方針に対して、全米の一般国民の、特に高齢者を中心とする多数からの「そう遠くない将来自然に老いて死ぬ我々より、むしろ未来のある幼年者・若年者を助けろ」という意見によって2007年10月に方針が180度変更された例など、全米規模でパンデミックに対する理解と準備が進んでいる。
日米とおそらくその他の国でも、人工呼吸器が不足する事が現時点で明らかになっているが、 数百万人や数千万人単位で発生する患者分の何割分かの台数の人工呼吸器を用意することは限られた医療予算では賄えないために、新規購入を増やす努力は行なわれていても、依然として不足することは今から明らかである。仮に、人数分が製造・購入できても、それを操作する医療従事者がいないという別の制約もある[38]。
人間社会への影響
H5N1によってヒトや動物が死亡するケースが出たため、人間社会に与えた影響は非常に大きい。
H5N1のパンデミックに対する研究には数億ドルの予算が費やされている。H5N1の被害によって10億ドル以上の損失があり、被害を抑えるために2億羽以上のトリが殺処分された。
パンデミック対策に個人で備蓄を行う人も出てきた。日本においてもパンデミック対策として、家から数週間出なくても生活できるように個人で食料などを備蓄しておくことが推奨されている。
しかし、H5N1のパンデミックをそれほど重大なことではないと考える意見もある。WHO公衆衛生当局者ロバート・ブラウンは次のように語っている。
ブラウンは、H5N1についてはまだわかっていないことが多くあると語っている。まだ完全に研究が完了したわけではないため、さらなる研究と国際的な連携が必要である[53]。
また、日本の北海道大学喜田宏教授もパンデミックの可能性には否定的である。
過去の3回のパンデミックはすべてブタからヒトへ伝播しており鳥のウイルスがヒトに広がることは、ごく限られたケースでしか起こらない。問題となっている鳥インフルエンザは判っているだけでも61ヶ国に広がっており、4年間に61ヶ国の内のわずか380人の感染者しか出ていないのは、ごく特殊な遺伝子を持ったヒトのみが感染しているとしか考えられない。わずかなヒト-ヒト感染のケースでもすべて親子兄弟間だけであり、遺伝子が異なる夫婦間での感染伝播は起こっていないのがそれを裏づけている。もし鳥インフルエンザがヒトに流行しても、致死率は0.5%を越えることはなく、全身でウイルス増殖が起こるとするのは間違いで、死亡した感染患者の全身からウイルスが検出されるのは呼吸器からあふれたウイルスの破片である[38]。
Remove ads
脚注
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads